Лабораторная работа 1. Лабораторная работа 1 титрование раствора щелочи раствором кислоты
 Скачать 19.71 Kb. Скачать 19.71 Kb.
|
|
Лабораторная работа №1 ТИТРОВАНИЕ РАСТВОРА ЩЕЛОЧИ РАСТВОРОМ КИСЛОТЫ Цель работы: ознакомление с мерной химической посудой и техникой выполнения отдельных операций лабораторной практики. Определение концентрации щелочи, вступающей в реакцию. Теория: титрование – определение содержания какого-либо вещества путем постепенного смешивания анализируемого раствора (например, кислоты) с контролируемым количеством реагента (например, щелочи). Конечная точка титрования (завершение химической реакции) устанавливается по изменению окраски химического индикатора. Титрование заключается в осторожном приливании (по каплям) раствора из бюретки в колбу с анализируемым раствором, который непрерывно перемешивают. Титрование ведут до изменения цвета индикатора. Колбу ставят на белый лист и проводят титрование. Если результаты титрования отличается друг от друга более чем на 0,1 мл, титрование повторяют. Ход работы: 1. Отберу в две конические колбы пипеткой по 10 мл раствора щелочи неизвестной концентрации. 2. Добавлю в каждую колбу 2-3 капли фенолфталеина и 30 мл дистиллированной воды. 3. Бюретку залью 0,1 н. раствором соляной кислоты и приведу её в рабочее положение. 4. Оттитрую приготовленный в двух колбах раствор NaOH 0,1 н. раствором соляной кислоты (до исчезновения розовой окраски). 5. По полученным данным рассчитаю концентрацию щелочи, используя закон эквивалентов для растворов: 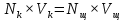 Результаты титрования
Вычисления: Vк = (V1+V2)/2 = (7,2+7,3)/2 = 7,25 мл Nщ = (Nк * Vк)/ Vщ = (0,1*7,25)/10 = 0,0725 Вывод: В ходе лабораторной работы я ознакомился с мерной химической посудой (мерный цилиндр, пипетка, бюретка, мерная колба) и оборудованием. Приобрел навык титрования раствора щелочи (NaOH) раствором кислоты (HCL), посчитал концентрацию щелочи, используя закон эквивалентов для растворов. Ответы на контрольные вопросы: 1. Мерные пипетки, мерные цилиндры, бюретки, мерные колбы. 2. Для грубого взвешивания (точность до 1 г); для точного взвешивания(технохимические весы точностью до 0,01 г); аналитические (точность до 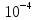 г). г).3. Технохимические весы имеют арретирное устройство и балансировочные гайки. При помощи арретирного устройства самые ответственные части весов - призмы и коромысло - в нерабочем состоянии отделяются и не касаются площадок. Это предохраняет призму от износа, а весы - от потери чувствительности. Для взвешивания на технохимических весах применяют точный разновес, представляющий собой набор граммовых и миллиграмовых гирь-разновесок, подобранных по десятичной системе. 4. 1) Перед взвешиванием проверяют, правильно ли по отвесу стоят весы: при правильной установке весов отверстие отвеса должно совпадать с вершиной конуса, находящегося у основания колонки. 2) Устанавливают нулевую точку весов. Для этого плавным поворотом арретира вправо приводят весы в рабочее состояние - дезориентируют и наблюдают колебания стрелки по нижней шкале. Если число делений при отклонении стрелки вправо и влево от центрального деления одинаково, то нулевая точка совпадает с центральным делением. Если же отклонения стрелки вправо и влево неодинаковы, то определяют среднее положение стрелки из трех - пяти показаний на шкале. Это положение стрелки и будет нулевой точкой весов. 3) Помещение или снятие взвешиваемого предмета и разновесок можно производить только при арретированных весах, т.е. когда весы находятся в нерабочем состоянии. 4) Взвешиваемый предмет следует помещать на левую чашу весов, разновески - на правую. Как взвешиваемый предмет, так и разновески следует помещать на середину чашки. 5) Сыпучие в-ва при взвешивании следует помещать на чашки весов в тиглях, бюксах или на листочках чистой бумаги 6) По окончании взвешивания весы следует привести в полный порядок и убрать разновески. 5. Суть титрования - определение концентрации растворов, путём измерения объемов растворов, вступающих в реакцию. 6.  7. . w=m(в-ва)*100%/m(р-ра) m(р-ра)=280+40=320г w=40*100%/320=12.5% 8. m(H2SO4)=w*m(р-ра)/100=400*50/100=200г m2(р-ра)=400-100=300г w2=200/300*100%=67% 9. M (HCl) = 1 + 35,5 = 36,5 г/моль Vm (HCl) = 22,4 л/моль m (HCl) = (36,5 х 67,2) : 22,4 = 109,5 г W = m(в-ва) / m(р-ра) х 100 %; 9 % = 109,5 г / m(р-ра) х 100 % 0,09 = 109,5 г / m(р-ра) m(р-ра) = 109,5 / 0,09 = 1217 г m (H2O) = 1217 г – 109,5 г = 1107,5 г Задачи для самостоятельного решения: 1. m(р-ра)=V*p m(р-ра)=100*1,14=114г m(H2SO4) = m(р-ра)*W/100 m(H2SO4)=114*0,2=22,8г m2(р-ра)=22,8*100/5=456г m(воды)=456-114=342г 2. m(HCl)=M1*M(HCl)*V= 2,3125г V=m(HCl)/M(HCl)*M2=2,3125/37*6=0,01041л=10,4мл 3. Nк=Vщ*Nщ/Vк=30*0,1/12=0,25 н. |
