лабораторные работы. Лабораторная работа 1а. Определение энтальпии диссоциации слабого электролита Оборудование и реактивы
 Скачать 1.91 Mb. Скачать 1.91 Mb.
|
Обработка экспериментальных данныхI. Определение точного значения концентрации слабого электролита 1. По данным таблицы 1 построить кривую кондуктометрического титрования, которая будет иметь вид, показанный на рис. 2 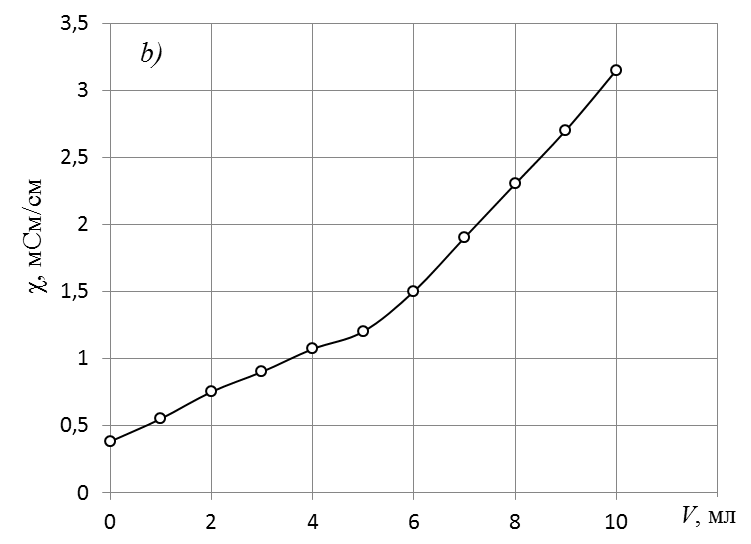 Рис. 2. Экспериментальная кривая кондуктометрического титрования. 2. Обработать графически кривую титрования, как показано на рис. 3. 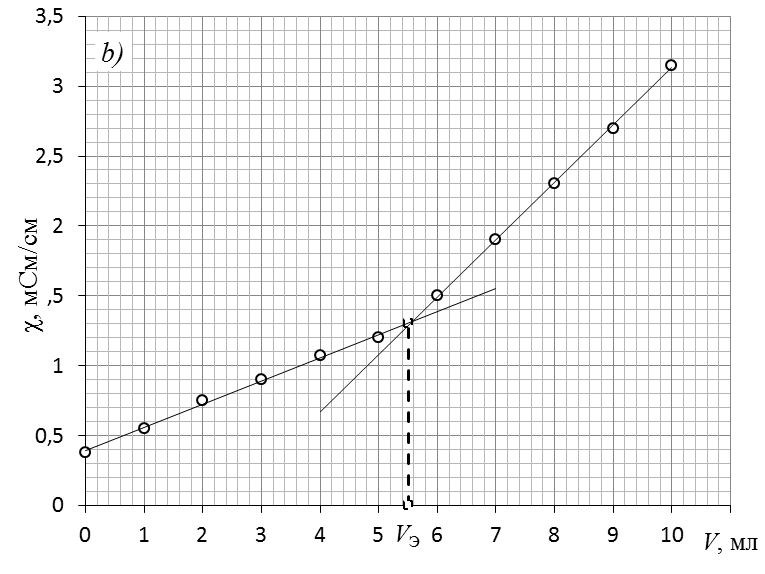 Рис. 3. Обработка экспериментальной кривой титрования и определение точки эквивалентности. 3. От места пересечения прямых опустить перпендикуляр с оси абсцисс и определить значение эквивалентного объема щелочи (см. рис. 3). 4. Точное значение концентрации слабого электролита вычислить по формуле: где VЭ – эквивалентный объем щелочи, определенный по кривой титрования, мл; СNaOH – концентрация раствора щелочи, экв./л; Va – объем аликвоты слабого электролита, мл. II. Определение константы и степени диссоциации слабого электролита Далее в расчетах используется точное значение концентрации слабого электролита, определенное в п. I. 1. Вычислить эквивалентную электропроводность каждого раствора по формуле: 2. Заполнить таблицу:
3. По данным таблицы построить графики зависимостей = f(C) и 1/λ = f(λС). 4. По графику 1/λ = f(λС) найти 1/λ∞ посредством экстраполяции зависимости на ось ординат 1/λ и вычислить λ∞. 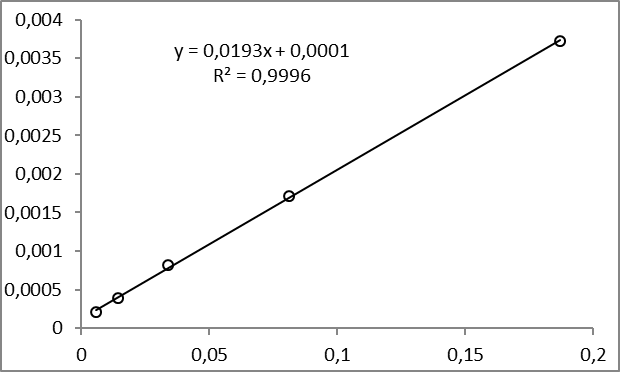 Полученное значение λ∞ сопоставить с данными [1]. При наличии сильного расхождения в дальнейших расчетах рекомендуется использовать справочные данные. 5. Рассчитать значение степени диссоциации по уравнению: 6. Вычислить значение константы диссоциации по уравнению: 7. Результаты вычислений занести в таблицу:
8. Среднее квадратичное отклонение σ рассчитывают по уравнению: 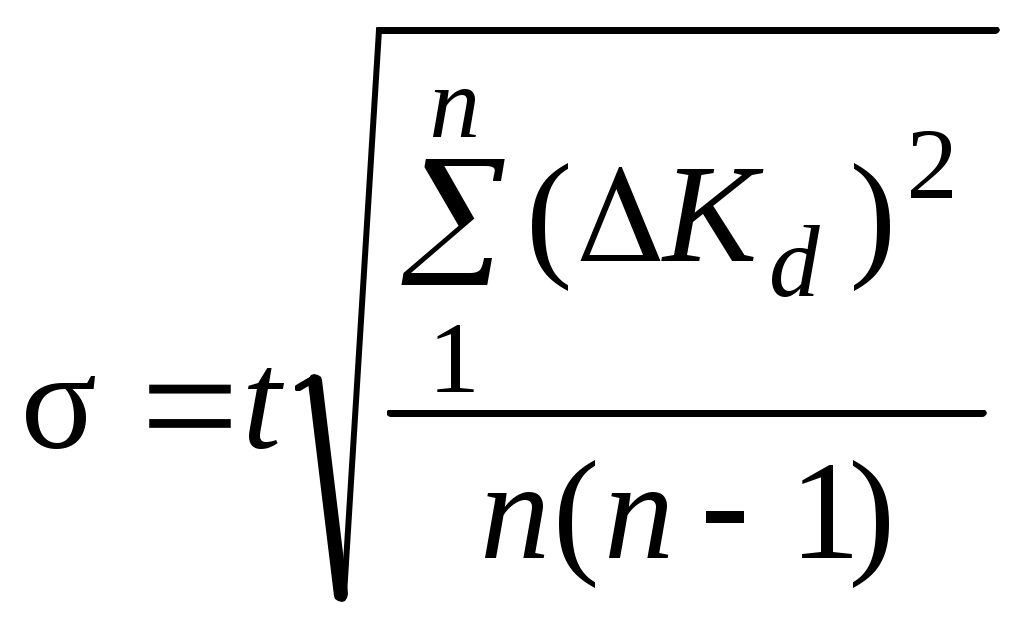 , , где t – коэффициент Стьюдента. Для доверительной вероятности 0,95 t = 3,2. 9. Окончательный результат представляют в виде: Kd = Kd среднее ± σ. | ||||||||||||||||||||||||||||||||||||||||||||||||||||
