лабораторные работы. Лабораторная работа 1а. Определение энтальпии диссоциации слабого электролита Оборудование и реактивы
 Скачать 1.91 Mb. Скачать 1.91 Mb.
|
Лабораторная работа № 6. Определение размера частицЦель работыопределение размеров дисперсных частиц, не подчиняющихся закону Рэлея. Сущность работыЭкспериментально измеряют кажущуюся оптическую плотность дисперсной системы при различных длинах волн (в достаточно узком интервале ) и строят график в координатах lgD – lg. Затем рассчитывают средний (наиболее вероятный) радиус частиц исследуемой дисперсной системы. Оборудование и реактивыФотоэлектроколориметр; кюветы стеклянные толщиной 1 см – 2 шт.; салфетки; электрическая плитка или колбонагреватель; круглая колба объемом 250 мл – 1 шт.; колба мерная объемом 200 мл – 1 шт.; пипетка мерная объемом 10 мл – 2 шт.; пипетка мерная объемом 1 мл – 2 шт.; стакан химический вместимостью 50 мл – 4 шт.; мерная пипетка объемом 10 мл – 1 шт.; хлорид железа (III) – раствор, концентрацией 2 %; гексацианоферрат (II) калия – раствор концентрацией 20 %; сульфат кобальта – раствор концентрацией 0,1 %; сульфат меди (II) – раствор концентрацией 10 % Выполнение работыI Получение золя Золь гидроксида железа (III) 1. В колбу с 250 мл кипящей воды мерной пипеткой прилить 10 мл раствора с массовой долей хлорида железа 2 %. 2. Образовавшийся золь, красно-коричневого цвета, охладить до комнатной температуры. Золь гексацианоферрата (II) кобальта (II). 1. В мерную колбу объемом 200 мл при помощи мерной пипетки поместить 1 мл раствора K4[Fe(CN)6] концентрацией 20 % 2. Довести дистиллированной водой до метки. 3. Колбу плотно закрыть пробкой. 4. Раствор тщательно перемешать, переворачивая колбу и встряхивая не менее 30 раз. 5. Раствор перелить в круглую колбу объемом 250 мл. 6. При помощи мерной пипетки вместимостью 10 мл медленно прибавить 10 мл раствора сульфата кобальта концентрацией 0,1 %. Образуется золь гексацианоферрата (II) кобальта (II) зеленого цвета. Золь гексацианоферрата (II) меди (II) 1. В мерную колбу объемом 200 мл при помощи мерной пипетки поместить 1 мл раствора K4[Fe(CN)6] концентрацией 20 % 2. Довести дистиллированной водой до метки. 3. Колбу плотно закрыть пробкой. 4. Раствор тщательно перемешать, переворачивая колбу и встряхивая не менее 30 раз. 5. Раствор перелить в круглую колбу объемом 250 мл. 6. Добавить при перемешивании 1 мл раствора сульфата меди (II) концентрацией 10 % Образуется золь гексацианоферрата (II) меди (II) красно-бурого цвета. II Проведение измерений 1. В кювету толщиной 1 см налить до метки дистиллированную воду и насухо протереть стенки кюветы кусочком фильтровальной бумаги. 2. Кювету с водой (раствор сравнения) поместить в среднее отделение кюветодержателя. 3. В другую кювету толщиной 1 см налить до метки пробу золя и насухо протереть стенки кюветы кусочком фильтровальной бумаги. 4. Кювету с золем поместить в ближнее отделение кюветодержателя. 5. Кюветодержатель поместить в кюветное отделение прибора. 6. Измерить оптическую плотность раствора при различных длинах волн в диапазоне от 350 до 600 нм с шагом 50 нм, следуя инструкции к пользованию прибором. Результаты измерений занести в таблицу. Содержание протокола лабораторной работыТаблица зависимости кажущейся оптической плотности от длины волны
Обработка результатов эксперимента1. Заполнить таблицу:
2. Построить график в координатах lg - lgD 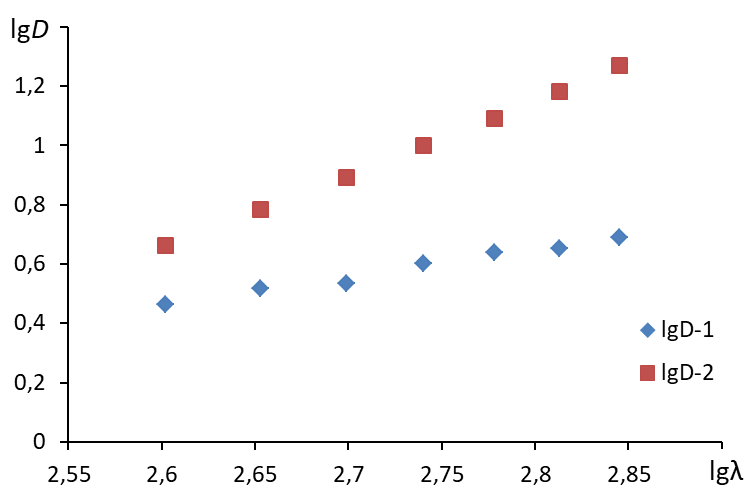 3. Построить линию тренда (формат линии тренда: аппроксимация – линейная, показывать уравнение на диаграмме, поместить на диаграмму величину достоверности аппроксимации R2) 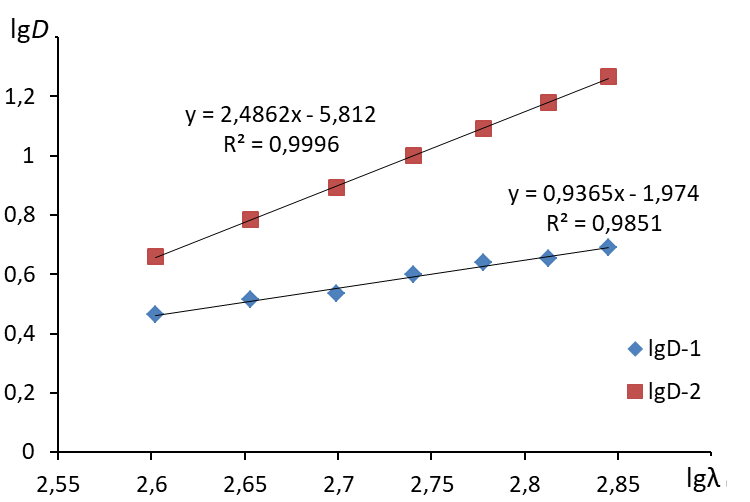 4. По угловому коэффициенту уравнения линии тренда определить величину n. 5. Определить среднее значение длин волн: 6. По уравнению 7. Рассчитать средний радиус частиц по формуле: Содержание отчета по лабораторной работе1. Название работы. 2. Цель работы. 3. Ход эксперимента. 4. Экспериментальные данные (см. протокол к лабораторной работе). 5. Обработка экспериментальных данных. 6. Вывод. |
