1. Рассчитайте молярность и моляльность 25% раствора хлорида кальция, плотность которого 1,19 гмл. Молярность
 Скачать 28.3 Mb. Скачать 28.3 Mb.
|
|
РУБЕЖНОЕ ТЕСТИРОВАНИЕ №2 вар.0 1. Рассчитайте молярность и моляльность 25% раствора хлорида кальция, плотность которого 1,19 г/мл. МОЛЯ́РНОСТЬ раствора, концентрация раствора, характеризуемая числом молей растворенного вещества в 1 л раствора. Берем 1 л такого раствора. Его масса равна 1000*1.19=1190 г. В нем содержится 25% СаCl2 т.е. 1190*0.25 =298 г СаCl2. Молекулярная масса СаCl2 = 40+35.5*2=111 Делим 298 на 111 и получаем 3 Молярность раствора = 3. Молярность - 3 моль/литр или 3 М Моляльность — количество растворённого вещества (число моль) в 1000 г растворителя. Измеряется в молях на кг. где:
Берем 1 л такого раствора. Его масса равна 1000*1.19=1190 г. В нем содержится 25% СаCl2 т.е. 1190*0.25 =298 г СаCl2. Молекулярная масса СаCl2 = 40+35.5*2=111 Делим 298 на 111 и получаем 3 То есть в литре такого раствора содержится 3 моля растворенного вещества СаCl2 а воды (растворителя) 1190 г-298 г=892 г воды. 3 моль СаCl2 - 892 г растворителя Х моль СаCl2 - 1000 г растворителя Х = 1000*3/892 =4 m Моляльность равна 4 m 2. Какой объем 3н раствора карбоната натрия надо взять для приготовления 2 л 0,25 М раствора? Нормальность раствора обозначает число грамм-эквивалентов данного вещества в одном литре раствора или число миллиграмм-эквивалентов в одном миллилитре раствора. Грамм - эквивалентом вещества называется количество граммов вещества, численно равное его эквиваленту. Для сложных веществ - это количество вещества, соответствующее прямо или косвенно при химических превращениях 1 грамму водорода или 8 граммам кислорода. Эоснования = Моснования / число замещаемых в реакции гидроксильных групп Экислоты = Мкислоты / число замещаемых в реакции атомов водорода Эсоли = Мсоли / произведение числа катионов на его заряд МОЛЯ́РНОСТЬ раствора, концентрация раствора, характеризуемая числом молей растворенного вещества в 1 л раствора. Иногда в лабораторной практике приходится пересчитывать молярную концентрацию в нормальную и наоборот. Если эквивалентная масса вещества равна мольной массе (Например, для HCl, KCl, KOH), то нормальная концентрация равна молярной концентрации. Так, 1 н. раствор соляной кислоты будет одновременно 1 M раствором. Однако для большинства соединений эквивалентная масса не равна мольной и, следовательно, нормальная концентрация растворов этих веществ не равна молярной концентрации. Для пересчета из одной концентрации в другую можно использовать формулы: M = (N · Э) / m N = (M · m) / Э Молекулярная масса Na2CO3 = 23*2+12+16*3=106 Э Na2CO3 = 106/2*1=53 2 – число катионов Na+ 1 – это заряд Молярная концентрация 3 н. Na2CO3 M = (3· 53) / 106 = 2 M. 2 л 0,25 М раствора содержат 106*0,25*2= 53 г Na2CO3 2 М раствор Na2CO3 содержит 106*2=212 г Na2CO3 в 1 литре раствора 53 г Na2CO3 содержатся в Х литре 2 М раствора Х=53*1/212= 0,25 л То есть, для приготовления 2 л 0,25 М нужно взять 250 мл 3 н. раствора Na2CO3 3. Какова энтальпия образования PbO, если при взаимодействии 6,21 г Pb с кислородом выделяется 6,57 кДж. Pb + ½ О2 = PbО Молекулярная масса Pb = 207 Если при взаимодействии 6,21 г Pb с кислородом выделяется 6,57 кДж, то энтальпия образования PbО будет равна х= 6,57*207/6,21= 219 кДж/моль Pb + ½ О2 = PbО    4. Не производя вычислений, установите знак S следующих процессов: а) 2 NH3(г) N2(г) + 3 H2(г) б) CO2(г) CO2 (тв)   а) 2 NH3(г) N2(г) + 3 H2(г) S>0 б) CO2(г) CO2 (тв)S<0 5. Напишите уравнения для определения скоростей следующих реакций а) А(г) + 2В(г) АВ2 б) А(тв) + 2В(г) АВ2 Как изменятся скорости этих реакций при увеличении давления в 3 раза?    а) А(г) + 2В(г) АВ2 ОТВЕТ: б) А(тв) + 2В(г) АВ2 ОТВЕТ: При увеличении давления в 3 раза концентрация реагирующих веществ возрастет в 3 раза, следовательно а) до изменения объема скорость реакции выражалась уравнением Сравнивая выражения для б) В случае б) ύ = k (3[B])2 = 9 k [B]2 скорость возрастет в 9 раз. 6. Напишите выражения Кравн для реакций 2 H2O(г) ↔ 2 H2 + O2 Н0р > 0 CaO(тв) + H2O(ж) ↔ Ca(OH)2(ж) Н0р < 0 Укажите, куда сместится равновесие в вышеприведённых реакциях при: а) увеличении давления б) охлаждении  В тексте опечатка перед словом ОТСЮДА должна быть еще буква D в квадратной скобке  
Кравн = [H2]2*[O2]/ [H2 O]2 равновесие сместится при: а) увеличении давления исходя из принципа Ле Шателье равновесие сместится в сторону исходных веществ, потому что в исходном уравнении 2 молей газа, а в продуктах реакции три. б) охлаждении 2 H2O(г) ↔ 2 H2 + O2 Н0р > 0 реакция идет с поглощением тепла При охлаждении равновесие сместиться в сторону исходных веществ. б) CaO(тв) + H2O(ж) ↔ Ca(OH)2(ж) Кравн = [Ca(OH)2]/ [H2 O]2 равновесие сместится при: а) увеличении давления исходя из принципа Ле Шателье система останется в равновесии, потому что и в левой и правой части реакции по 1 молю жид.веществ. Твердые во внимание не принимаются. б) охлаждении CaO(тв) + H2O(ж) ↔ Ca(OH)2(ж) Н0р < 0 реакция идет с выделением тепла При охлаждении равновесие сместиться в сторону продуктов реакции. 7. Напишите в ионно-молекулярной форме уравнения реакций: карбонат калия + соляная кислота хлорид аммония + гидроксид кальция сульфат цинка + избыток гидроксида калия Укажите, какие из этих реакций протекают практически необратимо и почему.  Дата на фото странная. Фотик д. Ромы. Он торопится жить. 8. Не производя расчётов, ответьте на поставленный вопрос Даны два раствора одинаковой молярной концентрации: селеноводородной и сероводородной кислот. рН этих растворов: а) одинаковы б) рН(H2Se) > pH(H2S) в) рН(H2Se) < pH(H2S) Ответ обосновать. Правильным является выражение в) рН(H2Se) < pH(H2S) Сера и селен являются элементами главной подгруппы VI группы. У их атомов на внешнем энергетическом уровне находится по 6 электронов: ns2np4. Следовательно, в соединениях с водородом они проявляют степень окисления – 2. С ростом порядкового номера элемента увеличивается радиус атома, что обусловливает уменьшение прочности соединения с водородом, увеличиваются кислотные свойства. 9. Рассчитайте рН 10-2М раствора HCl и 10-2М раствора NH4OH Сначала рассчитаем рН 10-2 М раствора HCl Соляная кислота – это сильная кислота, степень диссоциации почти равна 1 рН= - lg (10-2)= - (-2)= 2 рН 10-2М раствора HCl равно 2. Рассчитаем рН 10-2М раствора NH4OH  Запишем уравнение диссоциации гидроксида аммония: NH4OH<=> NH4+ + OH – Используя справочные данные константы диссоциации, найдем степень диссоциации 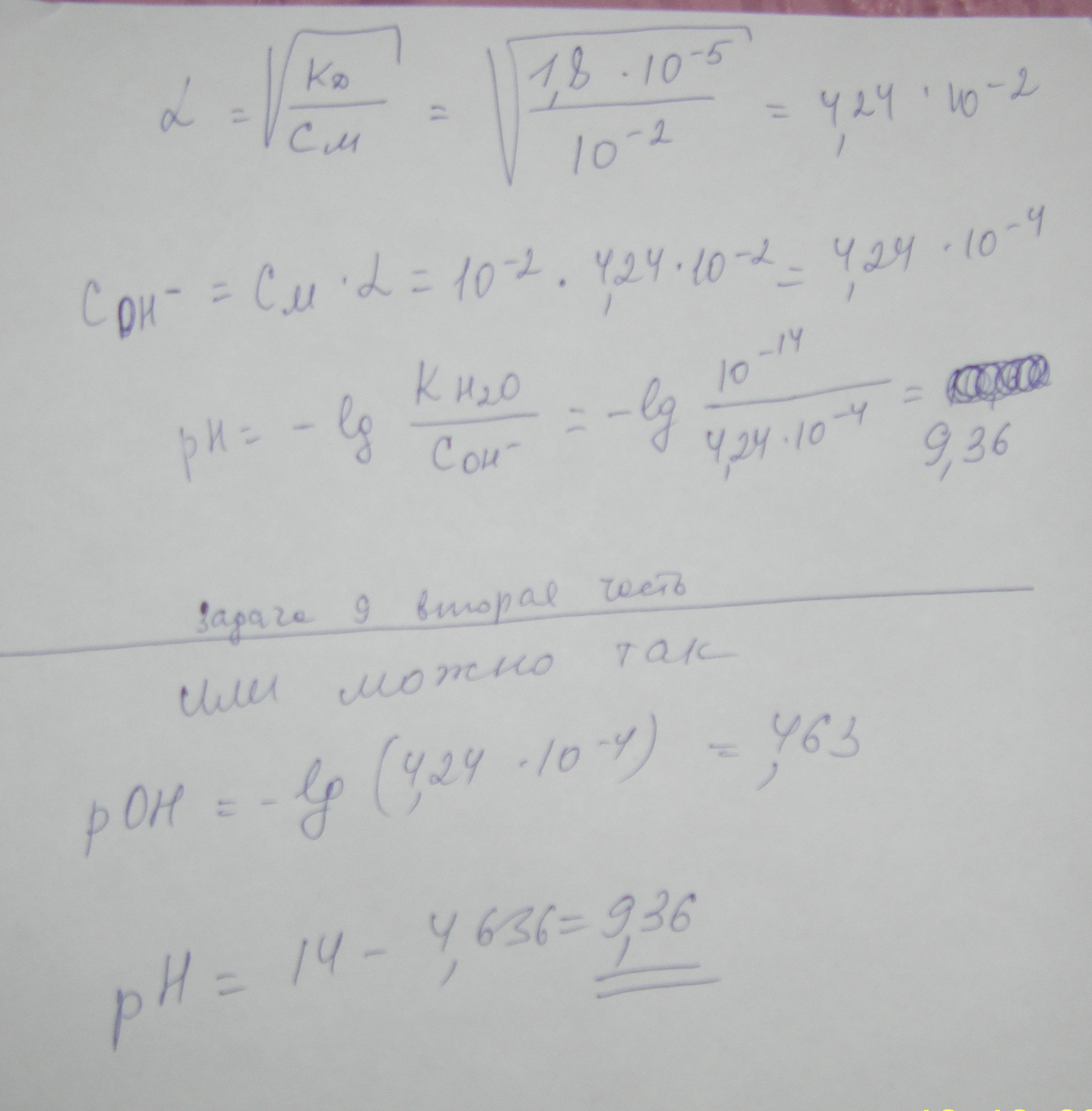 10. Какую среду имеют водные растворы сульфата натрия, сульфата железа (II), фосфата рубидия? Ответ подтвердите ионно-молекулярными уравнениями гидролиза этих солей. Гидролиз солей - это химическое взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита. Сульфат натрия Na2 SO4 – соль, образованная сильным основанием NaOH и сильной кислотой H2 SO4. Такие соли гидролизу не подвергаются, рН водного раствора =7. Сульфат железа (II) - соль, образованная слабым основанием и сильной кислотой (FeSO4) гидролизу подвергается катион: 2Fe SO4 + 2HOH =>[Fe(OH)] 2 SO4 + H2 SO4 2Fe2+ + 2SO4 2- + 2H+ + 2OH- => 2Fe(OH)+ + SO4 2- + 2Н+ + SO4 2- 2Fe2+ + 2H+ + 2OH- => 2FeOH+ + 2Н+ В результате гидролиза образуется слабый электролит, ион Н+ и другие ионы. рН раствора < 7 ( раствор приобретает кислую реакцию). 1-ая ступень 2Fe SO4 + 2HOH =>[Fe(OH)] 2 SO4 + H2 SO4 2Fe2+ + 2SO4 2- + 2H+ + 2OH- => 2Fe(OH)+ + SO4 2- + 2Н+ + SO4 2- 2-ая ступень [Fe(OH)] 2 SO4 + HOH =>Fe(OH)2 + H2 SO4 2Fe(OH)+ + SO4 2- + H+ + OH- =>Fe(ОН)2 + 2Н+ + SO4 2- В действительности по второй ступени реакция не пойдет из-за образующегося избытка ионов водорода сильной серной кислоты. Фосфат рубидия - Rb3PO4 это соль сильного основания (щелочи) RbOH и средней кислоты (фосфорной) H3PO4. Гидролиз соли идет по анионному типу, т.к. катион Rb+, связываясь с гидроксил-анионом OH¯, образует сильный электролит RbOH, который диссоциирует на ионы. Фосфорная трехосновная кислота образует три вида солей: RbH2PO4 –первичный фосфат Rb, хорошо растворимый Rb2HPO4 – вторичный фосфат Rb, практически нерастворимый Rb3PO4- третичный фосфат Rb, практически нерастворимый. Из этого ясно, что при гидролизе Rb3PO4, т.е. реакции, идущей до образования слабодиссоциирующей (плохорастворимой) соли, будет образовываться вторичный фосфат натрия Rb2HPO4. 1 ступень Ионно-молекулярное уравнение PO4¯³ + H2O ↔ HPO4¯² + OH¯ Молекулярное уравнение: Rb3PO4 + H2O ↔ Rb2HPO4 + RbOH 2 ступень Ионно-молекулярное уравнение Rb2HPO4 + H2O↔ H2PO4¯² +OH¯ Молекулярное уравнение Rb2HPO4 + H2O↔ RbH2PO4 + RbOH 3 ступень Ионно-молекулярное уравнение H2PO4¯+ H2O = H3PO4 + OH¯ Молекулярное уравнение RbH2PO4 + H2O = H3PO4 + RbOH Обычно реакция идет по первой ступени, далее накапливаются гидроксильные ионы OH¯ и не дают реакции идти до конца. Так как образуется кислая соль и сильное основание (щелочь), реакция раствора будет щелочная, т.е. pH>7. 11.Напишите краткое ионно-молекулярное уравнение гидролиза сульфита натрия, рассчитайте степень гидролиза (в %) и определите рН 10-2 М раствора этой соли. Na2SО3 – сульфит натрия соль, образованная сильным основанием NaOH и слабой кислотой H2SО3. Гидролиз протекает по анионному типу и включает две ступени: 1-ая ступень Nа2SО3 + HOH =>NаНSО3 + NаОН SО32- + 2Na+ + H+ + OH- =>НSО3- + ОН- + 2Na+ 2-ая ступень NаНSО3 + Н2О =>NаОН + Н2SО3 НSО3- + Na+ + H+ + OH- =>Н2SО3 + ОН- + Na+ в сокращенной ионной форме уравнение гидролиза запишется следующим образом: SО32- + Н2О ↔ НSО3- + ОН-  Константа гидролиза Кг рассчитывается с использованием справочных данных по формуле: 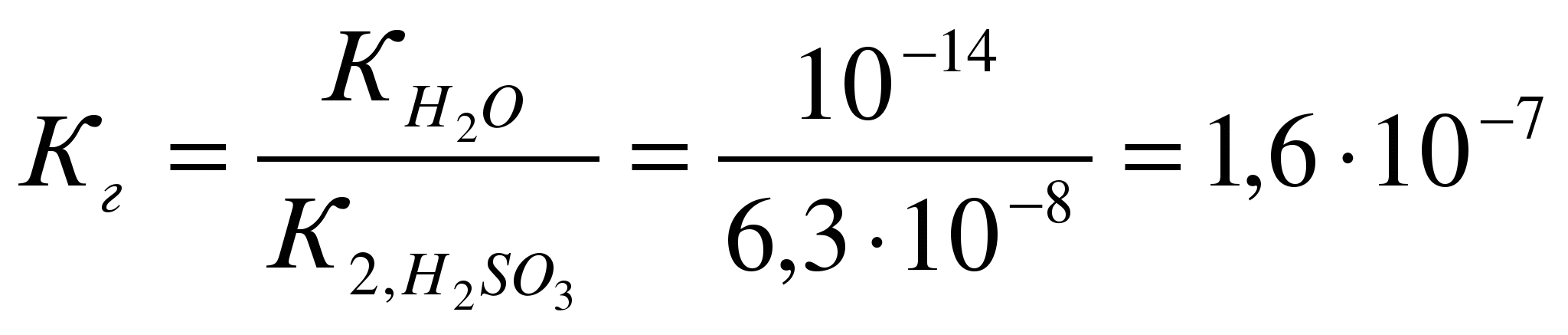 В соответствии с уравнением реакции 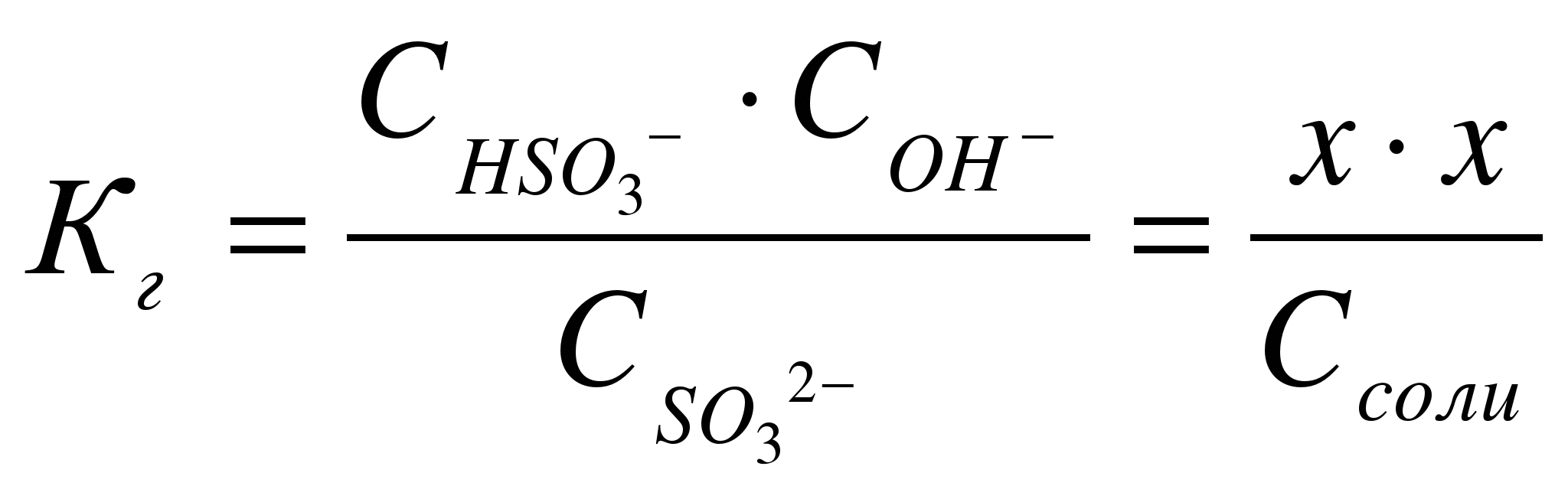 ; отсюда ; отсюда 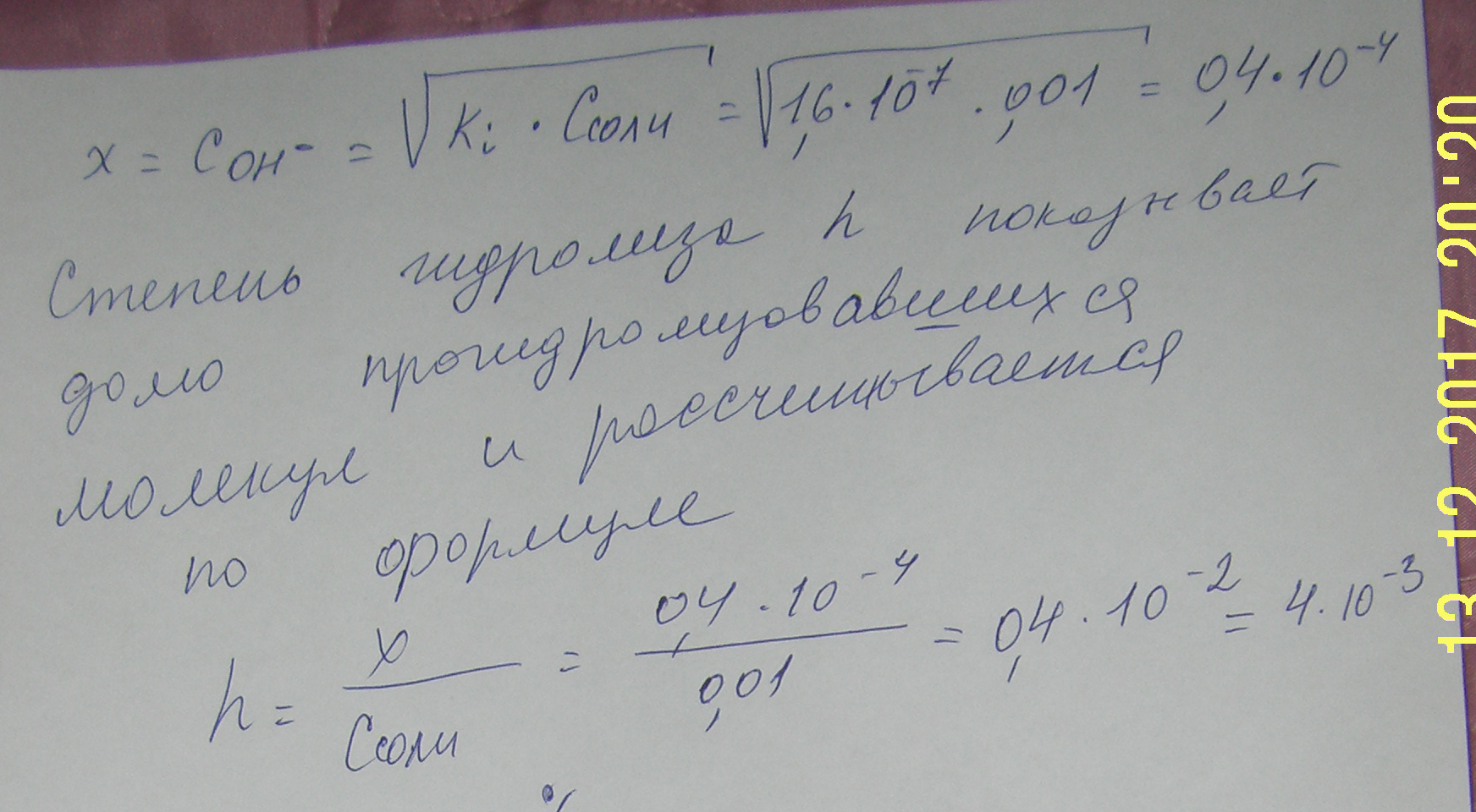 или 0,4% - степень гидролиза 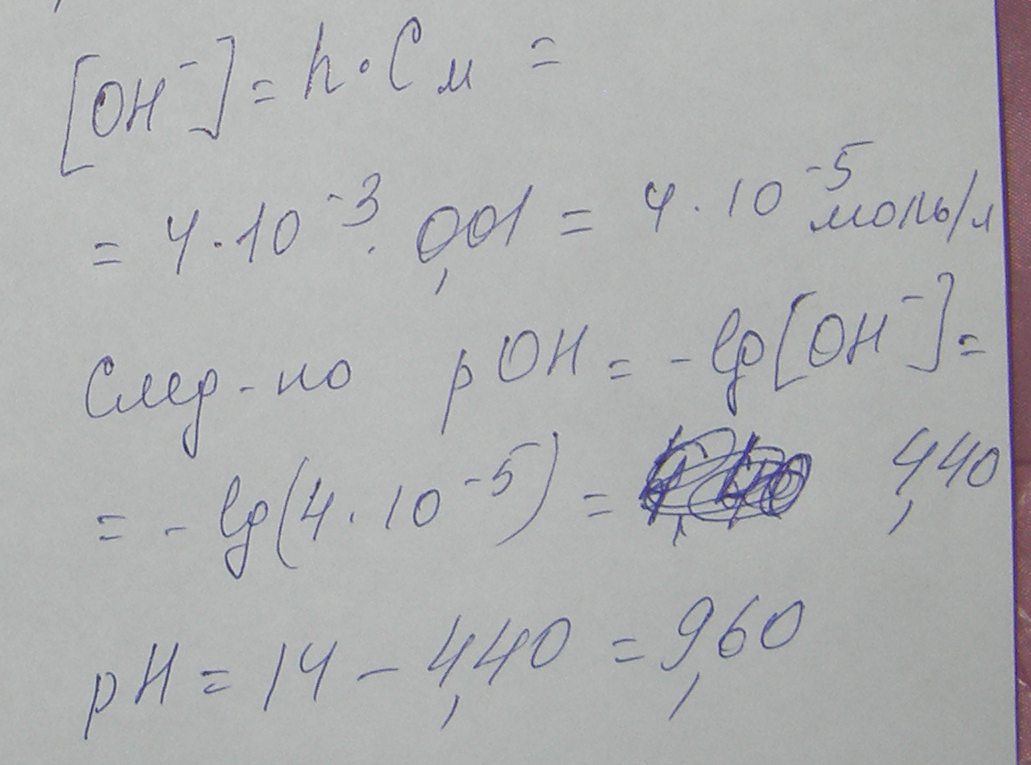 12. Выпадет ли осадок при сливании 700 мл 10-2 М раствора Pb(NO3)2 и 300 мл 10-4 М раствора KI? Ответ подтвердите расчетами.  Pb(NO3)2 + 2KI= Pb I2+ 2K NO3 Произведение растворимости иодида свинца = 8*10-9 Найдем молекулярную массу М (Pb(NO3)2 )= 207+14*2+16*3*2=331 г пренебречь М (KI )= 39+127=166 г Рассчитаем сколько Pb(NO3)2 находится в 700 мл 10-2 М раствора Задача написана карандашом 13. Определите объем воды, необходимый для растворения при 250С 2 г сульфата бария.  Произведение растворимости сульфата бария = 1,1*10-10 То есть для растворения 1,1*10-10 требуется 100 г воды, а для растворения 2 г 2*100/1,1*10-10 =181,82*1010 г воды или 1,82 *109 кг. Так как плотность воды =1, то объем воды также равен 1,82 *109 литров. 14. При растворении 5,0 г неэлектролита в 200 г воды раствор замерзает при -1,453оС. Ккр воды = 1,86. Рассчитайте молярную массу неэлектролита.  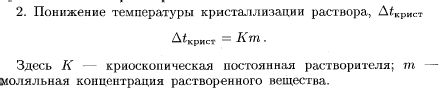 Из условия задачи находим: Из уравнения  Определяем моляльность раствора: 1,453=1,86*m m=1,453/1,86=0,781 моль на 1000 г воды. Из условия задачи следует, что 5,0 г неэлектролита растворено в 200 г воды. Так как мы имеем растворителя в 5 раза меньше, количество молей будет равно 0,781/5=0,156 моль. Масса 5 г соответствует 0,156 моль, мольную массу найдем из соотношения: М = 5 / 0,156=32,05 г/моль Молекулярная масса растворенного вещества равна 32 |
