СРСП 5. 3 Закон Лавуазье Лапласа Энтальпия образования вещества равна, но противоположна по знаку энтальпии его разложения
 Скачать 83.38 Kb. Скачать 83.38 Kb.
|
|
Занятие №5 расчеты. Химическая кинетика. Химическое равновесие 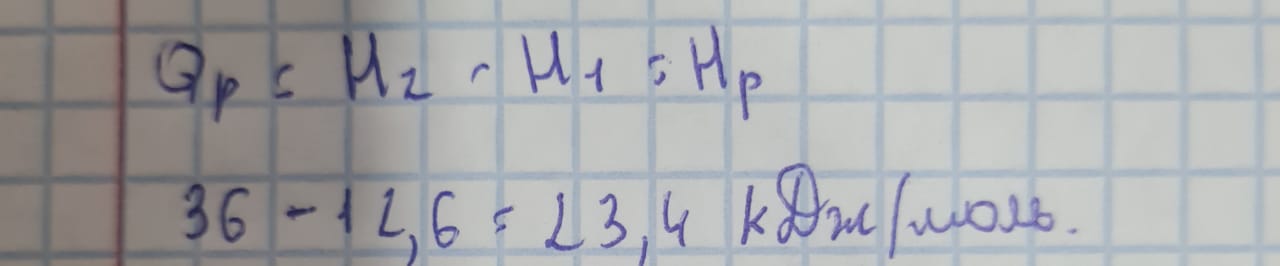 ∆H = 2∆H (C) + 4∆H(D) - ∆H(A) - ∆H(B); 2*0 + 4*100 - 0 -0 = 400кДж/моль - так как энтальпия получилась больше нуля, значит реакция эндотермическая ( происходит с поглощением тепла) 1) при повышении температуры-влево, так как реакция экзотермическая 2) при повышении давления - вправо, так как справа объемов меньше. Если увеличить концентрацию любого из веществ в два раза, скорость реакции возрастет в 2^2 = 4 раз. V=∆c/∆t=(0,8-0,7):20=0,005 при повыщении на 30градусов: 3*3*3=27 v=0,01*27моль/(л*мин)=0,27моль/(л*мин)  1) Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье — Лапласа). 2) Для реакций горения тепловой эффект сгорания равен сумме энтальпий сгорания реагентов минус сумма энтальпий сгорания продуктов. ΔНох.р. = ∑n·ΔНосг.(исх.) - ∑n·ΔНосг.(прод.) 3) Закон Лавуазье – Лапласа: Энтальпия образования вещества равна, но противоположна по знаку энтальпии его разложения. 4) Если начальное и конечное состояния химической реакции (реакций) совпадают, то их тепловой эффект равен нулю. Самопроизвольное протекание химических реакций возможно, если процесс сопровождается уменьшением внутренней энергии системы U или переходом ее в наиболее вероятное состояние, которое характеризуется большим числом возможных комбинаций взаимного расположения частиц с одинаковым запасом энергии. На скорость химической реакции оказывают влияние следующие факторы: природа реагирующих веществ; концентрация реагирующих веществ; поверхность соприкосновения реагирующих веществ (в гетерогенных реакциях); температура действие катализаторов. При́нцип Ле Шателье́ — Бра́уна (1884 г.) — если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные в сторону противодействия изменениям. |
