Лекция 2.1 (1). 3. Пиролиз бутана. Сссс 2сс
 Скачать 262.66 Kb. Скачать 262.66 Kb.
|
10133. Пиролиз бутана. 1. С—С—С—С → 2С—С• β α 2. Н—С—С•↛ 3. С-С-С-С+ С-С•→ С-С•-С-С+ C2H6 | H β α 4. С—С—С•—С → C=C—С+С• 5. С—С—С—С+С•→ С—С• —С—С+CH4 | H 6. С•+С•→C2H6 1. С—С—С—С →2С—С• β α 2. Н—С—С•↛ 3. С—С—С—С+С—С• → С—С—С—С•+C2H6 | H β α 4. С—С—С—С• → C=C+С—С• 5. С—С—С—С+С—С•→С—С—С—С•+C2H6 | H 6. С•+С•→C2H6 1. С—С—С—С•→ С•+ С—С—С• β α 2. С—С—С•→ C=C+С• 3. С—С—С—С+С• → С—С•—С—С+CH4 | H β α 4. С—С—С•—С → C=C—С+С• 3. С—С—С—С+С—С—С• → С—С•—С—С+С—С—С | H β α 4. С—С—С•—С → C=C—С+С• 5. С•+С• → C2H6 1.С—С—С—С• → С•+ С—С—С• β α 2. С—С—С• → C=C+С• 3. С—С—С—С+С• → С—С—С—С•+CH4 | H β α 4. С—С—С—С• → C=C+С—С• 5. С—С•+С—С—С—С → С—С—С—С•+C2H6 | Н 5. С—С•+С—С—С—С → С—С•—С—С+C2H6 | Н β α 6. С—С—С• → C=C—С+ С• 7. С•+С—С—С—С → С—С•—С—С+CH4 | Н 8. С•+С—С—С—С → С—С—С—С•+CH4 | Н β α 9. С—С—С—С• → C=C+ С—С• 10. С—С•+С—С—С—С → С—С•—С—С+C2H6 | Н β α 11. С—С—С•—С → C=C—С+С• 12. С—С—С—С+С—С—С• → С—С•—С—С+С—С—С | H β α 13. С—С—С•—С → C=C—С+С• 14. С—С—С—С+С• → С—С•—С—С+CH4 | H 12. С-С-С-С+ С—С—С• → С—С—С—С•+C3H8 | H β α 13. С—С—С—С• → C=C+ С—С• 14. С—С•+С—С—С—С → С—С—С—С•+C2H6 | Н 15. С•+ С• → C2H6 16. С•+С—С• → C3H8 3.3.1 Основы управления процессом пиролизаФакторами, которые можно в определительных пределах задавать, влияя на результаты пиролиза, являются температура, давление, время реакции и качество сырья. 1. Температура. Для реакции первого порядка, механизм которых не изменяется с изменением температуры, время реакции τ, необходимое для достижения заданной ее глубины, изменяется с изменением температуры, согласно уравнению: 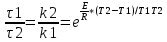 Для реакций других порядков это уравнение справедливо при постоянстве начальной концентрации. При энергии активации, равной | |||||||||||||||||||||||||||||||||||||||||||
| Компонент | Парциальное давление паров сырья, МПа | ||
| 0,010–0,014 | 0,04–0,06 | 0,10–0,15 | |
| H2 | 15,0 | 12,0 | 9,9 |
| CH4 | 28,1 | 26,6 | 24,4 |
| C2H4 | 31,2 | 28,9 | 26,3 |
| C2H5 | 5,0 | 7,2 | 9,7 |
| C3H5 | 13,7 | 13,6 | 13,2 |
| C3H8 | 0,6 | 3,6 | 6,7 |
| C4H61,3 | 2,2 | 2,1 | 1,9 |
| C4H8 | 3,9 | 4,0 | 4,0 |
| C4H10 | 0,3 | 2,0 | 3,9 |
Существенное увеличение выхода водорода при снижении парциального давления углеводородов связано с повышением вероятности распада радикалов Ċ̊2Н5, втор-Ċ3Н7, трет-Ċ4Н9.
3. Время реакции. Пиролиз является совокупностью последовательных реакций, при которых целевые продукты (обычно этилен и пропилен) образуются при распаде как исходного сырья, так и первичных продуктов его разложения, и также подвергаются разложению. Поэтому важно обеспечить время реакции, соответствующее максимальному выходу целевого продукта. Время достижения максимального выхода целевого продукта в реакторе идеального вытеснения равно:
τмакс=
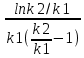 ,
,а максимальный выход продукта из сырья:
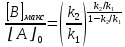 .
.Промежуточными продуктами пиролиза парафинов и циклопарафинов являются α-олефины, при распаде которых дополнительно образуются этилен и пропилен. При стационарном цепном процессе скорость разложения молекул исходного сырья А равна:
KA[R•стац][A] ,
молекул α-олефинов М:
kM[R•стац][M] .
По имеющимся данным, при температурах пиролиза kM/kA=2–15. Примем для скорости разложения исходного сырья значение k1=1013
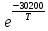 c-1. При 800 °C k1=6 и τмакс=0,12 с при k2/k1=2; τмакс=0,03 с при k2/k1=15.
c-1. При 800 °C k1=6 и τмакс=0,12 с при k2/k1=2; τмакс=0,03 с при k2/k1=15.Обычно время пиролиза значительно больше, и получаемые выходы
α-олефинов С4 и выше значительно ниже максимальных (25 % мол. при k2/k1=2 и 5,5 % мол. при k2/k1=15 при выходе 1 моль продукта на 1 моль разложившегося сырья). При увеличении температуры отношение k2/k1 можно считать неизменяющимся, так как разница в энергиях активации мала и при высоких температурах несущественна, а k1 возрастает. В результате максимальный выход промежуточных продуктов практически не меняется, а время его достижения снижается.
Этилен расходуется в результате как радикально-цепной реакции, так и (параллельно) в некоторой степени молекулярной реакции диенового синтеза. Цепной распад этилена идет по схеме:
R•(H. CH3)+C2H4→RH+Ċ2H3
Ċ2H3+ C2H4→Ċ4H7
Ċ4H7→C4H6+•H
Винильный радикал может стабилизоваться в этилен по реакции:
Ċ2H3+RH→ C2H4+H• ,
где RH – любой углеводород или молекулярный водород.
Из условия стационарности концентрации винильных радикалов:
k1[R•][ C2H4]=k2[Ċ2H3][ C2H4]+k4[Ċ2H3][RH]
находим:
[Ċ2H3]=
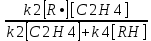 ,
,и скорость расходования этилена по цепному механизму:
ω2=k2[Ċ2H3][ C2H4]=
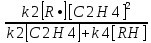 .
.Скорость образования этилена можно выразить так:
ω=k[R•][M],
где М – молекулы углеводородов, распадающихся с образованием этилена (как исходного сырья, так и промежуточных продуктов).
Очевидно, что максимальный выход этилена, если пренебречь его расходом по нецепному пути, достигается при ω2=ω. Далее этилен расходуется с большей скоростью, чем образуется, и при времени достижения максимального выхода этилена:
k[M]=
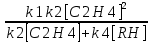
величина k4[RH] меняется с глубиной пиролиза в результате как изменения концентрации (так как реакция идет с увеличением числа молекул, [RH] возрастает), так и величины k4, которая определяется составом продуктов пиролиза. Изменяется также величина k[M], в результате уменьшается не только [M], но и k, связанного с ростом термостабильности продуктов М по мере углубления пиролиза. В результате задача определения [C2H4]макс в общем виде решена быть не может. Качественно можно утверждать:
а) с увеличением температуры время достижения максимального выхода этилена снижается, а максимальный выход несколько возрастает;
б) время достижения максимального выхода, как и его значение, зависят от свойств исходного сырья;
в) с увеличением давления в результате расходования части образующегося этилена по реакции второго порядка с диенами время достижения максимального выхода и его значение снижаются;
г) скорость снижения выхода этилена после достижения максимума тем выше, чем выше температура и давление, и зависит от качества исходного сырья.
На рисунке 3.1 приведены типичные кинетические кривые образования продуктов пиролиза.
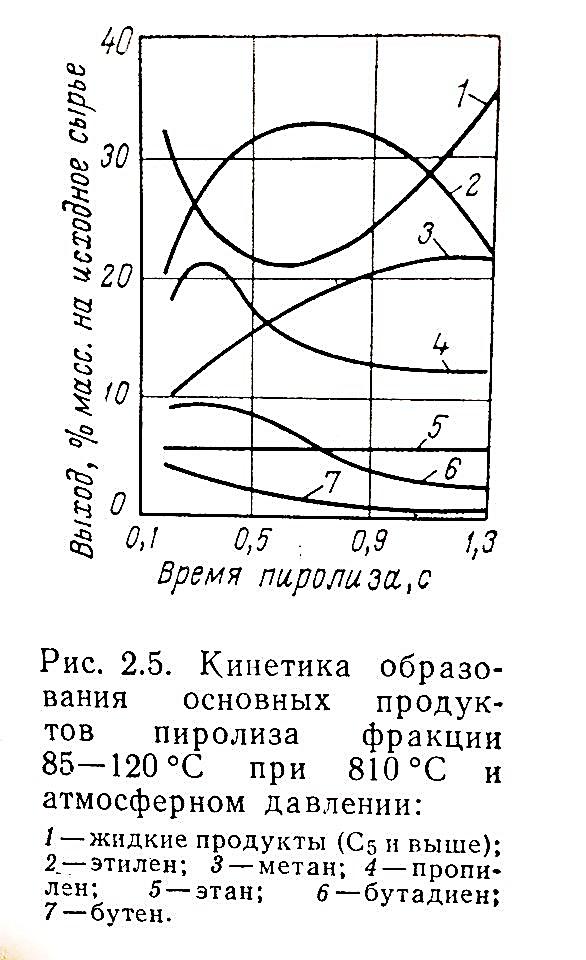
1 – жидкие продукты (C5 и выше); 2 – этилен; 3 – метан; 4 – пропилен; 5 – этан; 6 – бутадиен; 7 – бутен
Рисунок 3.1 – Кинетика образования основных продуктов пиролиза фракции
85–120 °C при температуре 810 °C и атмосферном давлении

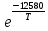 см3∙моль-1∙с-1. Для соотношения скоростей распада и конденсации характерно следующее значение:
см3∙моль-1∙с-1. Для соотношения скоростей распада и конденсации характерно следующее значение: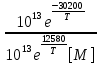
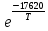 . Это соотношение равно приблизительно 0,1 при 850 К, 2 при 100 К и 10 при 1100 К. повышение температуры увеличивает роль реакции распада и снижает роль реакций конденсации; в результате при снижении времени реакции увеличивается выход тяжелых продуктов, в частности этилена, и снижается выход тяжелых продуктов конденсации.
. Это соотношение равно приблизительно 0,1 при 850 К, 2 при 100 К и 10 при 1100 К. повышение температуры увеличивает роль реакции распада и снижает роль реакций конденсации; в результате при снижении времени реакции увеличивается выход тяжелых продуктов, в частности этилена, и снижается выход тяжелых продуктов конденсации.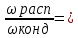 kрасп
kрасп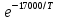 /kкондP
/kкондP