Некоторые ответы на экзаменационные вопросы. Шпаргалка. СПбГМУ, лечебн. Некоторые ответы на экзаменационные вопросы. Шпаргалка. СПбГМУ,. 35. Электронное строение карбоксильной группы
 Скачать 124 Kb. Скачать 124 Kb.
|
|
3 5. Электронное строение карбоксильной группы. На атоме углерода карбоксильной группы возникает эффективный положительный заряд δ+, однако электрофильность этого атома углерода понижена за счет +М эффекта ОН-группы. Характерны реакции нуклеофильного замещения Sn. Причина устойчивости карбоксилат аниона. Образование водородной внутримолек. св. явл прич уст карбоксилат аниона. Сила увел на право CH3COOH < HCOOH < ClCHCOOH (-I, ЭД) < Cl3CCOOH 36. Реакция получения сл. эфиров. Функцией катализатора является повышение электрофильности атома углерода карб. гр. путем протонирования карбоксильного атома и ор-я карбкатиона С ложные эфиры могут подвергаться гидролизу как в кисл. так. и в щел. среде. Гидр. в щел. ср. необратим и треб. эквимолярного кол-ва щелочи. 37. Особ-ти взаимод-я с нуклеофильными реагентами к. к-т и альдег. Функцией катализа-тора является повы-шение электрофиль-ности атома углерода карб. гр. путем протонирования карбоксильного атома и ор-я карбкатиона Спирты при вз-и с альдегидами обр ацетали. При обраб. полуац. изб. спирта в кисл ср. обр. ацет. Д ля повышения активности атома С оксо-гр исп. кисл. кат. 39. Реакции получения амидов из к.к-т и при аммонолизе их функ произв. 2 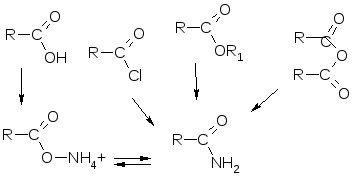 5. Факторы, влияющие насилу кислот Бренстеда. Чем стабильнее анион, тем сильнее кислота. Анион будет тем стабильнее, а кислота тем сильнее, чем: 1больше э/о у атома, удерживающего электронную пару после ухода протона 2больше размер (поляризуемость) этого атома 3больше возможность стабилизации аниона за счёт сопряжения 4больше возможность делокализации отрицательного заряда. в группах периодической системы сверху вниз увеличивается радиус атома и его поляризуемость таким образом сера, являясь эл-том III периода, имеет больший радиус атома, чем кислород. Отриц. заряд серы делокализ. в большем объеме, а эл плотность ниже. Это делает анион С2H5S- менее доступным к присоед протона. Следов этот анион более стабилен, тиолы – более сильные к-ты. бббб) в периодах с лев на прав растет эо элемнетв, т.е. спосон-ть удерж эл-роны. К-род как более эо эл-т прочнее удерж эл пару, чем азот. Следоват. анион C2H5O- более стабилен чем C2H5N-, а ОН к-ты сильнее. NH к-ты сильнее СН, кот явл самыми слаб. Фенолы по кислотности значит превосх алифат спирты, т.к. в феноксид ионе отр. заряд делок. при участии атомов углерода бенз. кольца. 26 Основания с позици теории бренстеда. Осн-я Бр-да – нейтр мол-лы или ионы, способ. присоед. протон (акцепторы прот) Чем не стабильнее анион, тем сильнее основание. Анион будет тем не стабильнее, а основание тем сильнее, чем: 1 меньше э/о у атома, удерживающего электронную пару после ухода протона 2меньше размер (поляризуемость) этого атома 3меньше возможность стабилизации аниона за счёт сопряжения 4меньше возможность делокализации отрицательного заряда. Эо азота меньше, чем О, азот – эл-т второго периода. Плотн заряда на орбитали неподелен пары высока, что благоприятств. более прочн связ протона. 27 Использов-е кислотно-осн св-в биоорг соед. О сн св-ва мног лекарств в-в исп для получ водорастор форм этих прпаратов при обр-и солей с к-тами. 28 Ароматич гциклы, лежащ в он прир физ акт в-в. В соединениях, содерж. пиррольн. ат. азота неподел. пара явл. частью системы аромат. и непроявл скл к связ прот. Пиррол лишен осн св-в. Но при вз-и с Na NH гр проявл кисл хар-р. В пиридине неподел пара не приним уч в обр скелета. Она ответств за проявл-е его осн. св-в. 48 Эпимеры. Эпимеры – стереоизомеры, отл. конфиг. только одн хир. центра. Она происх в щелочн ср. Явл-е эпимеризац связ с подвижн водор ат. в альфа-полож-и относит оксогр. В слабощел ср. катализир. кето-енольн. превр-е альдозы в ендиольн. ф-му. При обратном переходе образуется смесь моносах. 2 эпимерн С2 альдоз и одной кетозы. 1 термодинамич основы Термодинамика – это наука об энерг, о принм ею ф-мах и о правилах, огранич превр одн ф-мы в др. Энергия это способн к выполн р-ты или переносу тепла. Материя наполн всел, энергия движет материю. Энерг м.б. теплов, светов, химич, электрич, механич. и т.д. Меанич энерг быв двух видов. потенц и кинет. Энерг мож передав от одн тел к др, а также перех из одн ф. в др, но никогда не появл из ничего и не исчезает. 2 Понятие сист. Откр изол. Система – это в-во или совокупн в-в , сост из боьшого кол-ва частиц и отдел от вн среды реальной или вообр обол. У изолир сист нет обм с окр ср. закр – обмен только энергией. Откр – обмен энерг, массой и инфой. Состояние сист можно описать 1 осн пар-рами сост зн-я кот м.б. изменены (p, T, C, V) и ф-ями сост (общ пар-ры), измеряемыми для кот явл только их измен-я (Δ) кроме энтропии. К общ пар-рам отн внутр энерг Е, энталпия (теплосод) H, энтропия S, своб энерг Гиббса G. 3 I ый зн. Теплов эф в изоб изох проц. Теплов эффект р-и, протек при пост давл больше тепл эф р-и при пост объеме на величину р-ты pΔV. Тепл эф изох проц. Qv=ΔE=∑Eпрод-∑Eисх Тепл эф изобарн проц Qp=ΔE=∑Hпрод-∑Hисх 5 II з-н термод. и энтроп ф-р уст сист. II з-н термод гласит, что любая неравнов сист измен свое сост в опред, характ дял неё напр-и. Для того, что бы пошло измен-е в противопол напр-и не обх энергия. Вода замерз, гв. ржавеет. – это самопроизв проц. Все самопроизв проц идут в стор достиж р.весия. Протекают проц в стор увел беспорядка. Мерой беспорядка явл энтропия – S. При перех в менее упоряд сост S возр и ΔS>0 и наоборот. Энтр возр при перех ж. в пар, при раств крист в-ва. 6 Ведущ ведом р-и. Любое биохим действие предст собой два одновр происх проц: передачу энергии и измен-е упорядоченности др. отн. др. Действ 2 тенденц – стремл-е частиц соедин что уменьш S и разедин, что увел S. Эти тенд зовутся энтальпийн (ΔН) и энтропийн (ТΔS) ф-рами. В сост р.в ΔН= ТΔS, а ΔН-ТΔS=ΔG св эн Гиббса. Усл-ем протек проц явл ΔG<0. ?????? 84 Классификац, применение высмол соед в мед практ. Классиф осн на сл призн. природе атомов цепи и поимера в целом, кол-ве и распредел-и повтор звеньев, стр-и осн цепи и конфиг повт участка. По хим сост дел на - органич – цепи построены в осн из ат C, функ гр м.б из др атомов. элементо орг – содерж как орг так и неорг группы. неорг – несодржат С-Н связей. В зав-ти от прир цепи м.б. гетеро и гомоцпными. С точки зр. осн цепи м.б. линейными, двухтяжевыми, разветвленными, сшитыми. Сополим в зав-ти от строен делятся на. хаотические (ААВАВВВААВ), чередующимися (АВАВАВ), блок сополимеры (ААААВВВВ), привитые сополимеры. В зав-ти от растворимости м.б. водораств и водонераств. В зав-ти от способа перераб в изделия м.б. термо и реактопласты. 89. Конфиг цепи. Конфиг цепи отр химич структ макро мол-лы. Под конфиг поним взаимно р.полож-е ат вытянутой цепи. Конфиг м.б изменена только путем разр х.св. Одна из пар-ров конфиг – разл-е в спос ориентац мол-лы (гг, гх, хх). Макромол-лы назыв стереорегул, если два разн замест р.положены по одну стор отн плоск зигз цепи. 90 конформация Изменения конформ возм только в водн р-рах. Под конформ поним простр р.п атомов макромол-лы в даннйы момент вр. , опред фиксированными зн-ями длин связей, валентн углов, и углов вр-я вокруг св осн цепи. К предельн сл отн конформ вытянутой и свернутой в клубок цепи. Вытянут характ для макромол-л у кот почти отсутств вр-е. вокр осн цепи. Усл-ем обр-я клубка явл сильное м.молек взаимод-е между звеньями цепи а так же ра счет обр-я водор и гидрофобн св. 85 Термодинамика синтеза Термодинамически проц полимеризации возможен, когда ΔG=ΔH-TΔS<0, где ΔG, ΔS, ΔH – изменения своб энерг Гиббса. При полимеризации полимеров с кр св обычно ΔH<0 и ΔS<0. Значит проц пойдет при температурах ниже некоторой предельной темп. При температуре выше предельной полимеризац происх не может происх деполимеризация. Это связано с тем, что поступат дв-я мол-л при полимеризации уменьшается. Это верно и для поликонденсации, но тут надо следить, чтобы образовывалось как можно меньше циклов. 97 Участие НАД В ходе биологич дегидрирования субстрат теряет 2Н+ и 2е, в реакции окисления теряется ароматичность НАД+ в связи с чем увелич энергия НАДН. Т.о. НАДН запасает энергию, которая расходуется в др. биохимич процессах. 95. Определение направления протекания хим и биохим проц. Любое биохим действие предст собой два одновр происх проц: передачу энергии и измен-е упорядоченности др. отн. др. Действ 2 тенденц – стремл-е частиц соедин что уменьш S и разедин, что увел S. Эти тенд зовутся энтальпийн (ΔН) и энтропийн (ТΔS) ф-рами. В сост р.в ΔН= ТΔS, а ΔН-ТΔS=ΔG св эн Гиббса. Усл-ем протек проц явл ΔG<0. Т.о. самопроизвольному протеканию способств уменьш-е энтальп и увел-е энтроп. |
