хим2. 368. Азотистое равновесие Здоровый взрослый человек при полноценном питании. 369. Аминопептидазы
 Скачать 132.27 Kb. Скачать 132.27 Kb.
|
1 2 413. Относительно аспартатаминотрансферазы (АсАТ) верными являются утверждения: катализирует реакцию трансаминирования между глутамином и оксалоацетатом катализирует реакцию трансаминирования между аспартатом и альфа-кетоглутаратом активность AST в сыворотке значительно увеличивается при тяжелых формах заболеваний печени при инфаркте миокарда активность AST в сыворотке достигает максимальных значений за 24-48 часов при инфаркте миокарда и заболеваниях печени активность AST в сыворотке уменьшается 414. Относительно декарбоксилирования аминокислот верными являются утверждения: это реакция удаления –СООН группы аминокислот в виде СО2 является обратимым процессом в живых организмах различают 4 типа декарбоксилирования все аминокислоты подвергаются всем типам декарбоксилирования в результате альфа-декарбоксилирования образуются биогенные амины 415. Относительно образования карбамоилфосфата верными являются утверждения (первая реакция орнитинового цикла): начинается с образования карбамоилфосфата источником аминогруппы для карбамоилфосфата является глутаминовая кислота источником аминогруппы для карбамоилфосфата является глутамин для синтеза карбамоилфосфата используется одна макроэргическая связь карбамоилфосфат является макроэргическим соединением 416. Относительно почечной экскреции аммиака верными являются утверждения: сопряжено с поддержанием кислотно-щелочного равновесия сопряжено с поддержанием жидкостного состояния крови в почках глутаминаза катализирует реакцию: Gln + H2O →Glu + NH3 глутаминаза отсутствует в почках NH3 + H+ + Cl- → NH4Cl является реакцией образования аммонийных солей 417. Относительно продукта представленной химической реакции верными являются утверждения:  418. Относительно продукта представленной химической реакции верными являются утверждения: 419. Относительно трансаминаз аминокислот верными являются утверждения: это экскреторные ферменты печени в обычных условиях имеют высокую активность в крови при гепатитах в основном повышается активность аланинаминотрансферазы (ALT) в сыворотке при инфаркте миокарда выраженно увеличивается активность аспартатаминотрансферазы (AST) в сыворотке ALT и AST не являются органоспецифическими ферментами это класс изомераз реакции катализируемые трансаминазами являются обратимыми все трансаминазы обладают абсолютной субстратной специфичностью специфичность трансаминазы определяется коферментом простетической частью трансаминаз является пиридоксальфосфат 420. Относительно трансаминирования аминокислот верными являются утверждения: это перенос -NH2 группы от альфа-аминокислоты на альфа-кетокислоту является этапом непрямого дезаминирования аминокислот это необратимый процесс Glu, Asp и Ala не подвергаются ТА только Glu, Asp и Ala подвергаются ТА 421. Относительно химического процесса верными являются утверждения:  это реакция трансаминарования аланина является этапом непрямого дезаминирования аспарагиновой кислоты катализируется аланинаминотрансферазой (ALT) катализируется аспартатаминотрансферазой (AST) в результате реакции образуются пируват и глутамат 422. Относительно химической реакции верными являются утверждения: 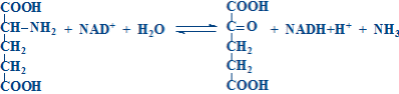 это необратимый процесс это главный путь синтеза заменимых аминокислот на первом этапе происходит трансаминирование аминокислоты с альфа-кетоглутаратом на втором этапе происходит окислительное дезаминирование глутаминовой кислоты в процессе дезаминирования глутаматдегидрогеназа использует НАДФН+Н+ 423. Относительно химической реакции верными являются утверждения: 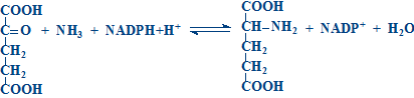 является необратимым процессом является путем синтеза всех аминокислот на первом этапе происходит восстановительное аминирование альфа-кетоглутарата на втором этапе происходит трансаминирование глутаминовой кислоты с альфа-кетокислотой в процессе реаминирования глутаматдегидрогеназа использует НАД+ 424. Серотонин синтезируется из: гистидина глутаминовой кислоты тирозина фенилаланина триптофана 425. Синтез мочевины (уреогенез): является механизмом временного обезвреживания NH3 нуждается в использовании энергии происходит во всех тканях мочевина является токсическим веществом мочевина синтезируется в печени и выделяется с мочой 426. Синтез мочевины (уреогенез): протекает исключительно в печени протекает в почках это синтез мочевой кислоты частично происходит в цитоплазме, а частично в митохондриях является механизмом окончательного обезвреживания NH3 427. Сколько макроэргических связей используется для синтеза 1 молекулы мочевины? 1 2 3 4 5 428. Сколько молекул АТФ необходимо для синтеза одной молекулы мочевины? 1 4 5 2 3 429. Трансдезаминирование аспарагиновой кислоты. Укажите реакции процесса (1) и ферменты (2), катализирующие эти реакции: Asp + H2O → оксалоацетат + NH3 + H2O аспартадегидратаза Asp + альфа-кетоглутарат→ оксалоацетат + Glu аспартатаминотрансфераза Asn + H2O → Asp + NH3 аспарагиназа Glu+НАДФ++H2O→альфа-кетоглутарат+НАДФH+H++NH3 глутаматдегидрогеназа Glu+НАД ++H2O→альфа-кетоглутарат+НАДH+H++NH3 глутаматдегидрогеназа оксалоацетат + Glu → Asp + альфа-кетоглутарат аспартатаминотрансфераза(AST) оксалоацетат + NH3 + H2O → Asp + H2O аспартатсинтаза альфа-кетоглутарат+ НАДH+H++NH3 → Glu + НАД++H2O глутаматдегидрогеназа альфа-кетоглутарат+НАДФH+H++NH3 → Glu+НАДФ++H2O глутаматдегидрогеназа Glu + NH3 + ATФ → Gln + AДФ + H3PO4 глутаминсинтетаза 430. Трансреаминирование аминокислот: является необратимым процессом является путем синтеза всех аминокислот на первом этапе происходит восстановительное аминирование альфа-кетоглутарата на втором этапе происходит трансаминирование глутаминовой кислоты с альфа-кетокислотой в процессе реаминирования глутаматдегидрогеназа использует НАД+ 431. Химическая реакция: (Гистидин – Гистамин) это альфа-декарбоксилирование это омега-декарбоксилирование это реакция образования гистамина это реакция образования серотонина продукт реакции обладает сосудосуживающим действием 432. Химическая реакция: (Гидрокситриптофан – Серотонин)  это реакция образования гистамина это реакция образования серотонина это реакция декарбоксилирования триптофана это реакция декарбоксилирования тирозина продукт реакции обладает сосудосуживающим действием 433. Алкаптонурия: развивается при врожденной недостаточности фенилаланингидроксилазы накапливается фенилпируват, фениллактат, фенилацетат развивается при врожденной недостаточности оксидазы гомогентизиновой кислоты из-за наличия гомогентизиновой кислоты моча чернеет при контакте с воздухом приводит к артрозам 434. Альбинизм: развивается при врожденной недостаточности фенилаланингидроксилазы развивается при врожденной недостаточности тирозиназы лица страдающие альбинизмом имеют высокий риск развития рака кожи лица, страдающие альбинизмом защищены от ультрафиолетовых лучей сопровождается замедлением умственного развития 435. Аспарагиновая кислота используется для синтеза: карбамоилфосфата пиримидиновых нуклеотидов глутатиона мочевины кетоновых тел 436. Белковая недостаточность: это результат полного или частичного голодания это результат однообразного белкового питания (белки растительного происхождения) сопровождается положительным азотистым равновесием сопровождается отрицательным азотистым равновесием азотистое равновесие не нарушается гипипротеинемия повышение осмотического давления отеки мышечная атрофия положительное азотистое равновесие 437. Выберите верное утверждение относительно взаимосвязи белкового и липидного обменов: заменимые аминокислоты могут быть синтезированы из жирных кислот избыток белков может быть превращен в жирные кислоты глюкогенные аминокислоты могут использоваться в синтезе глицерол-3-фосфата кетогенные аминокислоты могут использоваться в синтезе глицерол-3-фосфата аминокислоты, образующие промежуточные вещества цикла Кребса, не могут использоваться для синтеза жиров 438. Выберите верные утверждения относительно взаимосвязи белкового и углеводного обменов: a) большинство аминокислот является глюкогенными b) глюкоза не может быть использована для синтеза аминокислот c) заменимые аминокислоты могут быть синтезированы из глюкозы d) аминокислоты превращаемые в пируват могут образовывать глюкозу e) аминокислоты, образующие промежуточные вещества цикла Кребса, не могут быть превращены в глюкозу 439. Выберите верные утверждения относительно взаимосвязи углеводного и липидного обменов: жирные кислоты могут быть использованы в глюконеогенезе глицерин превращается в глюкозу избыток глюкозы не может быть превращен в жирные кислоты глицерол-3-фосфат образуется из промежуточного вещества гликолиза – дигидроксиацетонфосфат пентозофосфатный путь окисления глюкозы поставляет НАДФН для синтеза жирных кислот 440. Выберите наследственные болезни, обусловленные дефектами ферментов, участвующих в обмене фенилаланина и тирозина: алкаптонурия болезнь Хартнупа болезнь «моча с запахом кленового сиропа» альбинизм фенилкетонурия 441. Выберите ферменты, участвующие в обмене аминокислот: мутазы, карбоксилазы гексокиназы метилтрансферазы декарбоксилазы геликазы топоизомеразы ацил-КоА-синтетаза трансаминазы глутаматдегидрогеназа ацил-КоА-дегидрогеназа синтезе серина синтезе индикана синтезе метионина конъюгации желчных кислот служит источником одноуглеродных фрагментов для тетрагидрофолиевой кислоты 443. Данное химическое соединение используется в: (Аспарагиновая кислота)  малат-аспартатной челночной системе глюкозо-аланиновом цикле синтезе пуриновых нуклеотидов синтезе гема синтезе глюкозы 444. Относительно биосинтеза глутамина верным является утверждение: Gln синтезируется из аспарагина Gln синтезируется из глутаминовой кислоты катализируется глутаминазой катализируется глутаминсинтетазой реакция не нуждается в энергии 445. Относительно катаболизма аминокислот верным является утверждение: Leu является строго кетогенной аминокислотой Lys, Tyr, Phe, Trp являются строго кетогенными аминокислотами Ala, Gly, Ser, Glu, Gln, Asp, Asn являются глюкогенными аминокислотами Val, Leu, Ile являются кетогенными аминокислотами His, Arg, Pro являются кетогенными аминокислотами Arg, His, Pro включаются в цикл Кребса через альфа-кетоглутарат Tyr и Phe включаются в цикл Кребса через альфа-кетоглутарат Thr, Ile, Met и Val включаются в цикл Кребса через сукцинил-КоА Glu и Gln включаются в цикл Кребса через оксалоацетат Asp и Asn включаются в цикл Кребса через фумарат 446. Тетрагидрофолиевая кислота (ТГФК) является донором и акцептором следующих групп: ацильной карбоксильной амино метильной метиленовой 447. Тетрагидрофолиевая кислота (ТГФК): это витамин это кофактор участвует в карбоксилировании аминокислот участвует в декарбоксилировании аминокислот участвует в переносе одноуглеродных групп участвует в метаболизме серина (Ser) и глицина (Gly) Ser + ТГФК ↔ Gly + N5,N10-CH2- ТГФК + H2O Gly + ТГФК ↔ Ser + N5,N10-CH2- ТГФК + H2O Ser + ТГФК → NH3 + CO2 + N5,N10-CH2- ТГФК Gly + ТГФК → NH3 + CO2 + N5,N10-CH2- ТГФК участвет в метаболизме метионина гомоцистеин+ N5-метил-ТГФК→ Met + TГФК Met + N5- метил-ТГФК → гомоцистеин + TГФК реакция катализируется метилтрансферазой коферментом метилтрансферазы является витамин B6 448. Фолиевая кислота: содержит: птеридиновое кольцо, п-аминобензойную кислоту и глутаминовую кислоту синтезируется в человеческом организме переносит одноуглеродные фрагменты в различных ферментативных реакциях коферментом является восстановленная форма: тетрагидрофолиевая кислота (ТГФК) Ser + ТГФК N 5 N10 метилен-ТГФК + Glu это аминокислота состоит из птеридина, пара-аминобензойной кислоты и глутаминовой кислоты состоит из птеридина, пара-аминобензойной кислоты и глицина это витамин это кофермент 449. Химическая структура: (Глицин) является незаменимой аминокислотой превращается в серин является кетогенной аминокислотой превращение глицина в серин является необратимым процессом в превращении глицина в серин участвует N5,N10-СН2-TГФК (тетрагидрофолиевая кислота) 450. Химическая структура: (Аспарагиновая кислота)  это незаменимая аминокислота это кетогенная аминокислота подвергается прямому окислительному дезаминированию подвергается трансдезаминированию при дезаминировании превращается в альфа-кетоглутарат 451. Химическая структура: (Глутаминовая кислота) 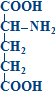 это незаменимая аминокислота при альфа-декарбоксилировании Glu образуется гама-аминомасляная кислота (GABA) при карбоксилировании Glu образуется гама-карбоксиглутаминовая кислота биотин является коферментом карбоксилазы Glu витамин К является коферментом карбоксилазы Glu это кетогенная аминокислота подвергается прямому окислительному дезаминированию из Glu синтезируется глутамин подвергается внутримолекулярному дезаминированию e синтезируется из пролина, аргинина, гистидина входит в состав глутатиона входит в состав пантотеновой кислоты входит в состав фолиевой кислоты при дезаминировании превращается в оксалоацетат при дезаминировании превращается в пируват 452. Химическая структура: (Гистидин) для человека является полузаменимой аминокислотой это кетогенная аминокислота подвергается окислительному дезаминированию подвергается внутримолекулярному дезаминированию при декарбоксилировании His образуется серотонин 453. Химическая структура: (Серин) 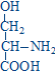 это незаменимая аминокислота это кетогенная аминокислота синтезируется из 3-фосфоглицерата может образовываться из глицина участвует в синтезе метионина участвует в синтезе глицерофосфолипидов служит источником одноуглеродных фрагментов для тетрагидрофолиевой кислоты участвует в синтезе гема участвует в синтезе пуриновых и пиримидиновых нуклеотидов входит в состав активных центров серинпротеиназ 454. Биосинтез тимидиловых нуклеотидов: предшественником тимидиловых нуклеотидов является УМФ предшественником тимидиловых нуклеотидов является dУМФ донором CH3 группы для тимина является S –аденозилметионин (SAM) донором CH3 группы для тимина является N5, N10-CH2-TГФК (тетрагидрофолат) фторурацил необратимо ингибирует тимидилатсинтазу 455. Биосинтез цитидиловых нуклеотидов: ЦТФ синтезируется из УТФ ЦМФ синтезируется из УМФ источником аминогруппы для цитозина является свободный аммиак источником аминогруппы для цитозина является глутамин (Gln) синтез сопряжен с гидролизом АТФ до АДФ и H3PO4 456. Выберите вещества, участвующие в синтезе пуринового кольца: рибозо-5-фосфат глутамин глутаминовая кислота аспарагин аспарагиновая кислота 457. Выберите вещества, участвующие в синтезе пуринового кольца: глицин аланин производные тетрагидрофолиевой кислоты (ТГФК) CO2 серин 458. Выберите источники атомов пиримидинового кольца: глицин аспарагиновая кислота производные тетрагидрофолиевой кислоты (ТГФК) CO2 аспарагин 459. Выберите клинические проявления подагры: подагрический артрит кожные ксантомы подагрические тофусы нефролитиаз холелитиаз 460. Выберите реакцию образования карбамоилфосфата при синтезе пиримидиновых нуклеотидов и фермент, катализирующий эту реакцию: HCO3- + Gln + 2ATФ + H2O → карбамоилфосфат + Glu + 2AДФ + H3PO4 HCO3- + NH4+ + 2ATФ + H2O → карбамоилфосфат + 2AДФ + H3PO4 HCO3- + NH4+ + ATФ + H2O → карбамоилфосфат + AДФ + H3PO4 фермент - карбамоилфосфатсинтетаза II (цитоплазматическая) фермент - карбамоилфосфатсинтетаза I (митохондриальная) 461. Выберите реакцию образования фосфорибозилпирофосфата (PRPP) и фермент, катализирующий эту реакцию: рибозо-5-фосфат + ATФ → PRPP + AДФ рибозо-5-фосфат + ATФ → PRPP + AMФ рибозо-5-фосфат + ATФ → PRPP + AMФ + H4P2O7 реакция катализируется ферментом PRPP – синтетазой PRPP-синтетаза является аллостерическим ферментом, ингибируется АТФ и ГТФ 462. Выберите реакцию синтеза фосфорибозиламина из фосфорибозилпирофосфата (PRPP) (вторая реакция синтеза пуриновых нуклеотидов) и фермент, катализирующий эту реакцию: PRPP + Glu → фосфорибозиламин + альфа-кетоглутарат + H4P2O7 PRPP + Gln → фосфорибозиламин + Glu + AMФ + H4P2O7 PRPP + Gln → фосфорибозиламин + Glu + H4P2O7 реакция катализируется ферментом амидофосфорибозилтрансферазой амидофосфорибозилтрансфераза является аллостерическим ферментом, ингибируется АМФ и ГМФ 463. Инозинмонофосфат (ИМФ): это промежуточное вещество в синтезе пиримидиновых нуклеотидов это промежуточное вещество в синтезе пуриновых нуклеотидов является предшественником в синтезе АМФ и ГМФ является предшественником в синтезе УМФ и ЦМФ является продуктом распада АМФ и ГМФ 464. Относительно образования карбамоилфосфата в ходе синтеза пиримидиновых нуклеотидов верными являются утверждения: для синтеза карбамоилфосфата используется одна молекула АТФ источником аминогруппы для карбамоилфосфата является аммиак источником аминогруппы для карбамоилфосфата является глутамин для синтеза карбамоилфосфата используется одна макроэргичесая связь карбамоилфосфат является макроэргическим соединением 465. Относительно синтеза АМФ из инозинмонофосфата (ИМФ) верными являются утверждения: происходит двумя последовательными реакциями источником аминогруппы для АМФ является глутамин источником аминогруппы для АМФ является аспарагиновая кислота нуждается в энергии в виде АТФ процесс активируется ГТФ 466. Относительно синтеза ГМФ из инозинмонофосфата (ИМФ) верными являются утверждения: происходит двумя последовательными реакциями источником аминогруппы для ГМФ является глутамин источником аминогруппы для ГМФ является аспарагиновая кислота нуждается в энергии в виде ГТФ процесс активируется АТФ 467. Регуляция синтеза пуриновых нуклеотидов (выберите верные утверждения): фосфорибозил-пирофосфат-синтетаза (PRPP-синтетаза) является аллостерическим ферментом амидофосфорибозилтрансфераза является аллостерическим ферментом АМФ и ГМФ активируют PRPP-синтетазу АТФ и ГТФ активируют фосфорибозиламинотрансферазу адениловые и гуаниловые нуклеотиды ингибируют регуляторные ферменты ГМФ активирует собственный синтез АМФ активирует собственный синтез АМФ ингибирует собственный синтез и образование инозинмонофосфата (ИМФ) ГМФ ингибирует собственный синтез и образование инозинмонофосфата (ИМФ) АТФ используется в синтезе ГМФ, а ГТФ используется в синтезе АМФ 468. Укажите конечный продукт распада пуриновых нуклеотидов: инозин гипоксантин ксантин мочевая кислота мочевина 469. Укажите правильные утверждения относительно подагры: главным биохимическим изменением при подагре является уремия главным биохимическим изменением при подагре является гиперурикемия обусловлена врожденными дефектами ферментов участвующих в синтезе мочевины обусловлена врожденными дефектами ферментов участвующих в синтезе пуриновых нуклеотидов обусловлена врожденными дефектами ферментов участвующих в катаболизме пуриновых нуклеотидов 470. Биосинтез гема (выберите необходимые вещества): глутамин глицин суцинил-КоА Fe2+ аспарагиновая кислота 471. Выберите верные утверждения относительно надпеченочной (гемолитической) желтухи: обусловлена снижением способности печени захватывать билирубин обусловлена острым и хроническим гемолизом в крови преимущественно повышается концентрация связанного билирубина нарушена конъюгация билирубина в печени в крови преимущественно повышается количество свободного билирубина 472. Выберите возможные причины желтух: повышенное образование билирубина сниженный распад гемопротеинов сниженная способность печени захватывать билирубин сниженная способность печени связывать билирубин повышенная способность печени связывать билирубин 473. Выберите возможные причины желтух: нарушения выделения билирубина в желчь гепатоцитами повышение способности печени захватывать билирубин снижение биосинтеза гемоглобина внепеченочные нарушения тока желчи снижение образования билирубина клетками ретикуло-эндотелиальной системы 474. Выберите вторую реакцию синтеза гема и фермент, катализирующий эту реакцию: 2 молекулы дельта-аминолевулиновой кислоты + ATФ → порфобилиноген + AДФ + H3PO4 + H2O 2 молекулы дельта-аминолевулиновой кислоты → порфобилиноген + 2 H2O реакция катализируется порфобилиногенсинтетазой реакция катализируется дельта-аминолевулинат дегидратазой коферментом является пиридоксальфосфат 475. Выберитегемопротеины: это простые белки все гемопротеины содержат протопорфирин IX и Fe2+ к гемопротеинам относятся гемоглобин и миоглобин к гемопротеинам относятся каталаза, цитохромы, пероксидазы миоглобин является олигомерным белком 476. Выберите изменения желчных пигментов при надпеченочной (гемолитической) желтухе: характерна для синдрома Жильберта и синдрома Криглера-Наяра I и II синдром Криглера-Наяра обусловлен дефектом УДФ-глюкуронозил-трансферазы специфичной для конъюгации билирубина синдром Криглера-Наяра обусловлен массивным гемолизом при синдроме Криглера-Наяра I фенобарбитал улучшает метаболизацию билирубина синдром Жильберта обусловлен недостаточностью захвата билирубина печенью 477. Выберите изменения желчных пигментов при печёночной желтухе: желчные пигменты в кишечнике - повышенное количество в моче появляется связанный билирубин общий билирубин – сниженное количество связанный билирубин - повышенное количество свободный билирубин –повышенное количество 478. Выберите изменения желчных пигментов при подпечёночной (механической) желтухе: общий билирубин – сниженное количество свободный билирубин –повышенное количество связанный билирубин - повышенное количество желчные пигменты в кишечнике - сниженное количество при полной обструкции – отсутствие уробилиногена и стеркобилиногена в моче 479. Выберите патологические формы гемоглобина: оксигемоглобин карбгемоглобин карбоксигемоглобин метгемоглобин деоксигемоглобин 480. Выберите первую реакцию биосинтеза гема и фермент, катализирующий эту реакцию: Gly + сукцинил-КoA → дельта-аминолевулиновая кислота + HS-КoA + CO2 Gly + сукцинил -КoA + ATФ → дельта-аминолевулиновая кислота + HS-КoA + CO2 + AДФ + H3PO4 реакция катализируется дельта-аминолевулинат синтазой реакция катализируется дельта-аминолевулинат декарбоксилазой фермент регулируется индукцией-репрессией гема 481. Выберите правильные ответы относительно катаболизма гемоглобина (Hb): правильная последовательность превращений: Hb→ вердоглобин→ биливердин→ билирубин правильная последовательность превращений: Hb→ биливердин→ вердоглобин→ билирубин реакции происходят в клетках ретикуло-эндотелиальной системы реакции происходят в гепатоцитах реакции происходят в крови начинается в неповрежденных эритроцитах происходит исключительно в крови происходит во всех тканях происходит в клетках ретикуло-эндотелиальной системы ежедневно распадаются ≈ 6g Hb 482. Выберите реакцию превращения протопорфирина IX в гем и фермент, катализирующий эту реакцию: протопорфирин IX + Fe3+ → гем + 2H+ протопорфирин IX + Fe2+ → гем + 2H+ реакция катализируется ферментом феррохелатаза фермент аллостерически ативируется гемом недостаточность фермента обусловливает развитие первичной протопорфирии 483. Выберите факторы, влияющие на сродство гемоглобина (Hb) к кислороду (O2): Понижение сродства снижение парциального давления кислорода (pO2) снижение pH снижение температуры повышение концентрации 2,3-дифосфоглицерата повышение концентрации 1,3-дифосфоглицерата Повышение сродства снижение парциального давления кислорода (pO2) повышение рН повышение температуры снижение концентрации 2,3-дифосфоглицерата снижение концентрации 1,3-дифосфоглицерата 484. Газообмен O2 и CO2 (выберите реакции, протекающие в лёгких): HHb + O2 → HHbO2 KHb + O2 → KHbO2 HHbO2 + KHCO3 → KHbO2 + H2CO3 KHbO2 + H2CO3 → HHbO2 + KHCO3 H2CO3 → CO2 + H2O 485. Газообмен O2 и CO2 (выберите реакции, протекающие в тканях): HHbO2 → HHb + O2 KHbO2 → KHb + O2 CO2 + H2O → H2CO3 KHb + H2CO3 → HHb + KHCO3 HHb + KHCO3 → KHb + H2CO3 486. Гемоглобин участвуетв: переносе O2 кровью переносе СO2 кровью регуляции жидкостного состояния крови переносе железа кровью регуляции кислотно-щелочного равновесия 487. Гипоксия: представляют снижение концентрации кислорода в тканях представляют снижение концентрации кислорода в крови могут быть обусловлены снижением парциального давления кислорода во вдыхаемом воздухе могут быть вторичны анемиям могут быть обусловлены обструктивными заболеваниями легких 488. К хромопротеинам относятся: нуклеопротеины металлопротеины флавопротеины гемопротеины фосфопротеины 489. Катаболизм гемоглобина: в начале происходит отщепление глобина от гема затем от вердоглобина отщепляется глобин и Fe3+ и образуется биливердин затем происходит окисление железа, расщепление порфиринового кольца и образование биливердина в начале происходит окисление железа, расщепление порфиринового кольца и образование вердоглобина Hb сразу превращается в биливердин 490. Относительно билирубина верными являются утверждения: захватывается из крови специальными рецепторами гепатоцитов переносится в микросомы лигандинами в микросомах фосфорилируется чтобы предупредить возвращение в кровь в микросома подвергается конъюгации с глюкуроновой кислотой в конъюгации участвует УДФ-глюкоза 491. Относительно билирубина верными являются утверждения: это плохо растворимое в воде соединение находится в крови в свободном состоянии переносится альбуминами комплекс билирубин-альбумин называется свободный билирубин комплекс билирубин-альбумин называется связанный билирубин 492. Относительно гемоглобина (Hb) верными являются утверждения: это тетрамерный белок связанный с одним гемом гем образован из протопорфирина IX и Fe2+ HbA (взрослый) состоит из 2 полипептидных цепей альфа, 2 цепей бета и 4 молекул гема железо входящее в состав гема, при нормальной деятельности Hb, меняет валентность: Fe2+ ↔ Fe3+ гем связывается посредством Fe2+ с остатками гистидина в составе цепей альфа и бета является тетрамером состоящим из 4 альфа - цепей протомеры связаны гликозидными связями каждая субъединица содержит простетическую группу «гем» является тетрамером состоящим из 2 типов субъединиц составные протомеры соединены ковалентными силами 493. Относительно захвата и превращения билирубина в печени верными являются утверждения: общий билирубин - повышенное количество свободный билирубин - повышенное количество связанный билирубин - повышенное количество желчные пигменты в кишечнике - повышенное количество желчные пигменты в моче - повышенное количество пигментов 494. Относительно конъюгации билирубина в печени верными являются утверждения: в конъюгации участвует УДФ-глюкуроновая кислота реакция катализируется ферментом УДФ-глюкуронозилтрансфераза в результате конъюгации уменьшается растворимость билирубина комплекс билирубин-глюкуроновая кислота называется свободный (непрямой) билирубин комплекс билирубин-глюкуроновая кислота называется связанный(прямой) билирубин 495. Относительно превращения биливердина в билирубин верными являются утверждения: происходит в гепатоцитах происходит в клетках ретикуло-эндотелиальной системы биливердин + НАД+ → билирубин + НАДH+H+ биливердин + НАДФH+H+ → билирубин + НАДФ+ реакция катализируется биливердин дегидрогеназой 496. Относительно превращения гемоглобина (Hb) в билирубин верными являются утверждения: правильная последовательность превращений: Hb→ вердоглобин→ биливердин→ билирубин правильная последовательность превращений: Hb→ биливердин→ вердоглобин→ билирубин реакции происходят в клетках ретикуло-эндотелиальной системы реакции происходят в гепатоцитах реакции происходят в крови 497. Относительно превращения желчных пигментов в кишечнике верны утверждения: у здоровых лиц моча не содержит желчные пигменты стеркобилиноген мочи - тот который всасывается через воротную вену стеркобилиноген мочи - тот который всасывается через систему геморроидальных вен часть уробилиногена всасываемого из кишечника в кровь выделяется в мочу связанный билирубин может выделяться в мочу 498. Относительно связывания кислорода к оксигемоглобину верны утверждения: содержит одну молекулу кислорода (O2) O2 связывается с Fe3+ гема O2 связывается с Fe2+ гема O2 связывается с белковой частью гемоглобина O2 связывается с тетрапирольным кольцом гема 499. Относительно транспорта кислорода (O2) кровью верными являются утверждения: O2 преимущественно переносится в растворенном виде O2 преимущественно переносится в форме оксигемоглобина метгемоглобин является главной транспортной формой O2 O2 связывается с Fe2+ гема O2 связывается с белковыми субъединицами гемоглобина 500. Перенос углекислого газа (CO2) кровью осуществляется в виде: метгемоглобина физически растворенным в плазме карбгемоглобина карбоксигемоглобина NaHCO3, KHCO3 501. Подпечёночная (механическая, обтурационная) желтуха обусловлена: гемолизом нарушением связывания билирубина в микросомах внутрипеченочным застоем желчи полной или частичной закупоркой желчных каналов снижением способности печени захватывать билирубин 502. Причинами печёночной желтухи могут быть: повышенное образование билирубина сниженный распад гемопротеинов сниженная способность печени захватывать билирубин сниженная способность печени связывать билирубин повышенная способность печени связывать билирубин 1 2 |
