4 Нуска Судын ионды кбейтіндісі. Сутектік крсеткіш. Гидроксидтік крсеткіш
 Скачать 26.39 Kb. Скачать 26.39 Kb.
|
|
4 Нуска) Судын иондық көбейтіндісі. Сутектік көрсеткіш. Гидроксидтік көрсеткіш. Берілген температурада су және кез келген сулы ерітінділер үшін сутек иондары [H+] және гидроксид-иондарының [ОH-] көбейтіндісі тұрақты шама болады да, судың иондық көбейтіндісі (Кн20) деп аталады. Кн20=[H+]*[ОH-], Кн20=1*10-14(t=250c) Ерітіндідегі бос сутек иондарының концентрациясының теріс таңбамен алынған ондық логарифміне тең болатын,ортаның қышқылдығының сандық сипаттамасы,сутектік көрсеткіш рН аталады. рН=-lg[H+]. Гидроксил-иондарының көрсеткіші (рОН)-ерітіндідегі бос гидроксид иондарының концентрациясының теріс таңбамен алынған ондық логарифимине тең шама. рОН=-lg[ОH-] 250 с температурада кез-келген сулы ерітіндіде рН+ рОН=14. Күшті және әлсіз қышкылдар мен күшті және әлсіз негізд ерітінділерінің рН есептеу. Қышқылдар мен негіздірдің рН-ін есептеудің формулалары. Күшті қышқылда: рН=-LgzC күшті қышқылда рН саны 0-3 дейін болу керек.Күшті негіздерде:рН=14+lgzC күшті негіздерде рН саны 4-7 болу керек. Әлсіз қышқылдар: рН=1/2рК-1/2lgC Әлсіз қышқылдарда рН саны 7-9 болу керек ал әлсіз негіздерде рН саны 10-14 ке дейін болып мына формула мен есептелінеді: pH=14-1/2pK+1/2lgC 1ши НУСКА))) Нуска Ферменттік катализ. Биокатализаторлар. Ферменттердің ерекшеліктері.Ферменттер(энзимдер)-тірі ағзалардағы реакцияларды жылдамдадатын жай және күрделі ақуыз молекулаларынан тұратын биологиялиқ катализатор. Субстрат-ферменттің әсеріне ұшырайтын қосылыс. Биокатализатор ферменттердің зат алмасуға, тыныс алуға, ұлпалар мен жасушалардың құрамына маңызды үлес қосады.Ферменттердің ерекшеліктері. 1)Өте жоғары каталитикалық активтилігі 2)Субстратқа және биохимиялық реакцияға таңдамалы түрде әсер ету қасиеті 3)Температура мен орта рН-ның өзгерісіне ерекше сезімталдығы. Ферменттердің ерекше қасиеттеріне олардың термолабильдігі, ортаның реакциясын сезгіштігі және талғампаздығы жатады.Ферменттердің температура өзгерісін сезгіштік қасиеті термолабильділік деп аталады. Ферменттердің ең жоғарғы активтілігі байқалатын температура температуралық оптимум деп аталады. Адам организмінің ферменттері үшін температуралық оптимум 37-410С аралығында болады. Температура жоғарылағанда (80-1000С) ферменттердің активтілігі төмендейді, реакция жүрмейді, себебі 100 оС-та фермент белоктар денатурацияға, яғни 2-, 3-ретті құрылымдары бұзылады. 8 нуска )))Буферлік жүйелер. Жіктелуі. Буферлік әсердің механизмі. Буферлік жүйелер- адамның қан жүйесінде сутектік көрсеткішті реттеп отыратын арнаулы жүйелер. Буферлік жүйелердің жіктелуі:Қышқылдық буферлiк жүйе донор болып есептелетiн әлсiз қышқылдан және акцептордың ролiн атқаратын анионы бар осы қышқылдың тұзынан тұрады.Ацетатты (СН3 СООН, СН3 СООNa). Негіздік буферлік жүйе әлсіз негізден (акцептор) және осы негiздiң катионы (донор) бар тұздан тұрады.Аммиакты:(NН4OH/NH4Cl) Амфолиттік буферлiк жүйе әрi донордың, әрi акцептордың ролiн атқаратын амфотерлiк қосылыстан тұрады.Белоктық:+H3N-R-COO-.Буферлі ерітіндіге қышықл немесе сілті қосқанда не болмаса оларды сұйылтқанда рН өзгермей тұрақты болуын буферлік әсер деп атайды. Буферлік жүйелердің әсер ету механизмдер: Бикарбонатты буфер (NaНСО3 /Н2СО3)1. Егер де жүйеге зат алмасу нәтижесінде қышқылдық қасиеті бар заттар қосылса,NaНСО3 + Н-Анион → Н2СО3 + Na+ + Анион– 2. Зат алмасу кезінде ңегіздік қасиеті бар заттар бөлінсе, буферлік жүйе өзгеріске ұшырайды: H2CO3 + Катион-ОН → Катион+ + HCO3– + Н2 буферлік ерітіндінің сутектік көрсеткіші Гендерсон - Гассельбахтың теңдеуі арқылы анықталады.Қшқылдық буферлер үшін; pH=pKa-lgCa*Va/Cs*Vs; Сілтілік буферлер үшін: pH=14-pkb+lg lgCb*Vb/Cs*Vs Ca(Cb)-қышқыл (негіз) ерітіндісіне концентрациясы; Cs- тұз ерітіндісінің концентрациясы; Vа(Vb)-қышыл(негіз) ерітіндісінің көлемі; Vs- тұз ерітіндісінің көлемі; pkа=-lgKa-қышқылдық көрсеткіш; pkb=-lgKb-сілтілік көрсеткіш. 9нуска)))Ерітінділер, жіктелуі. Ерітінділердің концентрациясын бейнелеу тәсілдері: массалық үлес, молярлық концентрация.Ерітінді- екі немесе одан да көп компонеттерден тұратын гамогенді жүйе.Ерітінді компонеттері;еріткіш,еріген зат.Еріткіш-ерітінді түзілу барысында агрегаттық күйін өзгертпейтін ерітінді компоненті. Егерде 2 компонентте бірдей агрегаттық күйде боса көбірек алынған зат еріткіш болып саналады.Ерітінділердің еріген заттың мөлшері бойынша жіктелуі;қанықпаған,қаныққан,аса қаныққан.Қаныққан ертінді-ерітін зат тұнбасымен динамикалық тепе-теңдік күйде болатын,заттың еру жылдамдығымен кристалдану жылдамдығы тең болатын ерітінді.Қанықпаған ертінді-концентрациясы қаныққан ерітіндінің концентрациясынан төмен болатын, берілген жағдайлар өзгеріссіз болғанда еріген заттың қосымша мөлшерін еріте алатын ерітінді.Аса қанақ ерітінді- концентрациясы қаныққан ерітіндінің концентрациясынан жоғары болатын,термодинамикалық тұрақсыз ерітінді.Ерітінділердің электролиттік диссоциациялануның болуына немесе болмауына орай жіктелуі;бейэлектролит,электролит.Бейэлектролит ерітінділері- электр тоғын өткізетін етітінділер: глюкоза,фруктоза,сахороза.Электролит ерітінділері-электр тоғын өткізетін:NaCl,MgSO4,NaHCO3.Массалық үлес ерітіндідегі еріген заттың массасын көрсетеді:W 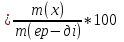 Молярлық концентрация-еріген зат мөлшерініің ерітінді көлеміне қатынасы: С(х) Молярлық концентрация-еріген зат мөлшерініің ерітінді көлеміне қатынасы: С(х)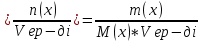 10 - нуска Биогенді элементтер. S, р, d –элементтердің биологиялық рөлі.Биогенді элементтер-бұл тұтас алғанда,ағза жасушаларының құрылысы мен тіршілігіне қажет болатын элементтер. Биогенді S элементтер:Менделеев периодтық жүйесінің IA және IIA топтарында орналасқан; атомның сыртқы қабатында болады. Бір S электроннан-(H,Na,K), немесе екі S электроннан- топшаларында орналасқан;атомның сыртқы қабатында 1-6 ға дейін электрондар болады;валенттік ретінде тек р-электрондар ғана емес сыртқы денгейшелерде S электрондарда бола алады;валенттік электрондар санының қосындысы топ нөмірі мен жоғары тотығу дәрежесіне сейкес келеді.(C,N,O,F,Si,P,S,Cl,Br,I). Биогенді d элементтер;үлкен периодтарда I-VIII қосымша топшалрында s және p элементтер арасында орналасқан;сыртқы d қабат алдындағы орбиталдан толтырылады;ішкі қабаттарында бір-екі 2s электроннан болады. (Cr,Fe,Mn,Co,Cu,Zn,Mo). Натрий-макроэлемент ағзадағы мөлшері 0,08% топографиясы: сүйек тіні, ми, бүйрек,өкпе,ми-жұлын сұйықтығы,өт сұйықтығы. Натрий иондарының биологиялық рөлі:осмостық гомеостозды қамтамасыз ету су алмасуды реттеу, жүйке импулсьтерін беру, тамырларын тонысын реттеу. Cl макроэлемент ағзадағы мөлшері 0,15% топографисы:барлық ұлпалар,асқазан сөлі. Cl биологиялық рөлі: осмостық қысымды денгейде ұстап тұруға қатысу кейц бір ферменттерді активтендіру.Zn иондарының биологиялық рөлі:ақуыздар, көмірсулар, липидтер алмасуынына қатысу мидың дамуына әсер ету,жаралар жазуын тездету. Ерітінділердің коллигативтік қасиеттері. Осмос. Осмостық қысым. Вант-Гофф заңы.Ерітінділердің коллигативтік қасиеттері дегеніміз салыстырмалы сипаттамалары еріген заттың табиғатына тәулсіз,тек бөлшектерінің санына ғана тәуелді қасиеттері:ерітіндінің бетіндегі еріткішдің қаныққан бу қысымының таза еріткішдің бетіндегі қаныққан бу қысымына қарағанда салыстырмалы төмендуі;ұшпайтын заттардың ерітінділерінің қайнау температурасының таза еріткішдің қайнау температурасына қарағанда салыстырмалы жоғарлауы;ерітіндінің қату температурасының таза еріткішдің қату температурасыына қарағанда салыстырмалы төмендуі; осмос және осмостық қысым.Осмос ертікіш молекулаларының өздігінен жартылай өткізгіш мембрана арқылы сұйытылған ерітіндіден концентрлы ерітіндіге қарай бағытталған түрде өтуі. Осмостық қысым (π) осмосты тоқтату үшін ерітіндіге қажет қысым яғни осмос құбылысын тұғызатын күш.Вант-Гофф заңы берілген температурада сұйытылған ерітіндінің осмостық қысымы еріген заттың молярлық концентрациясына тура пропорцианал. π =CRT, С-ерітіндінің молярлық массасы, моль/л; R-8,314 дж/(моль*К); Т-температура, К. Күшті және әлсіз қышкылдар мен күшті және әлсіз негізд ерітінділерінің рН есептеу. Қышқылдар мен негіздірдің рН-ін есептеудің формулалары. Күшті қышқылда: рН=-LgzC күшті қышқылда рН саны 0-3 дейін болу керек.Күшті негіздерде:рН=14+lgzC күшті негіздерде рН саны 4-7 болу керек. Әлсіз қышқылдар: рН=1/2рК-1/2lgC Әлсіз қышқылдарда рН саны 7-9 болу керек ал әлсіз негіздерде рН саны 10-14 ке дейін болып мына формула мен есептелінеді: pH=14-1/2pK+1/2lgC Осмостың биологиялық маңызы. Изо-, гипо-және гипертоникалық ерітінділер. Лизис, плазмолиз, гемолиз. Осмостың биологиялық маңызы;изотондық ерітінділер-осмостық баланстық бұзылуын болдырмау үшін тамыр арқылы егуге;глаубер тұзы және ащы тұз –ішті жүргізетін препараттар ретінде;дәкеден жасалған гипертонды танғыштар мен ауырғанда күре тамыр арклылы егуге қолданылады. Изотондық ерітінділер-осмостық қысымы бірдей ерітінділер. Гипертонды ерітінділер-стандартты ерітіндімен салыстырғанда осмостық қысымы жоғары ерітінділер.Гипотонды ерітінділер-стандарты ерітіндімен салыстырғанда осмостық қысымы төмен ерітінділер.Гемолиз-жасушаны гипотонды ерітіндіге салғанда жасушаның ісіну құбылысы.Плазмолиз-жасушаны гипертонды ерітіндіге батырғанда жасушаның жиырылу құбылысы. Лизис-жиырлған жасушаны изотонды ерітіндіге батырғанда оның бастапқы күйіне келу құбылысы Комплексті қосылыстар. Жіктелуі.Комплексті қосылыстар-қатты күйіндеде еріген куйіндеде өз құрамын тұтас сақтайтын күрделі иондар немесе молекулалардан тұратын қосылыстар. Комплексті қосылыстардың жіктелуі; Комплексті ионның заряды бойынша:катионды,анионды,бейтарап. Комплексті түзуші лигандалардың түрі бойынша,құрамында молекула түріндегі монодентантты лигандалыр бар комплестар:акво,аммиактар,карбонилдер және басқалар.Құрамында ион түріндегі лигандалыр бар комплесктер; гидроксокомплекстер,фторокомплестер,цианокомплесктер және басқалар. Лигандалардың табиғатына сәйкес комплескті қосылыстарды мына топтарға жіктеледі: гидрадти,ацидокомплекстер,аммиактар және амминаттар,циклді немесе сақина тәрізді қосылыстар. Гидрадти комплекстер- ішкі немесе сыртқы сферасында суц молекуласы бар қосылыстар егер су молекуласы комплекстің ішкі сферасында болса оларды акво комплекстер деп атайды. Ацидокомплекстер-легандалар қышқыл қалдықтарынан тұратын к.қ. Аммиактар лигандалары тек реакцияларды жылдамдадатын жай және күрделі ақуыз молекулаларынан тұратын биологиялиқ катализатор. Реакция жылдамдығының температураға тәуелдігі. Вант – Гофф ережесі. Температура жоғарылаған сайын химиялық реакцияның жылдамдығы артады,гомегендік реакциялар жылдамдығының температураның жоғарлауына байланысты артуын 1884 жылы ашылған Вант-Гофф ережесі анықтайды. Вант – Гофф ережесі.Температураны әр бір 10 градусқа көтергенде реакция жылдамдығы 2-4 есе артады.γ=ν2/ ν1=Kt1+10/Kt1=2-4 есе γ-температуралық коэффиценті тәжірибе жүзінде анықталады және оның мәні 2,3,4 болуы мүмкін.К-t10болғанындағы жылдамдық константасы,Кt1-10-t1-100 . Жоғарыдағы теңдікті былйша өзгертіп жазуға болады: νt2= νt1 γt2-t1/10. Адам организмінде ферменттің қатысыумен жүретін реакциялар жылдамдығыда температураға тәуелді,бірақ олардың басқа химиялық реакциядан оптималдық температурада болуы. Комплексті қосылыстардың құрылымы. А.Вернердің координациялық теориясы.Комплекс түзуші ион (орталық атом ) –компелксті қосылыстың молекуласының орталығында орналсқан көбіне өң зарядты болып келетін ион.Лигандалар-орталық атомды қоршай орналасатын молекулалар,атомдар немесе иондар. Комплексті қосылыстың құрылымы мысал ретінде К4 [Fe(CN)6] комплексті қосылысын алғанда: орталық атом-Fe2+; координациялық сан-6; лигандалар-6CN; ішкі координациялық сфера- [Fe(CN)6]4-; сыртқы кординациялық сфера-4 K+; Вернердің (1893 жылы) координациялық теориясы:комплексті қосылыстарда оны түзуші металл ионынан тұратын коодинациялық сфера боладыда оның маңайында теріс зарядталған аниондар немесе электр бейтарап молекулалар лигандалар орналасады. Металл ионы мен осы аталған лигандалар комплекс қосылысының ішкі сферасын тұз Буферлік сиымдылық. Буферлік ерітінділердің рН есептеу. Гендерсон- Гассельбах теңдеуі. Ерітіндінің буферлік сыйымдылығы-буферлік ерітіндіге күшті қышқыл немесе күшті негіз қосқанда,оның реакцияның ортасынынң өзгерісіне қарсы әрекетге қабілеттілігін сипаттайтын шама. Ерітіндінің буферлік сыйымдылығы(В)-1 литр буферлік ерітіндінің рН ның мәнін бір бірлікке өзгерті үшін қосылатын күшті қышқылдың немесе күшті негіздің мол-эквивалентінің сандық мәніне тең болатын шама. Буферлік сыйымдылықты қышқыл бойынша анықтау (Ва)Ba=Ca*Va/Vб*∆рН Са-күшті қышқыл эквивалентінің молярлық концентрациясы, моль/л, Va-қосылған күшті қышықыл көлемі,мл, Vб-буферлік ерітіндінің көлемі,мл, ∆рН- күшті қышқыл қосқан кездегі буферлік ерітіндінің сутектң көрсеткішінің өзгерісі. Буферлік ерітіндінің сутектік көрсеткіші Гендерсон - Гассельбахтың теңдеуі арқылы анықталады.Қшқылдық буферлер үшін; pH=pKa-lgCa*Va/Cs*Vs; Сілтілік буферлер үшін: pH=14-pkb+lg lgCb*Vb/Cs*Vs Ca(Cb)-қышқыл (негіз) ерітіндісіне концентрациясы; Cs- тұз ерітіндісінің концентрациясы; Vа(Vb)-қышыл(негіз) ерітіндісінің көлемі; Vs- тұз ерітіндісінің көлемі; pkа=-lgKa-қышқылдық көрсеткіш; pkb=-lgKb-сілтілік көрсеткіш. Комплексті қосылыстардың құрылымы. А.Вернердің координациялық теориясы.Комплекс түзуші ион (орталық атом ) –компелксті қосылыстың молекуласының орталығында орналсқан көбіне өң зарядты болып келетін ион.Лигандалар-орталық атомды қоршай орналасатын молекулалар,атомдар немесе иондар. Комплексті қосылыстың құрылымы мысал ретінде К4 [Fe(CN)6] комплексті қосылысын алғанда: орталық атом-Fe2+; координациялық сан-6; лигандалар-6CN; ішкі координациялық сфера- [Fe(CN)6]4-; сыртқы кординациялық сфера-4 K+; Вернердің (1893 жылы) координациялық теориясы:комплексті қосылыстарда оны түзуші металл ионынан тұратын коодинациялық сфера боладыда оның маңайында теріс зарядталған аниондар немесе электр бейтарап молекулалар лигандалар орналасады. Металл ионы мен осы аталған лигандалар комплекс қосылысының ішкі сферасын тұзеді. Термодинамика. Заңдылыктары жылу және жұмыс шамалары бойынша химиялық реакцияның жүруін санды түрде сипаттауға мүмкіндік туындайды және осы мәселемен айналысатын ілімді химиялық термодинамика деп атайды.Термодинамикалық жүйе - сыртқы қоршаған ортадан ойша белініп қарастырылатын, өзара жылу және механикалық әсерлесуде болатын дене не заттар жиыны, тобы. Термодинамикалық жүйені жабық, ашық және оқшауланған деп үшке бөледі. Жүйе - өзін қоршаған ортамен зат алмаспай тек энергиясымен ғана алмасса - жабық, ал зат алмасуы да орын алса - ашық жүйе деп аталады. Оқшауланған (изолированный) жүйеде - қоршаған ортамен зат және энергия алмасуы орын алмайды. Жүйені құрайтын дене бөліктері белгілі бip кеңістік бөлігінде бетпен шектеліп, және де сол бөліктің өн бойында химиялық құрамы, құрылымы, термодинамикалық қасиеттері бірдей болса, онда осы бөлікті – фаза – деп атайды. жүйе құрайтын фазалар бірдей агрегаттық күйде болса - біртекті (гомогенді), ал әртүрлі күйде болса - әртекті (гетерогенді) деп бөлінеді. Кез-келген күй шамаларыныц өзгepici термодинамикалық құбылыс(процесс) деп аталынады да күй шамасының тұрақтылығына қарай төмеңдегіше жіктелінеді: р = const – изобарлы, V = const – изохорлы,Т = const – изотермиялы, 1. термодинамика 1 заңы энтальпия термодинамикалық жүйені толықтау сипаттайтын энергетикалық шама. 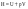 – болғандықтан, энтальпия шамасы да күй функциясы болып табылады, оған ішкі энергия қасиеттерінің бәрі де тән. Энтропияға мынадай факторлар әсер етеді: 1.Температура жоғарылағанда, энтропия жоғарылайды, себебі температура артқанда, ретсіздік артады. 2. Заттар кристалданған күйден аморфты күйге немесе сұйыққа, сұйықтан газға айналғанда, энтропия күрт жоғарылайды, себебі ретсіздік артады. 3. Қысымның жоғарылауы энтропияға температураның төмендеуі сияқты әсер етеді. Химиялық реакцияның энтропия өзгерісі энтальпияның өзгерісі сияқты есептеледі: ΔS = ∑ΔSт.з. ∑ΔSб.з. Конденсацияланған жүйелерде жүретін реакциялардың әртүрлі температуралардағы жылу эффектлерін салыстырғанда, олардың жылу эффектлері төменгі температуралар аймағындағы абсолютті нольге жақындағанда бір біріне жуықтайды. Осыдан термодинамиканың III заңы немесе температураның абсолюттік нольге жуықтамау қағидасы туындайды – болғандықтан, энтальпия шамасы да күй функциясы болып табылады, оған ішкі энергия қасиеттерінің бәрі де тән. Энтропияға мынадай факторлар әсер етеді: 1.Температура жоғарылағанда, энтропия жоғарылайды, себебі температура артқанда, ретсіздік артады. 2. Заттар кристалданған күйден аморфты күйге немесе сұйыққа, сұйықтан газға айналғанда, энтропия күрт жоғарылайды, себебі ретсіздік артады. 3. Қысымның жоғарылауы энтропияға температураның төмендеуі сияқты әсер етеді. Химиялық реакцияның энтропия өзгерісі энтальпияның өзгерісі сияқты есептеледі: ΔS = ∑ΔSт.з. ∑ΔSб.з. Конденсацияланған жүйелерде жүретін реакциялардың әртүрлі температуралардағы жылу эффектлерін салыстырғанда, олардың жылу эффектлері төменгі температуралар аймағындағы абсолютті нольге жақындағанда бір біріне жуықтайды. Осыдан термодинамиканың III заңы немесе температураның абсолюттік нольге жуықтамау қағидасы туындайды |
