Тема 26. Основы теории цветности. 4 Теория цветности
 Скачать 67.01 Kb. Скачать 67.01 Kb.
|
|
4.3.3. Теория цветности 4.3.3.1. Физические основы Цвет красителей является следствием их взаимодействия со светом, в результате которого происходит поглощение части световых лучей определенной длины волны. Процессы поглощения световых лучей органическими соединениями изучает теория цветности. Световой луч представляет собой поток фотонов — отдельных порций (квантов) электромагнитной энергии, величина которых Е (кДж) выражается уравнением Планка
где ν — частота электромагнитных колебаний, с–1; h — постоянная Планка, 6,62 · 10–37 кДж · с. Каждому фотону соответствует определенная длина электромагнитной волны, связанная с частотой колебаний уравнением
где λ — длина волны, выражаемая обычно в метрах или нанометрах (м, нм); с — скорость света, равная в вакууме 3 · 108 м/с = 3 · 1017 нм/с. Волновое число ν — величина, обратная длине волны; фактически это число волн, помещающихся в единице длины, например, в 1 см (если ν выражена в см–1), νλ = 1. Электромагнитный спектр охватывает диапазон длин волн λ от 10–14 до 106 м. Этим длинам волн соответствуют частоты колебаний ν от 3 · 1022 до 3 · 102 см–1, энергии фотонов Е от 2 · 10–14 до 2 · 10–34 кДж. Из всего этого огромного диапазона электромагнитной энергии зрительный аппарат человека способен воспринимать как ощущение света воздействие фотонов лишь в узком интервале энергий: ≈ от 2,5 · 10–22 до 5 · 10–22 кДж. Этим фотонам соответствуют световые лучи с частотами колебаний ν от 4 · 1014 до 7,5 · 1014 см–1 и длинами волн λ от 760 до 400 нм (видимая часть спектра). Световые лучи, выходящие за пределы этого интервала, не вызывают у нас зрительных ощущений. Невидимые лучи с длинами волн меньше 400 нм называются ультрафиолетовыми, больше 760 нм — инфракрасными. Особенностью зрительного восприятия человека является то, что при совместном действии всех световых лучей с длинами волн от 400 до 760 нм возникает ощущение так называемого белого неокрашенного света. Раздельное действие на зрительный аппарат световых лучей в более узких интервалах длин волн (монохроматический свет) производит ощущение окрашенного света (спектральные цвета), причем характер окраски (цвет) строго зависит от длин волн лучей, входящих в эти узкие интервалы. При взаимодействии белого цвета с различными веществами могут наблюдаться следующие явления: 1. Все лучи видимой части спектра полностью отражаются непрозрачной поверхностью или полностью проходят сквозь прозрачное вещество; в этом случае непрозрачное вещество кажется белым, а прозрачное — бесцветным. 2. Все лучи видимой части спектра полностью поглощаются веществом; вещество кажется черным. 3. Все лучи видимой части спектра частично поглощаются веществом, а частично отражаются им; вещество имеет серый цвет. 4. Вещество избирательно поглощает некоторые лучи видимой части спектра, остальные лучи проходят сквозь вещество или отражаются от него; вещество представляется окрашенным (цветным). Цвета, ощущение которых возникает в результате воздействия на зрительный аппарат всех световых лучей видимой части спектра за вычетом поглощенных лучей, называются дополнительными. Совместное действие дополнительных и спектральных цветов производит ощущение белого цвета (дополнительные цвета «дополняют» спектральный цвет до белого). Цвета предметов в естественных условиях, как правило, являются дополнительными. Например, тело избирательно поглощает лучи с длинами волн от 500 до 560 нм; при действии на зрительный аппарат эти лучи вызывают ощущение спектрального зеленого цвета. Поскольку эти лучи поглощаются, то воздействие оставшихся лучей видимой части спектра, т. е. лучей с длинами волн от 400 до 500 нм и от 560 до 760 нм, вызывает ощущение дополнительного цвета, и окраска предмета нам кажется пурпурной. Как и все дополнительные цвета, пурпурный цвет является смешанным, т. к. ощущение его вызывается совместным действием монохроматических лучей, порознь производящих ощущение фиолетового, синего, оранжевого, желтого и др. В табл. 4.3.1 приведена зависимость спектральных и дополнительных цветов от длины волны. Таблица 4.3.1 Соотношение между основными и дополнительными цветами Таким образом, причиной окраски (цвета) предмета является избирательное поглощение им части световых лучей из общего светового потока в видимой области электромагнитного спектра. Поглощение и отражение света окрашенными телами может быть измерено. Для этого используют специальные приборы — спектрофотометры. В спектрофотометрах свет лампы с помощью кварцевых призм разлагается на отдельные составляющие этот свет монохроматические излучения, которые поочередно пропускают через исследуемый объект. Объектами исследования могут быть растворы красителей, цветные прозрачные пленки (поглощение света) и окрашенные непрозрачные поверхности (отражение света). Краситель поглощает некоторую часть направленного на него светового потока, в результате чего интенсивность прошедшего или отраженного излучения уменьшается. Уменьшение интенсивности светового луча регистрируется фотоэлементом. Поглощение света для достаточно разбавленных растворов красителя, в которых отсутствует ассоциация частиц растворенного вещества, подчиняется закону Бугера — Ламберта — Бера. Согласно этому закону
где I0 и I — интенсивности светового луча до и после прохождения раствора соответственно; ε — мольный коэффициент поглощения (коэффициент погашения, коэффициент экстинкции), характерный для данного вещества; с — концентрация вещества в растворе, моль/л; l — толщина слоя раствора, см; D — оптическая плотность. Определив изменение интенсивности светового потока для каждой длины волны, строят график зависимости ε от λ, откладывая по оси абсцисс длины волн λ, а по оси ординат — мольные коэффициенты поглощения ε или lgε. Полученный график называется спектральной кривой поглощения или спектром поглощения (рис. 4.3.1). Положение максимума на кривой по оси абсцисс характеризует цвет (окраску) вещества, по оси ординат — интенсивность поглощения (интенсивность окраски). Изменение цвета, соответствующее сдвигу максимума поглощения в сторону лучей с большей длиной волны, называется углублением цвета или батохромным сдвигом (от греческих слов «батос» — глубина и «хрома» — цвет). Изменение цвета в обратном направлении называется повышением цвета или гипсохромным сдвигом (греч. «гипсос» — высота). Увеличение интенсивности поглощения называется гиперхромным эффектом (греч. «гипер» — над, возвышение), уменьшение — гипохромным эффектом (греч. «гипо» — под, снижение). Если цвет вещества определяется положением максимума поглощения на оси длин волн, то оттенки этого цвета зависят от общего характера кривой поглощения. Красители, отличающиеся чистым, ярким оттенком, имеют узкие полосы поглощения, которые изображаются кривой с четко выраженными максимумами и круто падающими склонами, например фиолетовый краситель (рис. 4.3.2). Чем более пологи склоны кривой, т. е. чем шире полоса поглощения, тем менее чист и ярок оттенок красителя. Так, желтый, оранжевый и красный цвета приобретают коричневый оттенок, синий — черноватый, зеленый переходит в оливковый и т. д. Для красителей «нечистых» тонов (оливковых, коричневых, серых, черных) — характерно отсутствие четкого максимума на кривой поглощения (рис. 4.3.3). Многие красители имеют сложную кривую поглощения с несколькими максимумами или с дополнительными нечеткими максимумами в виде изгиба («плеча») кривой поглощения. В этих случаях цвет вещества является результатом суммарного действия дополнительных цветов. Так, наличие двух максимумов (одного в области 400–430 нм, а другого в области 600–700 нм) обусловливает результирующий зеленый цвет (сложение дополнительных цветов: желтого и голубого, рис. 4.3.4). 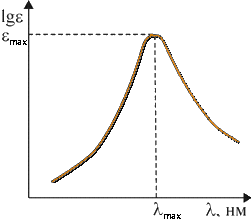 Рис. 4.3.1. Спектральная кривая поглощения 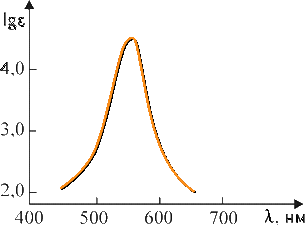 Рис. 4.3.2. Кривая поглощения фиолетового красителя 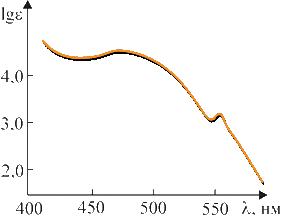 Рис. 4.3.3. Кривая поглощения коричневого красителя 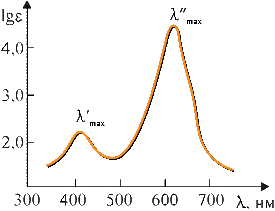 Рис. 4.3.4. Кривая поглощения зеленого красителя 4.3.3.2. Энергия возбуждения молекул и цвет Причиной избирательного поглощения световых лучей определенных длин волн, т. е. фотонов определенной энергии, является квантованность внутренней энергии молекул. Поскольку каждому виду молекул свойственны строго определенные значения (уровни) внутренней энергии, переход от одного значения к другому совершается скачкообразно, путем поглощения или выделения только такого кванта (порции) энергии, который сразу переводит молекулу с одного, присущего ей энергетического уровня, на другой. Вследствие этого молекула способна поглотить из светового потока только такие фотоны, энергия которых соответствует разности характерных для нее уровней энергии. Все остальные фотоны большей или меньшей энергии не будут поглощаться данным веществом. Если энергию молекулы в обычном, нормальном состоянии, называемом основным, обозначить через Е0, а энергию в состоянии возбуждения, в которое молекула переходит в результате поглощения света, через Е*, то разность ΔЕ = Е* – Е0, называемая энергией возбуждения, будет соответствовать энергии фотона, избирательно поглощаемого данной молекулой. Так как Е = hν, а νλ = с, то связь между длиной волны избирательно поглощаемого света и энергией возбуждения для одной молекулы можно выразить уравнением
Подставляя значения NA= 6,02 · 1023 моль–1, h = 6,62 · 10–37 кДж · с, с = 3 · 1017 нм/с, получим: ΔЕ ≈ 12 · 104 / λ (кДж/моль). Расчет по этой формуле показывает, что на границах видимой части спектра (λ равно 400 и 760 нм) энергия возбуждения ΔЕ соответствует 300 и 158 кДж/моль. Следовательно, окраской обладают только те вещества, которые переходят в возбужденное состояние от поглощения порций энергии в пределах 158–300 кДж/моль. Если энергия возбуждения ΔЕ > 300 кДж/моль, вещество поглощает в ультрафиолетовой (УФ) области спектра, если ΔЕ < 158 кДж/моль, вещество поглощает в инфракрасной (ИК) области спектра. В обоих случаях вещество кажется нам бесцветным. Таким образом, в спектре поглощения соединения величина λмакс, характеризующая цвет (окраску) вещества, является мерой энергии возбуждения его молекул, а величина εмакс, характеризующая интенсивность окраски (интенсивность поглощения), — мерой вероятности того, что при взаимодействии со светом с длиной волны λмакс молекула вещества захватит соответствующий фотон и перейдет в возбужденное состояние. Ауксохромы и хромофоры, 1) группы атомов (—ОН, —NH2, —SH и др.), сообщающие окрашенному веществу способность закрепляться на тканях, усиливающие и часто углубляющие цвет красящего вещества (ауксохромы); 2) группы атомов (—СН=СН—, —CH=N—, —N=N—, =С=О и др.), сообщающие окрашенность органическому веществу (хромофоры). Представление об ауксохромах и хромофорах выдвинуто в 1876 немецким химиком О. Виттом, оно составляло основу одной из первых теорий цветности. ГАЛОХРОМИЯ, способность некоторых органических соединений углублять (усиливать) свой цвет при действии кислот. Впервые явление галохромии было замечено на дибензальацетоне С6Н5∙СН: СН∙СО∙СН:СН∙С6Н5, веществе желтого цвета, который при действии соляной кислоты переходит в оранжево-красный. Простейшим примером галохромии является растворение бензальдегида в крепкой серной кислоте с желтым цветом. Целый ряд экспериментов дал возможность расширить понятие галохромии, равно как и предложить теоретические его обоснования. В настоящее время принято считать, что к явлению галохромии способны лишь соединения, обладающие циклическим строением и имеющие карбонильную группу >СО. К ним относятся альдегиды и кетоны, в первую очередь, а также и карбоновые кислоты, их эфиры и амиды. Хромия – это обратимое изменение окраски (цвета, оттенка, интенсивности) под воздействием каких-то внешних физических, химических и физико-химических импульсов. Хромию не следует путать с необратимыми изменениями, когда происходит деструкция окрашенной системы. Эти необратимые изменения колористики оценивают в баллах, как устойчивость окраски к различным факторам. Различают следующие виды хромии в зависимости от того, под влиянием какого фактора, импульса происходит обратимое изменение цвета: фото-, термо-, хемо-, сольвато-, механо-, электро-, магнитохромия. Фотохромия (обратимое изменение цвета или светопропускания) – под воздействием электромагнитного излучения, в том числе естественного (солнечный свет) или искусственного источника облучения. С этим негативным явлением химики-колористы сталкиваются, когда используют красители с высокой склонностью к фотохромии. Изделия из окрашенного такими красителями материала под действием яркого солнечного света ощутимо изменяет свой оттенок окраски, но именно обратимо, и в темноте (в шкафу, ночью) окраска возвращается к первоначальному цвету. Однако явление это гистерезисное и через определенное число циклов окраска теряет свою интенсивность (фотодектрукция). Как правило, красители склонные к фотохромии имеют недостаточно высокую светостойкость. Склонность красителей к фотохромии оценивается по стандарту ISO. Термохромия – обратимое изменение окраски (цвета, оттенка) при нагревании окрашенного объекта. Это явление мы наблюдаем в быту, когда гладим окрашенные изделия из текстиля; особенно сильно термохромия проявляется, если изделия перед глажкой увлажнить. Через определенное время после охлаждения окраска возвращается к исходному цвету. Склонность к термохромии у каждого красителя разная; на тканях из синтетических волокон она проявляется сильнее. Хемохромия – обратимое изменение окраски при действии химических реагентов (изменение рН, действие окислителей и восстановителей). Какой химик не использовал цветные реакции индикаторных красителей для определения рН среды? Все индикаторные красители – хемохромы. Технология колорирования кубовыми пигментами (обычно называют красителями) основано на обратимых окислительно-восстановительных процессах: сначала перевод нерастворимого окрашенного пигмента в более слабоокрашенную лейкоформу с помощью восстановителей в щелочной среде, а затем вновь в окрашенный пигмент окислением. Сольватохромия – обратимое изменение окраски при смене растворителя (полярного на неполярный и обратно). Механохромия – обратимое изменение окраски (цвета) при деформационных нагрузках на окрашенный материал. Электрохромияи магнитохромия – обратимое изменение окраски при пропускании различных видов тока и действии магнитного поля на окрашенный объект. Общие механизмы хромии У всех этих видов хромии имеется общий механизм, но очевидны и специфические особенности, связанные с природой (физика, химия, физико-химия) самого импульса. Как было сказано ранее, окраска, цвет при всех прочих необходимых условиях (о них был уже разговор) обусловлены химическим строением вещества или физической наноструктурой, которые делают вещество, объект, материал окрашенными и цветными. В случае окраски, в образовании которой участвуют окрашенные вещества (красители, пигменты), молекулы этих веществ должны иметь специфическое строение, отвечающее за избирательное поглощение лучей видимой части спектра. В случае органических красителей и пигментов, та часть их молекулы, которая определяет это свойство, называется хромофором. По теории цветности хромофор у органических веществ – это структура с достаточно протяженной системой сопряженных двойных связей (конъюгация). Чем длиннее цепочка сопряжений, тем более глубокий цвет имеют вещества, построенные из таких молекул. Сопряженная система связей характеризуется определенной плотностью π- и d-электронов и, как следствие, при взаимодействии с лучами солнечного света (его видимой части) вещество способно поглощать избирательно часть их. Следовательно, явление хромизма обязательно связано с обратимым образованием или изменением хромофорной структуры. Если окраска, цвет обусловлена наличием строго организованной наноструктуры (структурная окраска), то хромизм связан с обратимой организацией или дезорганизацией этой структуры под воздействием внешних импульсов. Под воздействием внешних факторов не обязательно должно происходить обратимая химическая модификация молекулы, но очень часто это связано с пространственной изомерией (например, цис-транс изомерия азокрасителей), переход из аморфного состояния в кристаллическое (кубовые на стадии мыловки кипящими растворами ПАВ) и др. 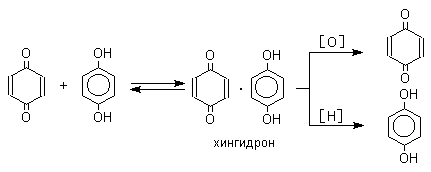 Окрашенный в темнозеленый цвет хингидрон представляет собой классический пример молекулярных комплексов, где один компонент служит донором, а другой - является акцептором электрона. Такие комплексы, где происходит перекрывание ВЗМО донора и НСМО акцептора, получили название комплексов с переносом заряда. К ним относятся КЛАССИФИКАЦИЯ КРАСИТЕЛЕЙ Средства для окрашивания текстильных материалов можно классифицировать на красители и пигменты. Термины «краситель» и «пигмент», хотя их часто используют как равнозначные, обозначают четко различающиеся функции при окрашивании текстильных материалов. Краситель –это вещество, которое – по крайней мере на какой-то стадии обработки - обладает внутренним сродством к окрашиваемому материалу (притяжением к нему). Красители растворимы в красильной среде на некоторой стадии процесса крашения. Они проникают внутрь материала и образуют более или менее прочную связь с волокнами. Все текстильные красители – органические вещества. Пигмент – это вещество, применяемое для придания окраски поверхности ткани. Пигменты не обладают внутренним сродством с текстильными материалами и удерживаются на них с помощью специальных химических препаратов. Пигменты могут быть как органическими, так и неорганическими веществами. Красители можно классифицировать как по способу применения, так и по химической структуре. Технологи, занимающиеся крашением, классифицируют красители по способу применения. Специалисты-химики, занимающиеся синтезом красителей и изучающие взаимосвязи между структурой и свойствами веществ, классифицируют красители по химической структуре. КЛАССИФИКАЦИЯ ПО СПОСОБУ ПРИМЕНЕНИЯ. В текстильной промышленности обычно используются красители восьми основных классов. Первые пять классов красителей (прямые, сернистые, азоидные, реактивные и кубовые) используются в основном для крашения целлюлозных волокон, например хлопковых и вискозных. Последние три класса красителей (кислотные, основные и дисперсные) применяются для крашения других натуральных и синтетических волокон. ПРЯМЫЕ КРАСИТЕЛИ. Эти анионные водорастворимые красители называются так потому, что обладают высоким сродством к целлюлозным волокнам и могут применяться без вспомогательных химических средств. Однако на практике скорость крашения и интенсивность окраски могут быть увеличены добавками неорганических солей, например хлорида или сульфата натрия. Прямые красители широко используются для крашения хлопковых и вискозных тканей. Их наибольшее достоинство – простота применения, а недостаток в том, что в ряде случаев они неустойчивы к мокрым обработкам. Устойчивость прямых красителей к мокрым обработкам повышают введением закрепителей и с помощью различных технологических приемов. СЕРНИСТЫЕ КРАСИТЕЛИ. Сернистые красители – это органические соединения, получаемые нагревом соединений из группы аминов или фенолов в присутствии серы. Сернистые красители существуют в форме пигментов, не обладающих сродством к целлюлозе. В процессе обработки сернистыми красителями используются химические реакции восстановления и окисления. Путем восстановления сернистые красители переводятся в водорастворимую форму, обладающую сродством к целлюлозе. После их поглощения волокнами сернистые красители надо окислить для обратного преобразования в пигментную форму. Наибольшее достоинство сернистых красителей – низкая стоимость. К недостаткам относятся невысокая яркость и, в некоторых применениях, низкая устойчивость к мокрым обработкам и воздействию света. АЗОИДНЫЕ КРАСИТЕЛИ. Эти красители синтезируются внутри волокон в ходе реакции двух компонентов, ни один из которых не является красителем. Поскольку один из компонентов – нафтол, азоидные красители иногда называют нафтоловыми. Вещество, образующееся при азоидном крашении, является пигментом. Однако азогены классифицируются как красители, потому что отдельные их компоненты действуют как таковые перед тем, как они прореагируют внутри волокна с образованием пигмента. Важное достоинство азоидных красителей состоит в том, что они обеспечивают дешевый способ получения оттенков некоторых цветов, особенно красного. Их недостаток – не всегда достаточная устойчивость к трению. РЕАКТИВНЫЕ КРАСИТЕЛИ. Реактивные красители, иногда называемые активными или волоконно-реактивными, разработаны в 1950-х годах. Реактивные красители образуют химическое соединение с волокном и становятся его частью. Поскольку связь между красителем и волокном прочна, реактивные красители очень устойчивы к мокрым обработкам, что является их основным достоинством. Реактивные красители, как правило, дороже прямых, сернистых и азоидных. Устойчивость реактивных красителей к воздействию хлора и других отбеливателей иногда бывает невысокой. КУБОВЫЕ КРАСИТЕЛИ. Эти красители похожи на сернистые в том отношении, что они являются пигментами, т.е. в процессе обработки сначала должны быть восстановлены, а потом окислены. На этом, однако, их сходство заканчивается. Кубовые красители обладают, как правило, очень высокой устойчивостью к мокрым обработкам и воздействию света; исключение составляет индиго. Большой недостаток кубовых красителей – высокая стоимость. КИСЛОТНЫЕ КРАСИТЕЛИ. Кислотные красители называются так потому, что содержат в своей структуре кислотные группы. Кислотные группы красителя реагируют с основными группами белковых (шерсть и шелк) и полиамидных (найлон) волокон с образованием связей между красителем и волокном через органические солевые группы. Эти связи прочны и придают окраске высокую устойчивость к мокрым обработкам. ОСНОВНЫЕ КРАСИТЕЛИ. Эти красители иногда называют катионными, потому что молекула красителя содержит положительный заряд. Основные группы красителя реагируют с кислотными группами акриловых, полиэфирных и полиамидных волокон, поддающихся крашению катионными красителями, а также белковых волокон. При этом между красителем и волокнами образуются связи примерно таким же путем, как в реакциях между кислотными красителями и волокнами (см. выше). Недостаток основных красителей – низкая устойчивость окраски к свету, особенно для белковых волокон. ДИСПЕРСНЫЕ КРАСИТЕЛИ. Дисперсные красители используются в основном для крашения полиэфирных, полиамидных и ацетилцеллюлозных волокон, хотя они могут окрашивать и другие волокна. Дисперсные красители почти нерастворимы в воде и должны быть диспергированы в ней для образования красильной ванны. Эти красители были разработаны в 1920-х годах специально для крашения ацетилцеллюлозных волокон. Дисперсные красители – единственный вид красителей, пригодных для крашения ацетатных и немодифицированных полиэфирных волокон. КЛАССИФИКАЦИЯ ПО ХИМИЧЕСКОЙ СТРУКТУРЕ. В молекулах красителей присутствуют разнообразные структурные группы. Однако свыше половины всех красителей можно классифицировать как азокрасители или антрахиноновые красители. АЗОКРАСИТЕЛИ. Азогруппы, т.е. два атома азота, соединенные двойной связью, обусловливают цвет свыше половины всех промышленно производимых красителей. Азогруппа -N=N- является сильным хромогеном (источником цвета), и поэтому азокрасители обычно обладают высокой красящей способностью. Молекулы азокрасителей могут содержать от одной до четырех, а иногда и больше азогрупп. Моноазокрасители (одна азогруппа) наиболее важны, дисазокрасители (две азогруппы) – вторые по значению. Азогруппы соединены с ароматическими ядрами, например бензолом или нафталином, которые в качестве заместителей могут содержать хлор и бром, а также нитро-, амино- и другие группы. Общая структурная формула моноазокрасителя может быть записана в виде A-N=N-B, где A и (или) B - ароматические ядра. Все азокрасители – синтетические соединения, не имеющие натуральных аналогов. Число теоретически возможных молекул с азогруппами чрезвычайно велико. АНТРАХИНОНОВЫЕ КРАСИТЕЛИ. По своему практическому значению антрахиноновые красители уступают только азокрасителям. Хотя антрахиноновые красители имеют более яркий цвет, чем азокрасители, они дороже их и слабее по красящей способности. |
