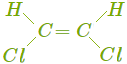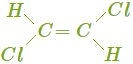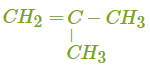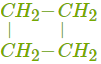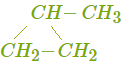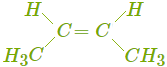Непредельные углеводороды. Алкены алкены это непредельные (ненасыщенные) углеводороды с одной двойной связью в молекуле
 Скачать 408.19 Kb. Скачать 408.19 Kb.
|
|
НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ. АЛКЕНЫ Алкены — это непредельные (ненасыщенные) углеводороды с одной двойной связью в молекуле. Простейший представитель алкенов имеет строение CH2=CH2. Это этилен (этен). Этилен — бесцветный газ, немного легче воздуха. У него малозаметный сладковатый запах. Алкены (этиленовые углеводороды) — это непредельные (ненасыщенные) углеводороды с одной двойной связью в молекуле. Общая формула алкенов — CnH2n. Начинается гомологический ряд с этилена. Его состав — C2H4. В молекуле каждого алкена есть одна двойная связь, а состав каждого следующего гомолога отличается от предыдущего на группу CH2. Наличие двойной связи в названиях веществ обозначается суффиксом -ен (вместо -ан у алканов). Формулы и названия некоторых алкенов приведены в таблице.
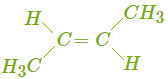
НОМЕНКЛАТУРА АЛКЕНОВ Согласно правилам международной номенклатуры ИЮПАК, алкен называют, заменяя в названии соответствующего алкана суффикс «ан» на «ен»: C2H4 — этен, C3H6 — пропен и т. д. Положение двойной связи указывают цифрой: CH2=CH−CH2−CH3 — бутен-1, CH2−CH=CH−CH3 — бутен-2. Используются также тривиальные названия алкенов: этилен, пропилени др. Чтобы назвать вещества с разветвлённой углеродной цепью или с заместителями, выбирают самую длинную цепь углеродных атомов и её нумеруют. Атомы нумеруются с того конца, к которому ближе двойная связь. Пример 1. Назовём алкен такого строения. 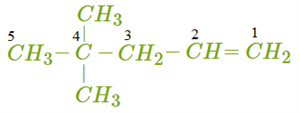 Самая длинная цепь в этой молекуле содержит пять атомов углерода. Нумерацию начинаем справа, так как между первым и вторым атомами углерода расположена двойная связь. В молекуле два радикала CH3. Указываем цифрами через запятую положение каждого радикала 4, 4, ставим дефис (-), указываем число и название радикалов (диметил), добавляем название главной цепи (пентен) и указываем положение двойной связи: 4, 4-диметилпентен-1. Если в молекуле содержатся разные радикалы или заместители, то их называют в алфавитном порядке. Пример 2. Назовём галогенпроизводное следующего алкена. 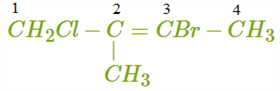 Выбираем и нумеруем самую длинную цепь. Здесь двойная связь находится посередине углеродной цепи, поэтому начало нумерации определяем по заместителю. Записываем «адрес» и название каждого заместителя в алфавитном порядке: 3-бром-2-метил-1-хлорбутен-2. ИЗОМЕРИЯ АЛКЕНОВ Алкенам характерна как структурная,так и пространственная изомерия. Виды структурной изомерии алкенов: изомерия углеродной цепи; изомерия положения двойной связи; межклассовая изомерия с циклоалканами. Обрати внимание! Изомерия углеродной цепи и положения двойной связи возможна при числе атомов углерода не меньше 4. В молекулах структурных изомеров атомы углерода соединяются в разном порядке. Молекулы могут иметь линейное или разветвлённое строение. Двойная связь в них может располагаться в разных местах. Межклассовые изомеры существуют у всех алкенов, кроме этилена. Например, пропену CH2=CH−CH3 изомерен циклопропан, структурная формула которого выглядит следующим образом: 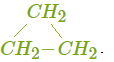 Для некоторых алкенов и их производных возможна пространственная изомерия. Она обусловлена невозможностью вращения частей молекулы вокруг двойной связи. У веществ, в молекулах которых оба атома углерода при двойной связи соединены с разными группами, существуют геометрические изомеры (цис-транс-изомеры). В молекулах этих веществ порядок соединения атомов одинаковый, но их пространственное расположение различается. Приведём пример пространственных изомеров для галогенпроизводного — 1, 2-дихлорбутена.
Составим структурные формулы изомеров, имеющих состав C4H8.
Значит, всего существует шесть веществ, имеющих состав C4H8, — пять структурных изомеров, один из которых (бутен-2) представлен двумя цис-транс-изомерами. Число изомеров увеличивается с ростом числа атомов углерода в молекуле алкена. Так, составу C5H10 соответствует шесть нециклических изомеров и пять циклических, а C6H12 — семнадцать нециклических и восемь циклических изомеров. ФИЗИЧЕСКИЕ СВОЙСТВА АЛКЕНОВ Алкены, как и все углеводороды, имеют молекулярное строение. При обычных условиях они представляют собой бесцветные газы, летучие бесцветные жидкости или твёрдые легкоплавкие вещества. Молекулы алкенов неполярные, поэтому они практически не растворяются в воде, но могут растворяться в органических растворителях. Сравним температуры плавления и кипения неразветвлённых алкенов.
В ряду алкенов с увеличением числа атомов температуры кипения и плавления возрастают. При нормальных условиях (0 °C и атмосферном давлении) алкены с C2H4 до C4H8 — газы, с C5H10 до C17H34 — жидкости, а начиная с C18H36 — твёрдые вещества. Температуры плавления и кипения зависят не только от состава, но и от строения молекул. У разветвлённых алкенов их значения ниже по сравнению с неразветвлёнными.
ХИМИЧЕСКИЕ СВОЙСТВА АЛКЕНОВ Алкены, в отличие от алканов, являются химически активными веществами. Им характерны реакции присоединения, полимеризации, окисления. Горение (полное окисление). Алкены сгорают на воздухе с образованием углекислого газа и воды: 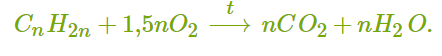 Реакции присоединения 1. Гидрирование. В присутствии катализатора алкены присоединяют водород и превращаются в алканы. В общем виде уравнение реакции гидрирования выглядит так:  В ходе реакции в молекуле алкена разрывается π-связь и по её месту присоединяются атомы водорода. Например, при гидрировании этилена получается этан: 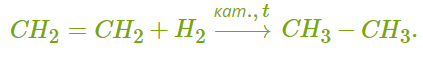 2. Галогенирование. При обычных условиях алкены вступают в реакцию присоединения с галогенами (кроме фтора). В ходе реакции в молекуле алкена разрывается π-связь и по её месту присоединяются атомы галогена. В общем виде реакцию присоединения хлора можно записать так:  Если для реакции использовать бромную воду (раствор брома в воде), то наблюдается её обесцвечивание. Пример такой реакции — присоединение брома к этилену с образованием 1,2-дибромэтана: Реакцию с бромной водой используют для обнаружения алкенов и других ненасыщенных соединений. 3. Реакция гидрогалогенирования. Алкены реагируют с галогеноводородами. Например, в результате присоединения хлороводорода образуется монохлорпроизводное: 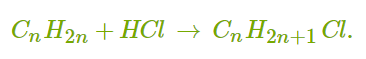 Если алкен несимметричный, то реакция присоединения галогеноводорода происходит в соответствии с правилом Марковникова. Атом водорода преимущественно присоединяется к более гидрированному атому углерода возле двойной связи. Рассмотрим протекание этой реакции на примере взаимодействия пропилена с бромоводородом: 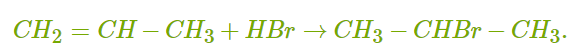 Продукт реакции — 2-бромпропан. 4. Реакция гидратации. В присутствии кислоты алкены присоединяют воду. В реакции образуются спирты: 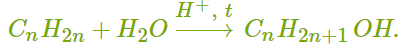 Атом водорода также присоединяется к более гидрированному атому углерода. Так, в результате гидратации пропилена образуется пропанол-2: 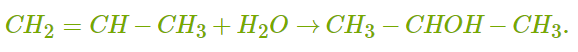 Реакции полимеризации алкенов Алкенам характерны реакции полимеризации. Под действием веществ-инициаторов происходит разрыв π-связи и молекулы алкена соединяются друг с другом в длинные цепи полимера. Например, в общем виде уравнение полимеризации этилена можно записать следующим образом: 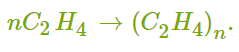 В реакции образуется полиэтилен. В структурном виде уравнение реакции выглядит так: 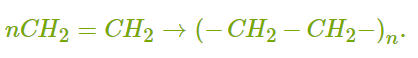 При полимеризации алкена в цепь макромолекулы всегда включаются только два атома углерода, между которыми была расположена двойная связь. Все остальные группы атомов располагаются вне цепи как боковые ответвления. Примеры: полимеризация пропилена (образуется полипропилен): 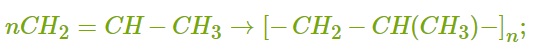 полимеризация бутена-1 (образуется полибутен-1): 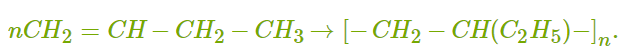 полимеризация бутена-2 (образуется полибутен-2): 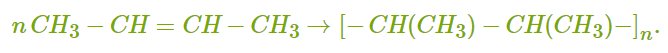 Полимеры (высокомолекулярные соединения), полученные при полимеризации алкенов и их производных, используются для производства пластмасс и синтетических волокон. ПОЛУЧЕНИЕ АЛКЕНОВ В промышленности алкены получаются из природного газа и нефти, а в лаборатории — из спиртов и галогеналканов. Рассмотрим основные способы получения. 1. Крекинг алканов. В процессе крекинга нефтепродуктов происходит расщепление молекул алканов с образованием более коротких молекул алканов и алкенов: 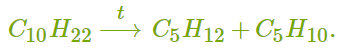 2. Дегидрирование алканов. При нагревании алканов в присутствии катализатора (платины, никеля и др.) происходит отщепление водорода и образуется алкен: 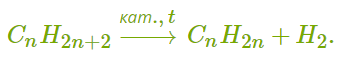 3. Дегидратация спиртов. Алкены образуются при нагревании спиртов до температуры выше 140°C с концентрированной серной кислотой: 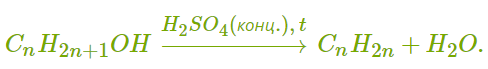 В реакции дегидратации спиртов возможно образование изомеров. Например, из бутанола-2 получаются два вещества — бутен-1 и бутен-2: 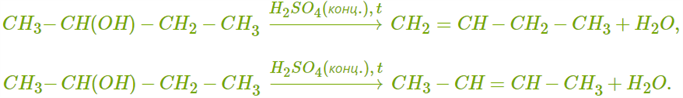 Реакция преимущественно идёт по второму варианту, т. е. атом водорода отщепляется от менее гидрированного атома углерода и в смеси продуктов выше содержание бутена-2. 4. Дегидрогалогенирование галогеналканов. Алкен можно получить, если нагревать галогеналкан со спиртовым раствором щёлочи: 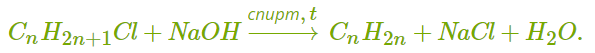 Так, из 2-бромбутана образуется смесь бутена-1 и бутена-2: 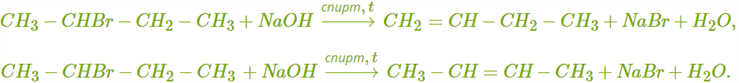 В полученной смеси также преобладает бутен-2, т. е. водород отщепляется от менее гидрированного атома углерода (как при дегидратации спиртов). Такая закономерность носит название правила Зайцева. 5. Получение из дигалогенпроизводных. Алкены образуются в реакциях дигалогеналканов с металлами (магнием, цинком и др.): 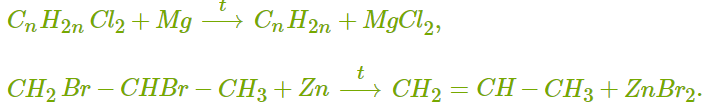 ПРИМЕНЕНИЕ АЛКЕНОВ Алкены являются важным химическим сырьём для производства пластмасс, синтетических волокон, спиртов, карбоновых кислот, альдегидов, кетонов и других веществ. Этилен добавляют в воздух теплиц для ускорения созревания плодов. Он находит широкое применение в качестве исходного вещества для органического синтеза. Рассмотрим некоторые направления использования этилена. Большое количество этилена расходуется для производства полиэтилена, из которого изготавливают прозрачную плёнку, трубы, посуду, электроизоляцию. Гидратацией этилена получают этиловый спирт C2H5OH, а из него — уксусную кислоту CH3COOH, уксусный альдегид CH3CHO, дивинил CH2=CH−CH=CH2 и другие продукты. Из этилена получаются хлорпроизводные, важнейшим из которых является хлорвинил (винилхлорид) CH2=CHCl — мономер для производства поливинилхлорида (ПВХ). При окислении этилена образуется этиленгликоль CH2OH−CH2OH — антифриз и исходное вещество для синтеза лавсана. Из этилена получают стирол (винилбензол) CH2=CH−C6H5, мономер для производства полистирола. Пропилен служит сырьём для производства полипропилена, из которого изготавливают разные бытовые предметы и получают прочное полипропиленовое волокно.  Изделия из полипропилена Изделия из полипропиленаПропилен используется также для получения: кумола CH3−CH(C6H5)−CH3; ацетона CH3−CO−CH3; фенола C6H5−OH; изопропилового спирта CH3−CH(OH)−CH3. |