аминокислоты. Лекция Аминокислоты
 Скачать 139.59 Kb. Скачать 139.59 Kb.
|
|
Лекция 6. Аминокислоты Вопросы: Общая характеристика и биологическая роль Способы получения аминокислот Физические и химические свойства Вопрос 1. Общая характеристика и биологическая роль Аминокислоты представляют собой карбоновые кислоты, у которых в α- (у второго атома углерода), β- (у третьего атома углерода) или -положении (у четвертого атома углерода) и т.д. атом водорода замещен на аминогруппу. α-Аминокислоты имеют общую формулу: 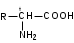 Из белков при помощи гидролиза выделено 20 аминокислот. Аминокислоты, входящие в состав белков, называют стандартными (протогенными). Каждая аминокислота имеет химическое и тривиальное (традиционное) название. Например, 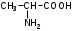 α-аминопропионовая аланин (Ala) α-аминопропионовая аланин (Ala)кислота 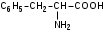 α-амино-β-фенилпропионовая фенилаланин (Phe) α-амино-β-фенилпропионовая фенилаланин (Phe)кислота Все стандартные аминокислоты (кроме глицина) содержат ассиметричный атом углерода (*) в α-положении и, следовательно, α-аминокислоты оптически активны, т.е. способны вращать плоскость поляризованного света в разные стороны. Аминокислоты существуют в виде пары энантиомеров (оптических изомеров): D- и L-изомеров. В формуле для D-изомера аминогруппа пишется справа, для L-изомера – слева:  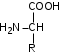 D-аминокислота L-аминокислота Направление вращения плоскости поляризованного света вправо (по часовой стрелке) обозначается знаком «+», влево – знаком «-». Обычно D-изомеры являются правовращающими, а L-изомеры – левовращающими. В состав белков входят только аминокислоты L-ряда. При гидролизе белков в мягких условиях аминокислоты сохраняют свою оптическую активность. Аминокислоты, присутствующие в организме животных и растений в свободном виде, также принадлежат к L-ряду. D-аминокислоты встречаются в природе очень редко: обнаружены в составе некоторых микроорганизмов и пептидных антибиотиков. Аминокислоты содержат кислотную – карбоксильную группу, поэтому являются амфолитами (амфотерными электролитами). В твердом состоянии и в нейтральной среде аминокислоты находятся в виде биполярного иона (цвиттер-иона, нем. zwitter – гибрид), что приводит к образованию внутренней соли: 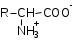 В растворах с разной кислотностью аминокислоты существуют в следующей ионной форме: 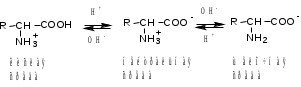 В зависимости от pH среды аминокислоты могут быть в форме катионов, анионов, электронейтральных биполярных ионов или смеси этих форм, одна из которых обычно доминирует. Для каждой аминокислоты характерна индивидуальная изоэлектрическая точка – такое значение pH, при котором ионы аминокислоты находятся в равновесии. В изоэлектрической точке растворимость аминокислоты минимальна и ее можно отделить от других аминокислот в растворе. В зависимости от суммарного заряда и массы ионы аминокислот с разной скоростью мигрируют в электрическом поле. На этом свойстве аминокислоты разделяются с помощью электрофореза. Благодаря амфотерности аминокислоты являются буферными веществами, выполняющими важную функцию регулирования pH в организме. Аминокислоты, обнаруженные в белках, можно классифицировать по разным признакам: по строению боковой цепи (R-группы) различают: алифатические, ароматические, гетероциклические аминокислоты. Аминокислоты, содержащие в радикалах OH-группы, называются гидроксиаминокислотами, а содержащие серу – серосодержащими аминокислотами. по полярности R-углеродных радикалов: с неполярными R-группами; полярными, но незаряженными R-группами; с отрицательно заряженными R-группами; с положительно заряженными R-группами; по положению изоэлектрической точки: нейтральные, основные, кислые; по числу аминных и карбоксильных групп: моноаминомонокарбоновые, диаминомонокарбоновые, моноаминодикарбоновые кислоты; по способности к синтезу в животном организме: заменимые (т.е.синтезируемые) и незаменимые (т.е. не синтезируются в организме). Значение аминокислот для организма человека заключается в том, что они используются для синтеза белков, метаболизм которых занимает важное место в процессах обмена веществ. Белки в свою очередь входят во все основные структурные компоненты клеток, тканей и органов человека, многие ферменты и гормоны имеют белковую структуру. Не менее важную роль играют производные аминокислот. К ним можно отнести гормоны надпочечников (адреналин, норадреналин), щитовидной железы (тироксин, трийодтиронин), медиаторы ЦНС (ацетилхолин, ГАМК), медиатор воспаления (гистамин) и т.д. Аминокислоты содержат почти 95% всего азота, поэтому именно они поддерживают азотистый баланс организма. Азотистый баланс – это разница между количеством азота, поступившего с пищей, и количеством выделяемого азота в виде мочевины и аммонийных солей. Состояние равенства поступления и выделения азота называют азотистым равновесием. Такое состояние бывает у здорового человека при нормальном питании. Азотистый баланс может быть положительным (азота поступает больше, чем выводится) (бывает у детей) или отрицательным (выделение преобладает над поступлением) (наблюдают при старении, голодании и во время тяжелых заболеваний). При безбелковой диете азотистый баланс становится отрицательным и в организме в сутки расходуется около 25 г собственных белков, в основном мышечных тканей. Это приводит к угрожающим жизни явлениям (задержка роста, неврологическим расстройствам, возникновению заболевания – анорексии и гибели организма). Часть аминокислот (аланин, аспарагин, аспарагиновая кислота, глицин, глутамин, глутаминовая кислота, пролин, серин, тирозин, цистеин) синтезируется в организме человека. Это так называемые заменимые аминокислоты. Другие относятся к незаменимым кислотам (аргинин, валин, гистидин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин), всего 10 организмом не синтезируются и поступают только с пищей. Отсутствие или недостаток в пище каких-либо незаменимых аминокислот приводит к угрожающим жизни явлениям (задержка роста, расстройство биосинтеза белков, возникновение заболеваний и т.д.) Вопрос 2. Способы получения аминокислот Выделение аминокислот из природного сырья Важнейший источник аминокислот – природные белки, при гидролизе которых образуются смеси α-аминокислот. Разделение этой смеси довольно сложная задача, однако, обычно одна или две аминокислоты образуются в значительно больших количествах, чем все другие, и их удается выделить достаточно просто. Микробиологический синтез. Известны микроорганизмы, которые в процессе жизнедеятельности продуцируют α-аминокислоты белков. Химический синтез Из галогензамещенных кислот действием аммиака 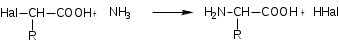 где Hal – Cl, Br Метод применим для синтеза не только α-аминокислот, но и аминокислот с любым отдалением аминогруппы от карбоксильной. Выходы аминокислот составляют 70-80% при 10-12 кратном избытке аммиака и добавлении карбоната аммония. Синтез Габриэля – фталимидный метод. Фталимид калия, образующийся при действии спиртового раствора гидроксида калия на фталимид, при повышенных температурах реагирует с эфирами галогенкарбоновых кислот, при этом образуя эфир фталиламинокислоты, при гидролизе которого получают аминокислоты 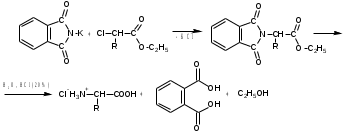 Метод применим для получения α-аминокислот, ω-аминокислот, α,ω-диаминокислот. Метод протекает с высокой селективностью для первичных аминов без примеси вторичных или третичных. Синтез Штреккера из альдегидов действием аммиака и синильной кислоты  Основным недостатком метода являются относительно низкие выходы α-аминокислот и применение токсичного цианистого водорода. Метод Штреккера позволяет получать α-аминокислоту, содержащую на один атом углерода больше, чем в исходном альдегиде. Синтез из α,β-непредельных карбоновых кислот действием аммиака 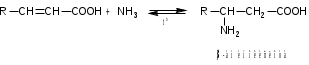 При нагревании β-аминокислоты снова распадаются на исходные ненасыщенные кислоты и аммиак. Восстановление ароматических нитрокарбоновых кислот Нитросоединения могут быть восстановлены до первичных аминов под действием сильных восстановителей в кислой среде. 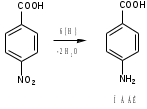 Восстановительное аминирование α-кетокислот при каталитическом гидрировании в присутствии аммиака. 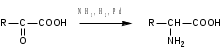 Вопрос 3. Физические и химические свойства Аминокислоты представляют собой белые кристаллические вещества хорошо растворимые (за некоторым исключением) в воде, аммиаке и других полярных растворителях, в неполярных органических растворителях нерастворимы. Многие аминокислоты обладают сладким вкусом. У серосодержащих аминокислот неприятный запах меркаптосоединений. Аминокислоты имеют высокую (выше 250°С) температуру плавления, т.к. существуют в виде внутримолекулярной соли. Очень часто плавление сопровождается разложением вещества. Химические свойства аминокислот определяются их строением: наличием карбоксильной группы, аминогруппы, строением R-группы. Ι. Кислотно-основные свойства 1.Кислотные свойства (взаимодействие со щелочами) 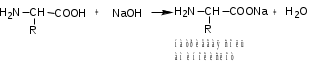 2. Основные свойства (взаимодействие с кислотами) 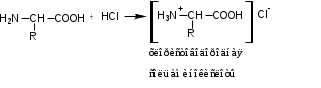 ΙΙ. Реакции по карбоксильной группе 1. Реакции комплексообразования с солями меди, ртути, кобальта и др. Основным реактивом является соль меди, с которой аминокислоты образуют комплексные соединения, имеющие темно-синюю окраску (качественная реакция на аминокислоты). 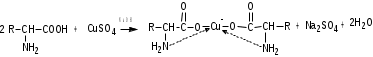 2. Взаимодействие со спиртами с образованием сложных эфиров (реакция этерификации) 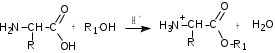 Получение эфиров аминокислот используется для разделения и определение аминокислот путем фракционной перегонки их эфиров в вакууме, и получения биологически активных ацетилпроизводных. 3. Декарбоксилирование при температуре более 200°С присутствии щелочных агентов (NaOH, Ba(OH)2 и др.) 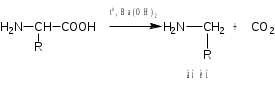 Образуются первичные амины. В живых организмах в мягких условиях под действием ферментов-декарбоксилаз целый ряд аминокислот подвергаются декарбоксилированию (аргинин, валин, гистидин, триптофан и др.) в результате чего образуются биогенные амины. 4. Восстановление карбоксильной группы до спиртовой алюмогидридом лития. Реакция протекает в атмосфере азота, в полярном растворителе: 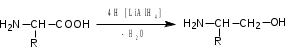 ΙΙΙ. Реакции по аминогруппе 1. N-ацилирование аминокислот действием уксусного ангидрида (или хлористым ацетилом) образуются N-ацильные производные аминокислот  Получение N-ацильных производных используется в химии аминокислот, в основном, как метод защиты аминогруппы. 2. Взаимодействие с формальдегидом с образованием N-метиленовых производных – азометинов, которые проявляют кислотные свойства вследствие разрушения цвиттер-иона. 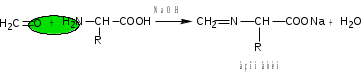 3. Алкилирование под действием избытка алкилгалогенидов, сульфатов, диазоалканов: 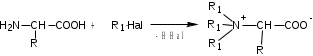 При алкилировании образуются N-моно-, затем N,N-диалкил-, и триалкильные производные аминокислот, которые обладают строением биполярных ионов. Например, при нагревании глицина с йодистым метилом получают бетаин, который впервые был найден в соке свеклы. Класс бетаинов содержится в большом числе растений (пшенице, ячмене, семенах подсолнечника и т.д.). 4. Взаимодействие с азотистой кислотой: 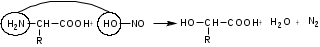 α-Аминокислоты превращаются в α-гидроксикарбоновые кислоты. ΙV. Перегруппировка аминокислот при нагревании 1) α-аминокислоты при нагревании превращаются в циклические амиды – дикетопиперазины: 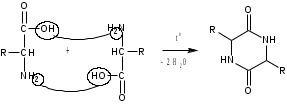 2) β-аминокислоты при нагревании переходят в α,β-непредельные кислоты: 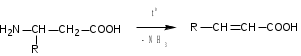 3) γ-аминокислоты при нагревании превращаются во внутренние циклические амиды - лактаны: 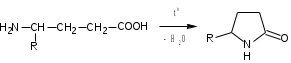 V. Поликонденсация Поликонденсация – реакция взаимодействия аминокислот между собой с образованием пептидов и белков – реакция, определившая жизнь:  Конденсация может идти между одинаковыми и разными аминокислотами. Рассмотренные реакции относятся к групповым, т.е. характерным для аминокислот как классу органических соединений. Но есть специфические реакции на отдельные аминокислоты (цветные реакции на аминокислоты). VΙ. Цветные реакции на аминокислоты 1.Для всех α-аминокислот используется нингидриновая проба. Взаимодействие с нингидрином дает образование соединения сине-фиолетовой окраски. Нингидриновая проба является групповой реакцией для α-аминокислот и используется при испытании на подлинность: 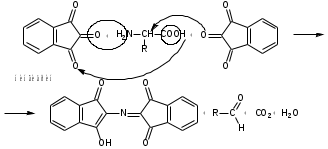 2.Реакция на ароматические аминокислоты – реакция нитрования (ксантопротеиновая реакция): 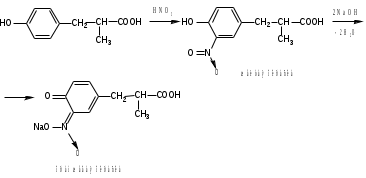 3.Реакция на серосодержащие аминокислоты – реакция Фоля: 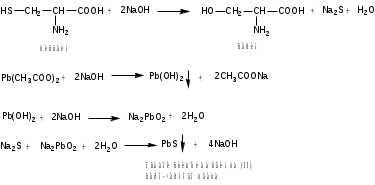 4.Реакция на гидроксильную группу в ароматическом кольце – реакция Миллона: 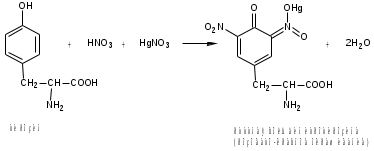 5.Реакция на гуанидиновую группу – реакция Сакагучи: 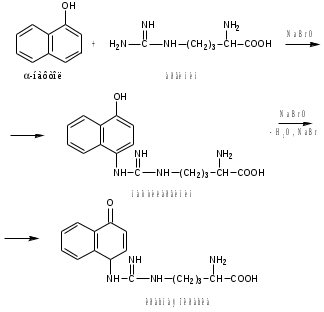 |
