белки. Азотистый баланс
 Скачать 0.63 Mb. Скачать 0.63 Mb.
|
|
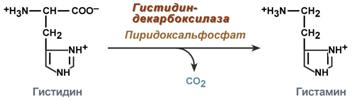
1) Питательная ценность различных белков. Азотистый баланс. Клинические проявления недостатка белков в пище. Азотистый баланс - разница между количеством азота, поступающего с пищей, и количеством выделяемого азота (преимущественно в виде мочевины и аммонийных солей). Если количество поступающего азота равно количеству выделяемого, то наступает азотистое равновесие. Питательная ценность белка зависит от его аминокислотного состава и способности усваиваться организмом. Если белок содержит все незаменимые аминокислоты в необходимых пропорциях и легко подвергается действию протеаз, то биологическая ценность такого белка условно принимается за 100, и он считается полноценным. К таким относят белки яиц и молока. Белки мяса говядины имеют биологическую ценность 98. Растительные белки по биологической ценности уступают животным, так как труднее перевариваются и бедны лизином, метионином и триптофаном. Однако при определённой комбинации растительных белков организм можно обеспечить полной и сбалансированной смесью аминокислот. Так, белки кукурузы содержат мало лизина, но достаточное количество триптофана. А белки бобов богаты лизином, но содержат мало триптофана. Каждый из этих белков в отдельности является неполноценным. Однако смесь бобов и кукурузы содержит необходимое человеку количество незаменимых аминокислот. Белковая недостаточность обычно связана с голодом. Она почти всегда сочетается с дефицитом энергии, поэтому данный алиментарный дисбаланс называетсябелково-энергетической недостаточностью(наблюдается недостаток продуктов главным образом животной группы). У новорожденных и детей младшего возраста белково-энергетическая недостаточность проявляется в форме квашиоркора и алиментарного маразма– заболеваний, встречающихся в беднейших странах. Алиментарная дистрофия может развиться у взрослого человека при длительном существенном дефиците питания. Ее проявления: снижение массы тела, потеря работоспособности, глубокие гиповитаминозы, снижение иммунитета. Развитие подобного состояния возможно также при нарушении обменных процессов при тяжелых заболеваниях. 2)Непрямое окислительное дезаминирование аминокислот. Схема процесса, стадии, ферм, био значение. Большинство аминокислот не способно дезаминироваться в одну стадию, подобно глутамату. Аминогруппы таких аминокислот перносятся на a-кетоглутарат с образованием глутаминовой кислоты, которая затем подвергается прямому окислительному дезаминированию Это происходит с участием 2 ферментов аминотрансферазы и глутаматдегидрогеназы. Непрямое дезаминирование – основной способ дезаминирования большинства аминокислот.  Этот путь дезаминирования преобладает в мышцах при интенсивной работе, в результате которой накапливается молочная кислота. Выделяющийся аммиак предотвращает закисление среды в клетках, вызванное образованием лактата. 3) Обмен метионина. Его роль в обмене в-в. Метионин - незаменимая, гликогенная АМК.Пищевые источники: яйца,молочные продукты,мясоМетионин участвует в реакциях трансметилирования: Реакции трансметилирования применяются в: -синтезе фосфатидилхолина, -синтезе карнитина, -синтезе креатина, -синтезе адреналина из норадреналина, -синтезе анзерина из карнозина, -метилировании азотистых оснований в нуклеотидах, -инактивации метаболитов и обезвреживании чужеродных соединений. 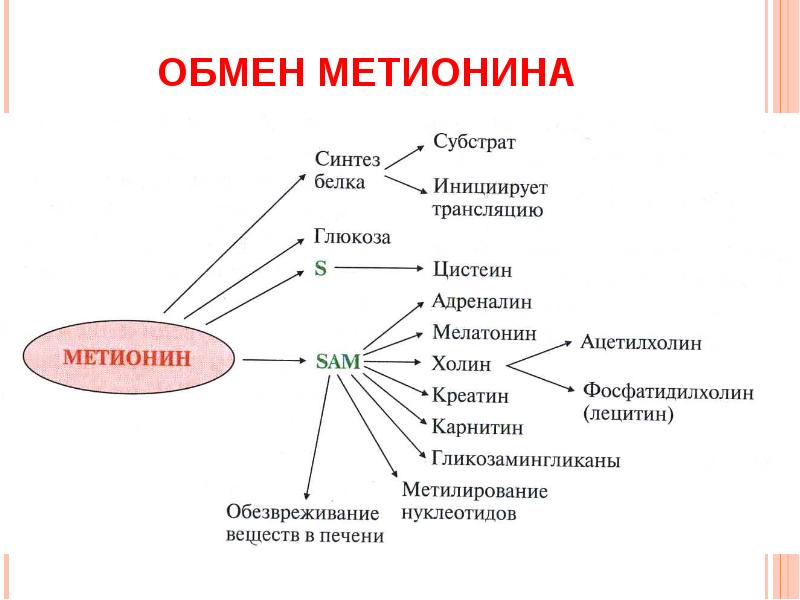 4) Переваривание белков в желудочно-кишечном тракте. Биологическое значение переваривания. Схема процесса. Активация пещеварительных ферментов. 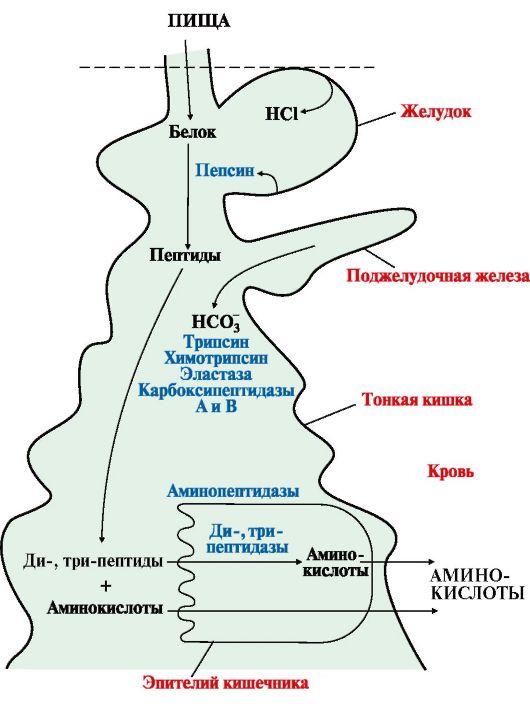 5) Токсичность аммиака. Содержание его в крови в норме. Симптомы аммиачного отравления. Токсичность аммиака обусловлена следующими обстоятельствами: 1. Связывание аммиака при синтезе глутамата вызывает отток α-кетоглутарата из цикла трикарбоновых кислот, при этом понижается образование энергии АТФ и ухудшается деятельность клеток. 2. Ионы аммония NH4+ вызывают защелачивание плазмы крови. При этом повышается сродство гемоглобина к кислороду (эффект Бора), гемоглобин не отдает кислород в капиллярах, в результате наступает гипоксия клеток. 3. Накопление свободного иона NH4+ в цитозоле влияет на мембранный потенциал и работу внутриклеточных ферментов – он конкурирует с ионными насосами для Na+ и K+. 4. Продукт связывания аммиака с глутаминовой кислотой – глутамин – является осмотически активным веществом. Это приводит к задержке воды в клетках и их набуханию, что вызывает отек тканей. В случае нервной ткани это может вызвать отек мозга, кому и смерть. 5. Использование α-кетоглутарата и глутамата для нейтрализации аммиака вызывает снижение синтеза γ-аминомасляной кислоты (ГАМК), тормозного медиатора нервной системы. В норме содержание свободного аммиака в крови представлено лишь следовыми количествами (0,4-0,7 мг/л или 25-40 мкмоль/л). Симптомы аммиачного отравления: тремор, нечленораздельная речь, затуманивание зрения, возбуждение, судороги, галлюцинации. В тяжелых случаях – коматозное состояние и смерть. 6)Небелковые азотсодержащие компоненты крови 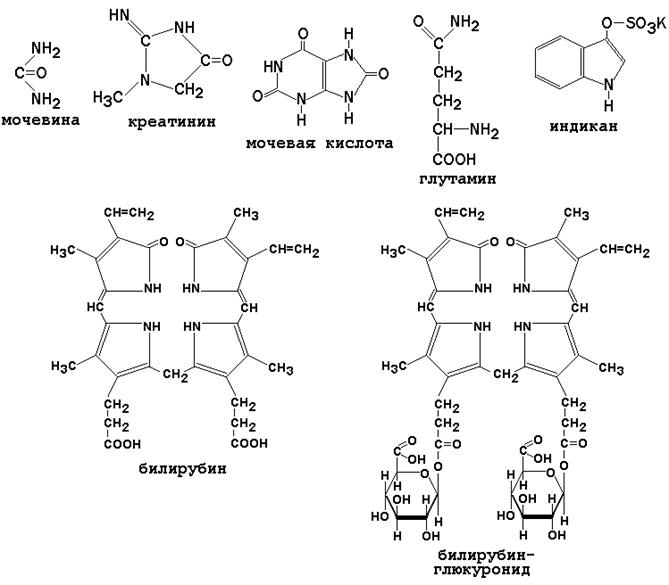 7) Синтез мочевины: схема орнитинового цикла, суммарное уравнение, источники аминногрупп в молекуле мочевины. Связь с ЦТК. 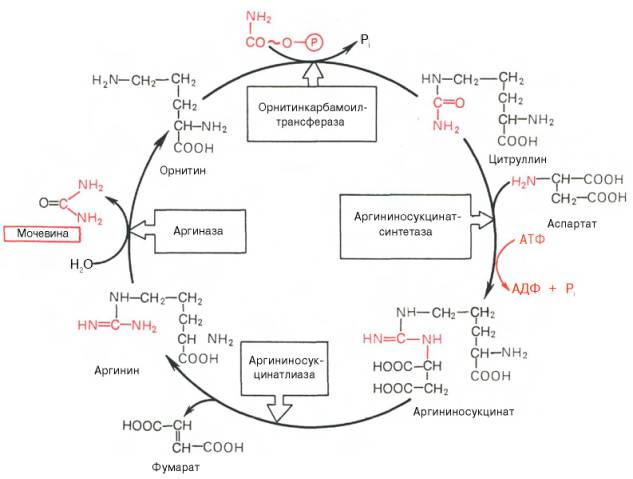 Суммарное уравнение синтеза мочевины: СО2 + NH3 + Аспартат + 3 АТФ + 2 Н2О → Мочевина + Фумарат + 2 (АДФ + Н3Р04) + АМФ + H4P2O7. 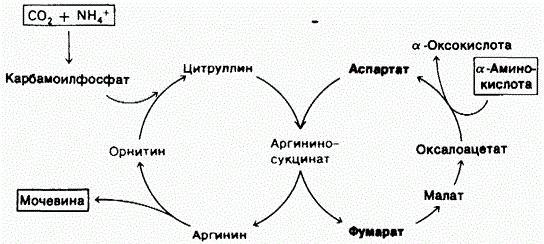 8) Источники и пути использования свободный аминокислот. Судьба безазотистого остатка аминокислот. В ходе катаболизма аминокислоты превраща ются в кетокислоты (безазотистые остатки). Большая часть аминокислот превращается в пируват или непосредственно (серин, аланин), либо более сложным путем – сначала превращаются в один из метаболитов ЦТК, который затем в реакциях цикла Кребса превращается в оксалоацетет, из которого затем синтезируется фосфоенолпируват. Из фосфоенолпирувата под действием пируватки назы образуется пируват. Пируват подвергается окислительному декарбоксилированию и превра щается в ацетил-КоА, который сгорает в ЦТК до СО2 и воды с выделением энергии. Такой путь преимущественно проходят аминокислоты пищи. Аминокислоты, которые превращаются в пируват и промежуточные продукты ЦТК и в конеч ном итоге образуют оксалоацетат, могут использоваться в процессе глюконеогенеза для синтеза глюкозы. Такие аминокислоты называют гликогенными (их 14). Некоторые аминокислоты в процессе катаболизма превращаются в ацетоацетат (кетоновое тело) или ацетил-КоА и могут использоваться в синтезе кетоновых тел. Такие аминокислоты называют кетогенными (их две: лейцин и лизин). Ряд аминокислот используется и для синтеза глюкозы, и для синтеза кетоновых тел. Такие аминокислоты называют смешанными, или глико-кетогенными. Их 4: фенилаланин, тирозин, триптофан, изолейцин. онд свободных аминокислот организма составляет примерно 35 г. Содержание свободных аминокислот в крови в среднем равно 3565 мг/дл. Большая часть аминокислот входит в состав белков, количество которых в организме взрослого человека нормального телосложения составляет примерно 15 кг. Источники свободных аминокислот в клетках - белки пищи, собственные белки тканей и синтез аминокислот из углеводов. Многие клетки, за исключением высокоспециализированных (например, эритроцитов), используют аминокислоты для синтеза белков, а также большого количества других веществ: фосфолипидов мембран, гема, пуриновых и пиримидиновых нуклеотидов, биогенных аминов (катехоламинов, гистамина) и других соединений (рис. 9-1). Резервом аминокислот могут служить все функциональные и структурные белки тканей, но преимущественно белки мышц, поскольку их больше, чем всех остальных. В организме человека в сутки распадается на аминокислоты около 400 г белков, примерно такое же количество синтезируется. Поэтому тканевые белки не могут восполнять затраты аминокислот при их катаболизме и использовании на синтез других веществ. Первичными источниками аминокислот не могут служить и углеводы, так как из них синтезируются только углеродная часть молекулы большинства аминокислот, а аминогруппа поступает от других аминокислот. Следовательно, основным источником аминокислот организма служат белки пищи. 9)Пути образования аммиака Основной путь, приводящий к образованию аммиака в тканях - это непрямое окислительное дезаминирование аминокислот, т.е. трансдезаминирование. 1 Неокислительное дезаминирование серина, треонина, цистеина и внутримолекулярное дезаминирование гистидина. 2 Гидролитическое дезаминирование АМФ (адениловой кислоты). Процесс особенно активен в мышечной ткани. 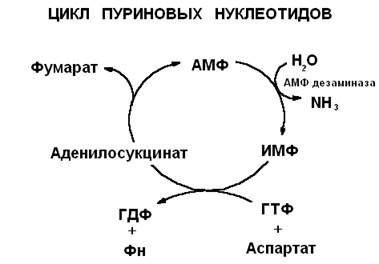 10) Превращение белков в желудке. Обр соляной кислоты и ее роль в переваривании белков. Регуляция секреции соляной кислоты. В желудке пища подвергается воздействию желудочного сока, включающего соляную кислоту и ферменты. К ферментам желудка относятся т пепсин и гастриксин. У грудных детей основным ферментом является реннин. 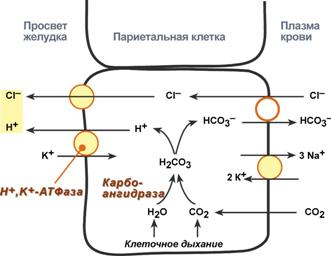 Гистамин, образующийся клетках слизистой оболочки желудка, взаимодействует с Н2-рецепторами на обкладочных клетках желудка, увеличивает в них синтез и выделение соляной кислоты. Закисление желудочного содержимого подавляет активность G-клеток и по механизму обратной отрицательной связи снижает секрецию гастрина и желудочного сока. 11) Прямое окислительное дезаминирование аминокислот. Схема процесса, ферменты. Аэробное прямое окислительное дезаминирование катализируется оксидазами D-аминокислот (D-оксидазы) в качестве кофермента использующими ФАД, и оксидазами L-аминокислот (L-оксидазы) с коферментом ФМН. В организме человека эти ферменты присутствуют, но практически неактивны. 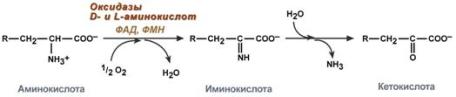 Анаэробное прямое окислительное дезаминирование существует только для глутаминовой кислоты, катализируется только глутаматдегидрогеназой, превращающей глутамат в α-кетоглутарат. Фермент глутаматдегидрогеназа имеется в митохондриях всех клеток организма (кроме мышечных). > 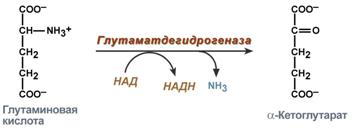 12)Нормальные и паталогические компоненты желудочного сока. Желудочный сок содержит соляную кислоту и ряд минеральных солей, а также различные ферменты, главнейшими из которых являются пепсин, расщепляющий белки, химозин (сычужный фермент), створаживающий молоко, липаза, расщепляющая жиры. Также слизь, играющую важную роль в защите слизистой оболочки желудка от раздражающих веществ. Так же содержится также особое вещество —внутренний фактор Касла, необходимое для всасывания витамина В12 в тонких кишках Желчь появляется при пониженной кислотности или при полном отсутствии кислоты. В этом случае нарушается функция привратника, он расслаблен, и кишечное содержимое может забрасываться в желудок. Этому также может способствовать и неплотное закрытие привратника в связи с рубцовыми процессами в нём. Окраска желудочного сока в жёлтый и зеленоватый цвет желчью зависит от наличия НСI в нём. Если имеется НСI, то желудочный сок имеет зеленоватую окраску, т.к. билирубин окисляется в биливердин. Кровь может появляться в желудке при травме желудка, при травме слизистой ротовой полости, пищевода, при варикозном расширении вен пищевода, при зондировании, при заглатывании крови во время носового кровотечения. В этом случае кровь находится в виде прожилок. Кровь также может появиться вследствие язвы желудка, распада опухоли; в этом случае цвет желудочного сока сравнивают с цветом «кофейной гущи», за счёт окисления гемоглобина соляной кислотой в солянокислый гематин тёмно-коричневого цвета. При кровотечении в условиях ахлоргидрии или ахилии желудочный сок с примесью крови имеет все оттенки красного цвета. Молочная кислота обнаруживается в желудочном соке при раке желудка, сопровождающемся ахлоргидрией и задержкой эвакуации пищи. У таких больных желудочное содержимое носит застойный характер, отмечается брожение углеводов с образованием молочной кислоты. Летучие жирные кислоты тоже относятся к патологическим составным частям желудочного сока, т.к. причиной появления их является понижение кислотности желудочного сока или полное отсутствие соляной кислоты. 13) Пути обезвреживания аммиака 1. Восстановительное аминирование α-кетокислот;2. Синтез амидов аминокислот (глутамина и аспарагина);3. Синтез мочевины в печени;4. Образование аммонийных солей в почках. Образование мочевины – основной путь обезвреживания аммиака. 1 стадия – образование карбамоилфосфата происходит в митохондриях под действием фермента карбомоилфосфат-синтетазы:   Цитруллин переходит из митохондрий в цитозоль клеток печени. 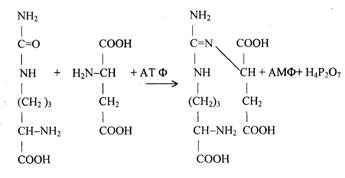 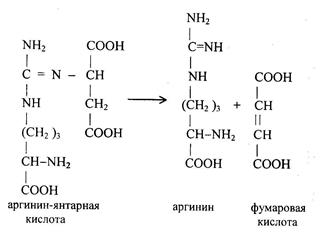 Под действием аргиназы аргинин гидролизуется, образуется мочевина и орнитин. В дальнейшем орнитин поступает в митохондрии и может включиться в новый цикл обезвреживания аммиака, а мочевина выделяется с мочой.  Таким образом, в синтезе одной молекулы мочевины нейтрализуется две молекулы NH3 и CO2 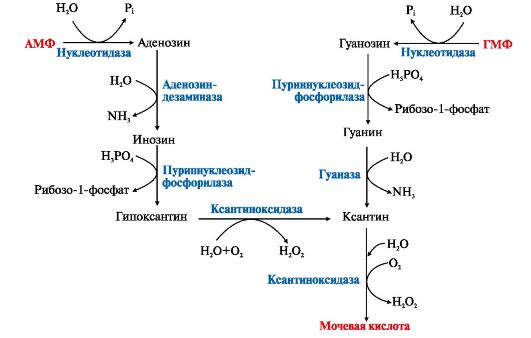 14)Переваривание белков в кишечнике. Всасывание продуктов переваривания. Желудочное содержимое (химус) поступает в двенадцатиперстную кишку. Низкое значение рН химуса вызывает в кишечнике выделение белкового гормона секретина, поступающего в кровь. Этот гормон в свою очередь стимулирует выделение из поджелудочной железы в тонкий кишечник панкреатического сока, содержащего НСО3-, что приводит к нейтрализации НСl желудочного сока и ингибированию пепсина. В результате рН резко возрастает от 1,5-2,0 до ∼7,0. Поступление пептидов в тонкий кишечник вызывает секрецию другого белкового гормона - холецистокинина, который стимулирует выделение панкреатических ферментов с оптимумом рН 7,5-8,0. Под действием ферментов поджелудочной железы и клеток кишечника завершается переваривание белков. Специфичность действия протеаз. Трипсин преимущественно гидролизует пептидные связи, образованные карбоксильными группами аргинина и лизина. Химотрипсины наиболее активны в отношении пептидных связей, образованных карбоксильными группами ароматических аминокислот (Фен, Тир, Три). Карбоксипептидазы А и В - цинксодержащие ферменты, отщепляют С-концевые остатки аминокислот. Причём карбоксипептидаза А отщепляет преимущественно аминокислоты, содержащие ароматические или гидрофобные радикалы, а карбоксипептидаза В - остатки аргинина и лизина. Последний этап переваривания - гидролиз небольших пептидов, происходит под действием ферментов аминопептидаз и дипептидаз, которые синтезируются клетками тонкого кишечника в активной форме. 15) Декарбоксилирование аминокислот. Образованиебиогенных аминов из фенилаланина и тирозина: гистамина, серотонина, ГАМК, дофамина, их биороль. Обезвреживание биогенных аминов.
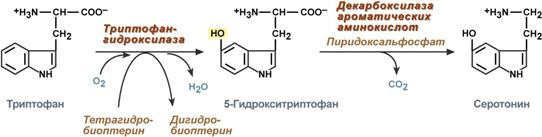
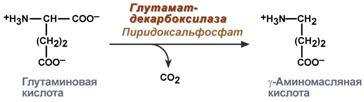 В центральной нервной системе ГАМК (наряду с глутаминовой кислотой) является тормозным медиатором. Наиболее высока ее роль в височной и лобной коре, гиппокампе, миндалевидных и гипоталамических ядрах, черной субстанции, ядрах мозжечка. 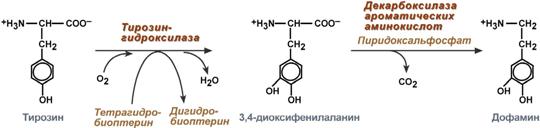 Является медиатором дофаминовых рецепторов в подкорковых образованиях ЦНС, в больших дозах расширяет сосуды сердца, стимулирует частоту и силу сердечных сокращений, расширяет сосуды почек, увеличивая диурез. 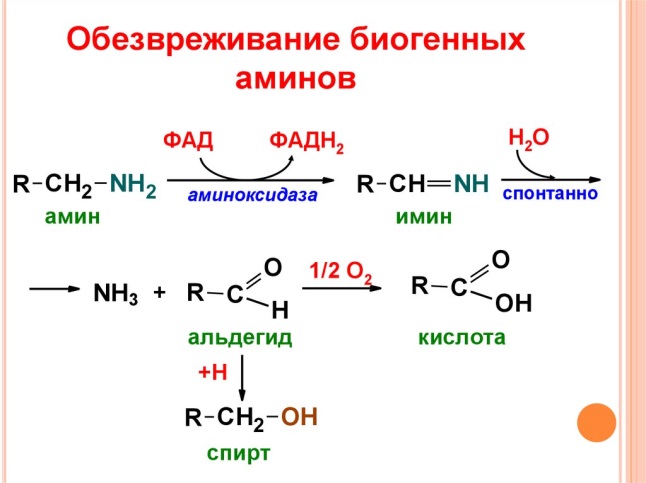 16)Клиническое значение определения концентрации мочевины в крови и моче. Причины повышения и понижения концентрации мочевины. Увеличениесодержания мочевины в крови наблюдается при:
Снижение содержания мочевины в кровинаблюдается при:
Увеличение экскреции мочевины с мочой наблюдается при:
Уменьшение экскреции мочевины с мочой наблюдается при:
Пода́гра — метаболическое заболевание, которое характеризуется отложением в различных тканях организма мочевой кислоты. В основе возникновения лежит накопление мочевой кислоты и уменьшение её выведения почками, что приводит к повышению концентрации последней в крови (гиперурикемия). Синдром Лёша — Нихена — наследственное заболевание, характеризующееся увеличением синтеза мочевой кислоты вызванное дефектом фермента гипоксантин-гуанинфосфорибозилтрансферазы,который катализирует реутилизацию гуанина и гипоксантина — в результате образуется большее количество ксантина и, следовательно, мочевой кислоты. Проявляется умственной отсталостью, хореоатетозом, приступами агрессивного поведения 17)Обмен ароматических аминокислот фенилаланина и тирозина. Его нарушения, биохимические дефекты. 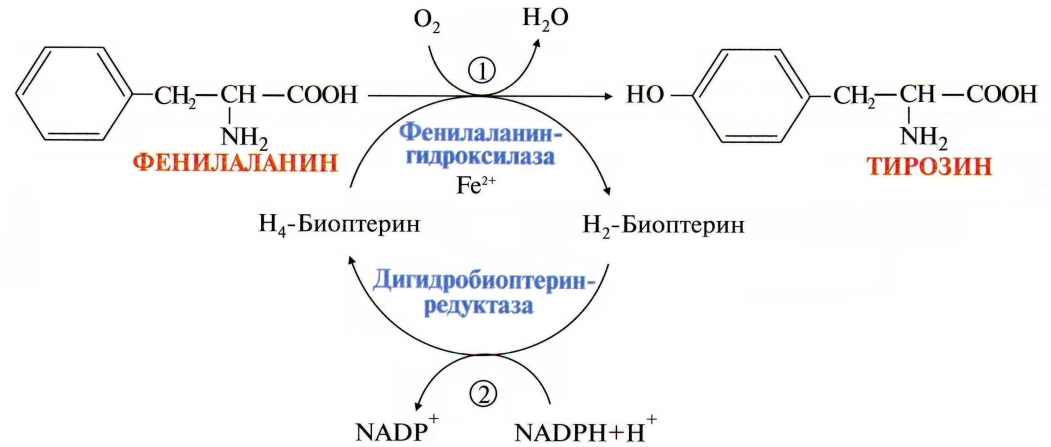 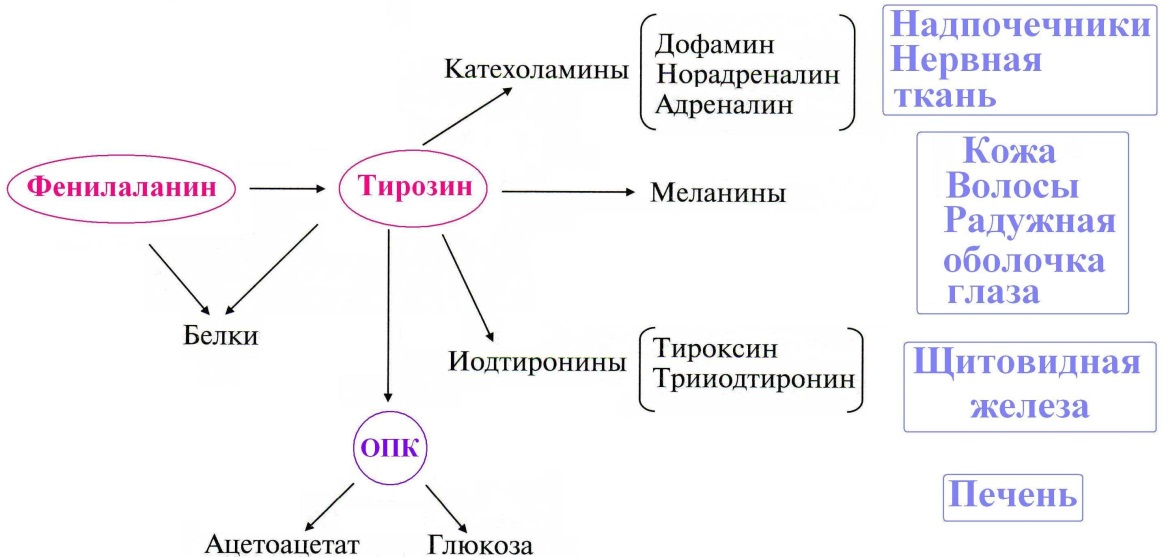 При нарушении активности ферментов синтеза меланинов развивается альбинизм, при котором снижается фотопротекторная, антиоксидантная, иммуномодулирующая функция меланинов.При врожденном дефекте трансаминазы, гидроксилазы, гидролазы развиваются различные виды тирозинозов. При отсутствии оксидазы гомогентизиновой кислоты наблюдается алкатонурия,характеризующаяся повышенным выделением с мочой гомогентизиновой кислоты, которая при контакте с воздухом переходит в продукты тёмного цвета. Классическая фенилкетонурия:Причина: наследственный дефект фермента фенилаланингидроксилазы 18)Синтез креатина, креатинина и креатинфосфата. Функции в ор-ме. Креатин – вещество скелетных мышц, миокарда, нервной ткани. В виде креатинфосфата креатин является "депо" макроэргических связей, используется для быстрого ресинтеза АТФ во время работы клетки. 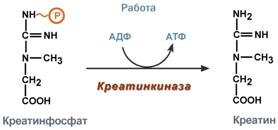 Особенно показательна роль креатина в мышечной ткани. Креатинфосфат обеспечивает срочный ресинтез АТФ в первые секунды работы (5 10 сек), когда никакие другие источники энергии (анаэробный гликолиз, аэробное окисление глюкозы, β-окисление жирных кислот) еще не активированы, и кровоснабжение мышцы не увеличено. В клетках нервной ткани креатинфосфат поддерживает жизнеспособность клеток при отсутствии кислорода. При мышечной работе ионы Са2+, высвободившиеся из саркоплазматического ретикулума, являются активаторами креатинкиназы. 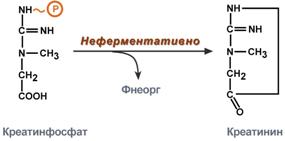   19) Метаболические нарушения орнитинового цикла Метаболические нарушения, обусловленные частичным блокированием каждого из 5 ферментов, катализирующих в печени реакции синтеза мочевины, а также N-ацетилглутаматсинтазы. Эти генетические дефекты, являются частичными. Полное блокирование какой-либо из стадий цикла мочевины в печени, несовместимо с жизнью, потому что другого эффективного пути удаления аммиака не существует. Общим признаком всех нарушений синтеза мочевины является повышенное содержание NH4+ в крови (гипераммониемия). Наиболее тяжёлые клинические проявления наблюдаются при дефекте фермента карбамоилфосфатсинтетазы. Клиническими симптомами, общими для всех нарушений цикла мочевины, являются рвота, нарушение координации движений, раздражительность, сонливость и умственная отсталость. Если заболевание не диагностируется, то быстро наступает гибель. У детей старшего возраста проявлениями заболевания служат повышенная возбудимость, увеличение размеров печени и отвращение к пище с высоким содержанием белка. |