Химия. 43. Основные понятия химической кинетики
 Скачать 187.86 Kb. Скачать 187.86 Kb.
|
|
43.Основные понятия химической кинетики В химической кинетики различают: Гетерогенные реакции 2Na(кр) + H2O = 2NAOH(жд) + H2(г) Гомогенные реакции HCl(р) + NaOH(р) = NaCl(р) + H2O(ж) Гетерогенные реакции (моль/(л*сек)) Гомогенные реакции (моль/(м2*сек)) по молекулярности мономолекулярные (одно-) PbCO3(тв)= PbO(тв)+СO2(г) двухмолекулярные (ди-) 2HI = H2 + I2 трехмолекулярные (три-) 2NO + Сl2 = 2NOCl 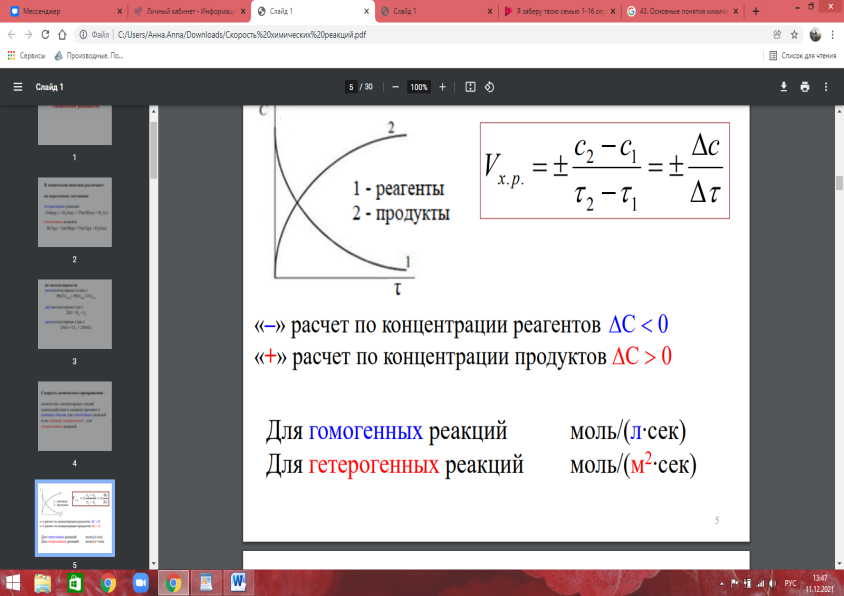 V = f(C, t, P, kat, S) C – концентрация t – температура P – давление kat – наличие катализатора 44.Факторы, влияющие на скорость химических реакций. Закон действия масс. Правило Вант-Гоффа. – природа реагирующих веществ Влияние природы реагирующих веществ 1) медленнопротекающие (твердофазные, обратимые) 2) быстропротекающие (горение, взрыв, реакции в растворах) Например: NaCl + AgNO3= AgCl + NaNO3 – быстро H2+ О2= H2О – на 15 % за 54 млрд. лет Для реакции аА + bВ cС + dD V = k∙СAaCBb k – константа скорости реакции СA и СB – концентрации исходных веществ А и В закон действия масс Гульдберга и Вааге (1864 г.) истинная скорость простой гомогенной химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам Например: N2 (г) + 3H2 (г) = 2NH3 (г) V = k[N2 ][H2 ] 3 Fe2O3 (к) + 3H2 (г) = 2Fe + 3H2O (г) V = k[H2 ] 3 Правило Вант-Гоффа: при повышении температуры на каждые 10° скорость реакции увеличивается примерно в 2-4 раза V2 = V1* γ^t2-t1/10 V1 и V2 скорость реакции при t1 и t2 γ – температурный коэффициент скорости реакции γ = 2 – 4 |
