Экология. 6,3694. значения коэффициентов m и n определить в зависимости от параметров f и vм f 1000 f 1000 3,245
 Скачать 86.92 Kb. Скачать 86.92 Kb.
|
|
Практическая часть Задача 1.Расчет концентрации вредного вещества в приземной области атмосферы, при выбросе нагретой газовоздушной смеси из трубы промышленного предприятия. Ответ. Максимальное значение приземной концентрации вредного вещества Cm, мг/м3 при выбросе нагретой газовоздушной смеси из одиночного точечного источника с круглым устьем при неблагоприятных метеорологических условиях определяется по формуле: СМ = 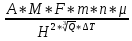 Берем исходные данные из приложения №8: A = 140; F = 1; Q = 3,2; ∆T = 16; H = 25; D = 0,8; М=0,9 Для определения Cm необходимо: 1. Рассчитать среднюю скорость w0, м/с выхода газовоздушной смеси из устья источника выброса: w0 = 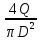 w0 = 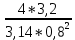 = 6,3694. = 6,3694.2. значения коэффициентов m и n определить в зависимости от параметров f и vм: f = 1000* 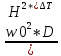 f = 1000* 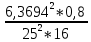 = 3,245. = 3,245.vм = 0,65* 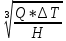 vм = 0,65* 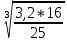 = 0,825. = 0,825.3. Коэффициент m определить в зависимости от f по формуле: m = 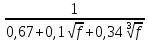 m = 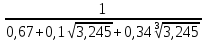 = 0,739. = 0,739.4. Коэффициент n определить в зависимости от величины vм: n = 1 при vм ≥ 2 n = 0,532 vм 2 - 2,13 vм +3,13 при 0,5 ≤ vм < 2 n = 4,4 vм при vм < 0,5 n = 0,532 vм 2 - 2,13 vм +3,13 = 0,532*0,8252-2,13*0,825+3,13 = 1,735. 5. Расстояние от источника выброса xm, м, на котором при неблагоприятных метеорологических условиях достигается максимальная приземная концентрация вредных веществ определяется по формуле: xm = 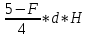 где d – безразмерный коэффициент, определяемый по формуле: d = 4,95* vм*(1+0.28 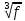 ) )d = 4,95*0,825*(1+0,28 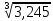 ) = 5,774. ) = 5,774.xm = 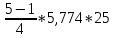 =144,356 =144,356Вычисляем СМ: СМ = 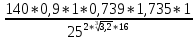 = 0,069 – максимальное значение из одиночного точечного источника. = 0,069 – максимальное значение из одиночного точечного источника.Определим фактическую концентрацию вредного вещества у поверхности земли с учетом фонового загрязнения воздуха по формуле: См’ = См+Сф См’ = 0,069+0,03 = 0,099 - фактическая концентрация вредного вещества у поверхности земли с учетом фонового загрязнения воздуха. Данная концентрация не превышает максимальную разовую предельно допустимую концентрацию (0,6 мг/м3), и превышает среднесуточную (0,06 мг/м3). Рассчитаем концентрацию загрязнителя на расстоянии x1 и x2 от источника выброса по формуле: СX = Сm*SX, где SX – коэффициент, зависящий от величины 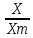 Дано: x1 = 100; x2 = 500 Вычисляем СX1: 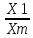 = = 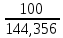 = 0,692 < 1 = 0,692 < 1SX1 = 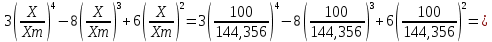 = 0.907 СX1 = 0,099*0,907 = 0,089 Вычисляем СX2: 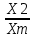 = = 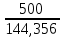 = 3,463 1< = 3,463 1<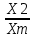 <8 <8SX2 = 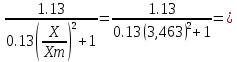 0.445 0.445СX2 = 0,099*0,445 = 0,044 Определим фактическую концентрацию вредного вещества у поверхности земли с учетом фонового загрязнения воздуха по формуле: Сх’ = Сх+Сф Сх1’ = Сх1+Сф = 0,089+0,03 = 0,119 Сх2’ = Сх2+Сф = 0,044+0,03 = 0,074 Данные концентрации не превышают максимальную разовую предельно допустимую (0,6 мг/м3), однако превышают среднесуточную (0,06 мг/м3) концентрации. Задача 2.Оценка загрязнения атмосферного воздуха отработанными газами автотранспорта на участке магистральной улицы (по концентрации CO). Ответ. Формула оценки концентрации окиси углерода (Сco): CCO = (СCФ+0,01*N*KT)*КA*КУ*КС*КВ*КП Коэффициент токсичности автомобилей определяется как средневзвешенный для потока автомобилей по формуле: KT = ∑PI*KTI Пусть на некотором участке магистральной улицы состав движения для легкого грузового транспорта – 15%, KTI = 2,3 среднего грузового транспорта – 0%, KTI = 2,9 тяжелого грузового транспорта – 0%, KTI = 0,2 автобуса – 5%, KTI = 3,7 легкового транспорта – 80%, KTI = 1,0 тогда коэффициент токсичности автомобилей на данном участке: KT = 0,15*2,3+0*2,9+0*0,2+0,05*3,7+0,8*1,0 = 0,345+0+0+0,185+0,8=1,33 Данные для формул берем согласно шифра из приложений № 11-16: СCФ = 0,03; N = 500; КA = 1,0; КУ = 1,55; КС = 1,05; КВ = 1,15; КП = 2,0 Вычисляем: CCO = (0,03+0,01*500*1,33)*1,0*1,55*1,05*1,15*2,0 = 25,004 мг/м3 Выброс на данном участке дороги превышает разовую максимальную дозу (5 мг/м3) и суточную (3 мг/м3). Предложения: 1. Увеличение зеленых насаждений. 2. Установка светофоров с вызывными фазами. Задача 3.Опишите основные химические, физические и опасные свойства фенол, напишите соответствующие уравнения химических реакций. Ответ. Фенол (гидроксибензол, химическая формула - C6O6OH) - органическое соединение, возглавляющее класс фенолов. Токсичен, является сильным ирритантом (группа веществ, вызывающих при попадании сильное местное раздражение слизистых оболочек, кожных покровов и расположенных в них нервных рецепторов с формированием ответной рефлекторной защитной реакции организма направленной на устранение раздражающего вещества (зуд, жжение, боль, першение, слезотечение, чиханье, кашель). Физические свойства: Представляет собой бесцветные игольчатые кристаллы, розовеющие на воздухе из-за окисления, приводящего к образованию окрашенных веществ (это связано с промежуточным образованием хинонов). Обладает специфическим запахом (таким, как запах гуаши, так как в состав гуаши входит фенол). Умеренно растворим в воде (6 г на 100 г воды), в растворах щелочей, в спирте, в бензоле, в ацетоне. 5%-й раствор в воде — антисептик, широко применявшийся в медицине в прошлом. Химические свойства: Фенол проявляет кислотные свойства, поэтому в водных растворах он диссоциирует по типу кислоты с образованием протона водорода, поэтому фенол называют карболовой кислотой. Фенол, как и спирты, взаимодействует со щелочными металлами. Так, в реакции фенола с натрием образуется фенолят натрия и водород. Фенол реагирует с растворами щелочей, так как кислотные свойства у него выражены сильнее, чем у спиртов. Например, в реакции фенола с гидроксидом натрия образуется фенолят натрия и вода. Кислотные свойства у фенола выражены слабее, чем у неорганических кислот, даже таких, как угольная кислота. Поэтому, если добавить к водному раствору фенолята натрия соляную кислоту, то образуется фенол и хлорид натрия. Реакции галогенирования у фенола протекают с замещением атомов водорода в бензольном кольце. Так, в реакции фенола с бромной водой образуется белый осадок 2, 4, 6-трибромфенола. Эта реакция используется для качественного обнаружения фенола. 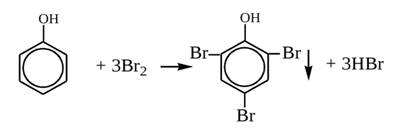 Фенол, как и бензол, реагирует с азотной кислотой. Но у фенола эта реакция идёт легче. В реакции фенола с азотной кислотой образуется 2, 4, 6-тринитрофенол, или пикриновая кислота. 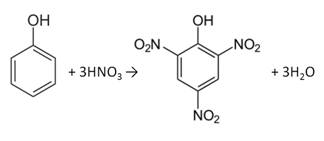 Токсические свойства: Фенол — токсичное вещество. По степени воздействия на человеческий организм фенол относится к высокоопасным веществам (Класс опасности 2). При вдыхании вызывает нарушение функций нервной системы. Пыль, пары и раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу, вызывая химические ожоги. Доказательства канцерогенности фенола для людей отсутствуют. Предельно допустимые концентрации (ПДК) фенола: ПДКр.з. = 1 мг/м³ (2 класс опасности) ПДКр.с. = 0,3 мг/м³ (2 класс опасности) ПДКм.р. = 0,01 мг/м³ ПДКс.с. = 0,006 мг/м³ ПДКв. = 0,001 мг/л. Попадая на кожу, фенол очень быстро всасывается даже через неповреждённые участки и уже через несколько минут начинает воздействовать на ткани головного мозга. Сначала возникает кратковременное возбуждение, а потом — паралич дыхательного центра. Даже при воздействии минимальных доз фенола наблюдается чихание, кашель, головная боль, головокружение, бледность, тошнота, упадок сил. Тяжелые случаи отравления характеризуются бессознательным состоянием, синюшностью, затруднением дыхания, нечувствительностью роговицы, скорым, едва ощутимым пульсом, холодным потом, нередко судорогами. Смертельная доза для человека при попадании внутрь — 1—10 г, для детей — 0,05—0,5 г. ПДК в воздухе рабочей зоны — 1 мг/м³ (максимально-разовая) и 0,3 мг/м³ (среднесменная). Порог восприятия запаха фенола у разных людей разный; и он может достигать (среднее значение в группе) 5,8-7,5 мг/м³[22]. А у отдельных работников он может быть значительно больше среднего значения. По этой причине можно ожидать, что использование широко распространённых фильтрующих СИЗОД в сочетании с «заменой фильтров по появлении запаха под маской» (как это почти всегда рекомендуется в РФ поставщиками) приведёт к чрезмерному воздействию паров фенола на, по крайней мере, часть работников, и причинить вред их здоровью[23] — из-за запоздалой замены противогазных фильтров. Для защиты от фенола следует использовать более эффективные изменение технологии и средства коллективной защиты. Получение: В настоящее время производство фенола в промышленном масштабе осуществляется тремя способами: кумольный метод. В каскаде барботажных колонн кумол подвергают некаталитическому окислению воздухом с образованием гидропероксида кумола (ГПК). Полученный ГПК, при катализе серной кислотой, разлагают с образованием фенола и ацетона. Кроме того, ценным побочным продуктом этого процесса является α-метилстирол. 95 % всего производимого в мире фенола производят этим методом. Способ был изобретён советскими учёными П. Г. Сергеевым, Н. М. Горнасталевой, Р. Ю. Удрисом, Б. Д. Кружаловым. По сравнению с большинством других процессов, процесс кумола использует относительно мягкие условия синтеза и относительно недорогое сырьё. Однако, чтобы работать экономно, должен быть спрос как на фенол, так и на ацетон[11][12]. В 2010 году мировой спрос на ацетон составлял примерно 6,7 миллиона тонн, 83 процента из которых были удовлетворены ацетоном, полученным кумольным методом; окисление толуола, с промежуточным образованием бензойной кислоты (около 3 %); выделением из каменноугольной смолы. Фенол также можно получить восстановлением хинона. Применение: Мировое производство фенола на 2006 год составляет 8,3 млн т/год. По объёму производства фенол занимает 33-е место среди всех выпускаемых химической промышленностью веществ и 17-е место среди органических веществ[источник не указан 1595 дней]. По данным на 2006 год мировое потребление фенола имеет следующую структуру: 43 % фенола расходуется на производство бисфенола А, который, в свою очередь, используется для производства поликарбонатов и эпоксидных смол; 30 % фенола расходуется на производство фенолформальдегидных смол; 12 % фенола гидрированием превращается в циклогексанол, используемый для получения искусственных волокон — нейлона и капрона[13]; в России большое количество фенола используется в нефтепереработке, в частности, для селективной очистки масел на технологических установках типа 37/1 и А-37/1. Фенол проявляет высокую селективность и эффективность при удалении из масел смолистых веществ, различных полициклических ароматических углеводородов с короткими боковыми цепями, а также соединений, содержащих серу[14]; остальной фенол расходуется на другие нужды, в том числе на производство антиоксидантов (ионол), неионогенных ПАВ — полиоксиэтилированных алкилфенолов (неонолы), других фенолов (крезолов), лекарственных препаратов (аспирин), антисептиков (ксероформа) и пестицидов. Раствор 1,4 % фенола применяется в медицине (орасепт) как обезболивающее и антисептическое средство[15]. Фенол и его производные обусловливают консервирующие свойства коптильного дыма. . В косметологии — как химический пилинг (токсично). в скотоводстве — дезинфекция животных растворами фенола и его производных. в косметологии — для проведения глубокого пилинга. Задача 4.Охарактеризуйте абсорбцию, распределение и токсичность иона металла (на примере алюминий(Al)) в организме человека и животных. Ответ. Алюминий – один из наиболее распространенных в природе элементов и занимает третье место после кислорода и кремния, с которыми в виде алюмосиликатов составляет больше 82% массы земной коры. Как писал Д.И. Менделеев в своем классическом учебнике “Основы химии”, “алюминий есть самый распространенный в природе из всех металлов; достаточно указать на то, что он входит в состав глины, чтоб ясно было всеобщее распространение алюминия в коре земной. Алюминий, или металл квасцов (alumen), потому и называется иначе глинием, что находится в глине”. В почвах содержится 150–600 мг/кг, в атмосферном воздухе городов – около 10 мкг/м3 в сельской местности – 0.5 мкг/м3 алюминия. Накоплению алюминия в почве содействует ее закисление. При закислении водоема нерастворимые формы алюминия переходят в растворимые, что способствует резкому повышению его концентрации в воде. Являясь одним из самых распространенных элементов в земной коре, алюминий содержится практически в любой природной воде. Алюминий попадает в природные воды естественным путем при частичном растворении глин и алюмосиликатов, а также в результате вредных выбросов отдельных производств (электротехническая, авиационная, химическая и нефтеперерабатывающая промышленность, машиностроение, строительство, оптика, ракетная и атомная техника) с атмосферными осадками или сточными водами. Сульфат алюминия широко используется в качестве коагулянта в процессах водоподготовки для коммунальных нужд и присутствие его в питьевой воде в значительных количествах является результатом нарушений технологии и недостаточного контроля при проведении этих процессов. Содержание алюминия в водоисточниках колеблется в широких пределах от 2.5 до 121 мг/л. Иногда указанные выше значения могут быть превышены в сотни раз. Согласно исследованиям, проведенным в США, содержание алюминия в грунтовых водах может достигать 14–290 мг/л, а в поверхностных водах – 16–1170 мг/л. Во влажном климате, где разлагающиеся остатки обильной растительности образуют много органических кислот, алюминий мигрирует в почвах и водах в виде органоминеральных коллоидных соединений. В настоящее время алюминий относится к жизненно важным элементам, обнаруживаемым в следовых количествах. Суточная потребность в алюминии для взрослого человека составляет 35–49 мг. Одним из специфических источников поступления алюминия в организм человека является все возрастающее использование его в пищевой промышленности (посуда, упаковочный материал, пищевые добавки) и фармакологии. Алюминий входит в состав медицинских препаратов, которые обладают обезболивающим, адсорбирующим и антацидным действием, помогая снизить кислотность желудочного сока. Соединения алюминия применяются при лечении язвы желудка, ряда заболеваний поджелудочной железы, гастрита, изжоги. Общее содержание алюминия в суточном смешанном рационе человека составляет 80 мг. Алюминий входит в состав тканей животных и растений. В органах млекопитающих животных обнаружено от 10–3 до 10–5% алюминия в расчете на материал естественной влажности. Алюминий может поступать в животный организм с питьевой водой, воздухом, а также с растительной пищей. Содержание алюминия в пшенице составляет 42 мг/кг, горохе – 36, кукурузе – 16, картофеле 4 мг/кг, репе – 46 мг/кг, меде – 4 мг/кг, мясе и мясных изделиях – от 1.6 до 20 мг/кг. Много алюминия в цветной капусте, моркови, помидорах. В яблоках содержится до 150 мг/кг алюминия, а в листьях чая – 850–1400 мг/кг. Алюминий содержится в овсянке, рисе, авокадо, артишоках, савойской капусте, баклажанах, топинамбуре, киви, персиках, белокочанной капусте, фасоли, манной крупе. Растительные продукты содержат в 50–100 раз больше алюминия, чем продукты животного происхождения. Алюминием обогащен хлеб, так как выпекается в алюминиевой посуде. Источниками повышенного поступления алюминия в организм человека также могут быть консервированная пища, некоторые травы и плавленые сыры, дезодоранты, бумажные полотенца, а также продукты, контактирующие с алюминиевой фольгой. Алюминий играет в организме важную физиологическую роль – он участвует в образовании фосфатных и белковых комплексов, в процессах регенерации костной, соединительной и эпителиальной ткани, оказывает, в зависимости от концентрации, тормозящее или активирующее действие на пищеварительные ферменты, способен влиять на функцию околощитовидных желез. Дефицит алюминия может развиваться, если его поступление в организм человека меньше 1 мкг в день, но пагубного влияния нехватки данного микроэлемента на организм не известно, так как этого практически никогда не случается. В связи с этим данные о возможных патогенных эффектах дефицита алюминия у человека отсутствуют. У экспериментальных животных в случае дефицита алюминия наблюдается увеличение числа выкидышей, снижение продуктивности, задержка роста, нарушение координации движений, слабость в конечностях. Содержание и распределение алюминия в тканях. На сегодняшний день принято, что общее содержание алюминия в крови взрослого человека находится в пределах 50–140 мг. Содержание в крови – 0.024–0. 070 мг/мл (большей частью в сыворотке), лёгких – 0.59 мг/г, трубчатых костях – 0.5 мг/г, зубах – до 0. 33 мг/г, сердце – 0.056– 0.210 мг/г, мышцах – 0.015мг/г, головном мозге – до 0.016 мг/г, грудном молоке – до 0.01 мг/мл, яичниках – 0.4 мкг/г, семенниках – 0.4 мкг/г, лимфатических узлах – 0.032 мг/г. Больше всего алюминия содержится в ногтях (до 0.93 мг/г). Депонируется алюминий в костях, печени, легких и в сером веществе головного мозга. С возрастом содержание этого элемента в легком и головном мозге увеличивается. Алюминий выводится из организма с мочой, калом, потом и выдыхаемым воздухом. Оценка содержания алюминия в организме дается по результатам исследований крови, мочи и волос. Среднее содержание алюминия в плазме крови составляет около 2 мкг/л. В моче содержание алюминия находится в пределах 1–20 мкг/л, а в волосах 1–20 мг/кг. Повышенное содержание алюминия в волосах у мужчин встречается чаще, чем у женщин, а у детей этот показатель выше, чем у взрослых. Токсичность алюминия. Несмотря на распространенность алюминий относится к токсическим элементам. Органами-мишенями при избыточных концентрациях алюминия в организме являются почки, центральная нервная система, кости, легкие, костный мозг, яичники, матка и молочные железы. Достаточно выражены и многообразны биохимические проявления интоксикации алюминием. Алюминий способен вызывать осаждение белков и образование нерастворимых белковых соединений в виде волокнистых субстанций без признаков воспаления. Высокая способность алюминия образовывать комплексные соединений обуславливает его роль в снижении активности многих ферментов и их систем. Токсичность алюминия во многом связана с его антагонизмом по отношению к кальцию и магнию, фосфору, цинку и меди, а также способностью влиять на функции околощитовидных желез, легко образовывать соединения с белками, накапливаться в почках, костной и нервной ткани. Алюминий тормозит усвоение кальция, магния, железа, витаминов В6 и С и некоторых серосодержащих аминокислот. Установлено, что соединения алюминия проявляют гемолитический эффект. В опытах in vitro выявлено, что в ряду: гидроокись, ацетат, сульфат алюминия снижается гемолитическое действие. При экспериментально вызванной анемии соли алюминия задерживают восстановление содержания гемоглобина до исходного уровня. Алюминий вызывает различные нарушения биохимических процессов в клетках. Установлено, что соединения алюминия нарушают процессы фосфорилирования (синтез АТФ). Алюминий конкурирует с усвоением фосфора, кальция и железа, может приводить к дефициту магния и марганца. Алюминий изменяет энергообмен в клетках, в результате чего клетки теряют способность к нормальному размножению, начинают делиться хаотично, порождая опухоли. Отмечается факт алюминий индуцированного апоптоза. В результате снижения поступления фосфатов в организм угнетается транспорт углеводов, связанный с фосфатами. Особо следует отметить влияние соединений алюминия на мембранный транспорт, так как алюминий оказывает существенное влияние на состояние мембранных липидов. При интоксикации алюминием существенно снижается уровень АТФ, что приводит к тяжелым нарушениям тканевого метаболизма. При хронической пероральной экспозиции солей алюминия вследствие нарушений фосфорного обмена снижается всасывание глюкозы из кишечника. В результате возникает гипогликемия, падает уровень гликогена в печени, возрастает уровень лактата в печени и пирувата в печени и мышцах. Накопление алюминия в организме может вызвать нарушение холинэргической передачи нервного импульса. При концентрации порядка 100 мкмоль ионы алюминия снижают активность очищенной холинэстеразы плазмы крови человека в 2 раза. Показано, что ионы алюминия действуют как неконкурентный ингибитор холинэстеразы, однако ионы кальция снимают это действие, а ионы магния не оказывают аналогичного защитного эффекта. Одним из возможных механизмов токсического действия алюминия может быть нарушение зависящего от трансферрина транспорта железа в организме. При токсических дозах алюминия снижение транспорта железа может вызвать железодефицитную анемию. Интоксикация высокими дозами алюминия (до 200 мг на кг) приводит к увеличению в плазме крови активности альдолазы, что сопровождается гипергликемией. У экспериментальных животных на срезах печени выявляется пониженное потребление кислорода в тканях. In vitro растворимые соли алюминия увеличивают агглютинацию эритроцитов. Разнообразные токсические проявления действия алюминия, вероятно, обусловлены его активным связыванием белками. Показано высокое сродство алюминия к лактоферрину и трансферрину. Алюминий снижает усвоение фосфора в организме, что может привести к нарушению фосфорно-кальциевого обмена. Имеются данные о мутагенной активности алюминия. У детей алюминий вызывает анемию, так как ингибирует синтез гемоглобина, заболевания почек, печени, колиты. Интоксикация алюминием часто сопровождается такими проявлениями как мышечные подёргивания и судороги, боли в желудке и во всём теле, запоры, снижение веса и аппетита, изменение состава крови (лимфоцитоз, эозинопения, анемия), постоянный кашель, дезориентация в пространстве, потеря памяти, нарушение фосфорно-кальциевого обмена, снижение стабильности синтеза и повреждение ДНК, развитие фиброзных уплотнений в мягких тканях. Часто интоксикация алюминием сопровождается нарушением функции почек (нефропатии, увеличение риска мочекаменной болезни). В клинической картине алюминиевой интоксикации как наиболее значимые различают неврологические, костные, гематологические синдромы . Вопрос №1 Что такое круговорот биогенов? Совместная деятельность различных живых организмов определяет закономерный круговорот отдельных элементов и химических соединений, включающий введение их в состав живых клеток, преобразования химических веществ в процессах метаболизма, выведение в окружающую среду и деструкцию органических веществ, в результате которой высвобождаются минеральные вещества, вновь включающиеся в биологические циклы. Процессы круговорота происходят в конкретных экосистемах, но в полном виде биогеохимические циклы реализуются лишь на уровне биосферы в целом. Ниже рассматриваются наиболее значимые элементы круговорота веществ. Круговорот углерода Углерод существует в природе во многих формах, в том числе в составе органических соединений. Неорганическое вещество, лежащее в основе биогенного круговорота этого элемента,— диоксид углерода (или углекислый газ, CO2). В природе СО2 входит в состав атмосферы, а также находится в растворенном состоянии в гидросфере. Включение углерода в состав органических веществ происходит в процессе фотосинтеза, в результате которого на основе СО2 и H2O образуются сахара. В дальнейшем другие процессы биосинтеза преобразуют эти углеводы в более сложные (крахмал, гликоген), а также в протеиды, липиды и др. Все эти соединения не только формируют ткани фотосинтезирующих организмов, но и служат источником органических веществ для животных и незеленых растений. В процессе дыхания все организмы окисляют сложные органические вещества; конечный продукт этого процесса, СO2, выводится во внешнюю среду, где вновь может вовлекаться в процесс фотосинтеза. Углеродсодержащие органические соединения тканей живых организмов после их смерти подвергаются биологическому разложению организмами-редуцентами, в результате чего углерод в форме углекислоты вновь поступает в круговорот. Этот процесс составляет сущность так называемого почвенного дыхания. При определенных условиях в почве разложение накапливающихся мертвых остатков идет замедленным темпом — через образование сапрофагами (животными и микроорганизмами) гумуса, минерализация которого воздействием грибов и бактерий может идти с различной, в том числе и с низкой, скоростью. В некоторых случаях цепь разложения органического вещества бывает неполной. В частности, деятельность сапрофагов может подавляться недостатком кислорода или повышенной кислотностью. В этом случае органические остатки накапливаются в виде торфа; углерод не высвобождается и круговорот приостанавливается. Аналогичные ситуации возникали и в прошлые геологические эпохи, о чем свидетельствуют отложения каменного угля и нефти. В гидросфере приостановка круговорота углерода связана с включением СО2 в состав СаСО3 в виде известняков, мела, кораллов. В этом случае углерод выключается из круговорота на целые геологические эпохи. Лишь поднятие органогенных пород над уровнем моря приводит к возобновлению круговорота через выщелачивание известняков атмосферными осадками, а также биогенным путем —действием лишайников, корней растений. Круговорот азота. Главный источник азота органических соединений — молекулярный азот в составе атмосферы. Переход его в доступные живым организмам соединения может осуществляться разными путями. Так, электрические разряды при грозах синтезируют из азота и кислорода воздуха оксиды азота, которые с дождевыми водами попадают в почву в форме селитры или азотной кислоты. Имеет место и фотохимическая фиксация азота. Более важной формой усвоения азота является деятельность азот-фиксирующих микроорганизмов, синтезирующих сложные протеиды. Отмирая, они обогащают почву органическим азотом, который быстро минерализуется. Таким путем в почву ежегодно поступает около 25 кг азота на 1 га (для сравнения — путем фиксации азота разрядами молний — 4-10 кг/га). Наиболее эффективная фиксация азота осуществляется бактериями, формирующими симбиотические связи с бобовыми растениями. Образуемый ими органический азот диффундирует в ризосферу, а также включается в наземные органы растения-хозяина. Таким путем в наземных и подземных органах растений (например, клевера или люцерны) на 1 га накапливается за год 150-400 кг азота. Существуют азотфиксирующие микроорганизмы, образующие симбиоз и с другими растениями. В водной среде и на очень влажной почве непосредственную фиксацию атмосферного азота осуществляют цианобактерии (способные также к фотосинтезу). Во всех этих случаях азот попадает в растения в форме нитратов. Эти соединения через корни и проводящие пути доставляются в листья, где используются для синтеза протеинов; последние служат основой азотного питания животных. Экскреты и мертвые организмы составляют базу цепей питания организмов-сапрофагов, разлагающих органические соединения с постепенным превращением органических азотсодержащих веществ в неорганические. Конечным звеном этой редукционной цепи оказываются аммонифицирующие организмы, образующие аммиак NH3, который затем может войти в цикл нитрификации: Nitrosomonas окисляют его в нитриты, a Nitrobacter окисляют нитриты в нитраты. Таким образом, цикл азота может быть продолжен. В то же время происходит постоянное возвращение азота в атмосферу действием бактерий-денитрификаторов, которые разлагают нитраты до N2. Эти бактерии активны в почвах, богатых азотом и углеродом. Благодаря их деятельности ежегодно с 1 га почвы улетучивается до 50-60 кг азота. Азот может выключаться из круговорота путем аккумуляции в глубоководных осадках океана. В известной мере это компенсируется выделением молекулярного N2 в составе вулканических газов. Круговорот воды. Вода — необходимое вещество в составе любых живых организмов. Основная масса воды на планете сосредоточена в гидросфере. Испарение с поверхности водоемов представляет источник атмосферной влаги; конденсация ее вызывает осадки, с которыми в конце концов вода возвращается в океан. Этот процесс составляет большой круговорот воды на поверхности Земного шара. В пределах отдельных экосистем осуществляются процессы, усложняющие большой круговорот и обеспечивающие его биологически важную часть. В процессе перехвата растительность способствует испарению в атмосферу части осадков раньше, чем они достигнут поверхности земли. Вода осадков, достигшая почвы, просачивается в нее и либо образует одну из форм почвенной влаги, либо присоединяется к поверхностному стоку; частично почвенная влага может по капиллярам подняться на поверхность и испариться. Из более глубоких слоев почвы влага всасывается корнями растений; часть ее достигает листьев и транспирируется в атмосферу. Эвапотранспирация— это суммарная отдача воды из экосистемы в атмосферу. Она включает как физически испаряемую воду, так и влагу, транспирируемую растениями. Уровень транспирации различен для разных видов и в разных ландшафтно-климатических зонах. Если количество воды, просочившейся в почву, превышает ее влагоемкость, она достигает уровня грунтовых вод и входит в их состав. Подземный сток связывает почвенную влагу с гидросферой. Таким образом, для круговорота воды в пределах экосистем наиболее важны процессы перехвата, эвапотранспирации, инфильтрации и стока. В целом круговорот воды характеризуется тем, что в отличие от углерода, азота и других элементов вода не накапливается и не связывается в живых организмах, а проходит через экосистемы почти без потерь; на формирование биомассы экосистемы используется лишь около 1% воды, выпадающей с осадками. Круговорот фосфора. В природе фосфор в больших количествах содержится в ряде горных пород. В процессе разрушения этих пород он попадает в наземные экосистемы или выщелачивается осадками и в конце концов оказывается в гидросфере. В обоих случаях этот элемент вступает в пищевые цепи. В большинстве случаев организмы-редуценты минерализуют органические вещества, содержащие фосфор, в неорганические фосфаты, которые вновь могут быть использованы растениями и таким образом снова вовлекаются в круговорот. В океане часть фосфатов с отмершими органическими остатками попадает в глубинные осадки и накапливается там, выключаясь из круговорота. Процесс естественного круговорота фосфора в современных условиях интенсифицируется применением в сельском хозяйстве фосфорных удобрений, источником которых служат залежи минеральных фосфатов. Это может быть поводом для тревоги, поскольку соли фосфора при таком использовании быстро выщелачиваются, а масштабы эксплуатации минеральных ресурсов все время растут, составляя в настоящее время около 2 млн. т/год. Кислород - наиболее активный газ. В пределах биосферы происходит быстрый обмен кислорода среды с живыми организмами или их остатками после гибели. В составе земной атмосферы кислород занимает второе место после азота. Господствующей формой нахождения кислорода в атмосфере является молекула О2. Круговорот кислорода в биосфере весьма сложен, поскольку он вступает во множество химических соединений минерального и органического миров. Свободный кислород современной земной атмосферы является побочным продуктом процесса фотосинтеза зеленых растений и его общее количество отражает баланс между продуцированием кислорода и процессами окисления и гниения различных веществ. В истории биосферы Земли наступило такое время, когда количество свободного кислорода достигло определенного уровня и оказалось сбалансированным таким образом, что количество выделяемого кислорода стало равным количеству поглощаемого кислорода. Вторым по содержанию в атмосфере после азота является кислород, составляющий 20,95% ее по объему. Гораздо большее его количество находится в связанном состоянии в молекулах воды, в солях, а также в оксидах и других твердых породах земной коры, однако к этому огромному фонду кислорода экосистема не имеет непосредственного доступа. Время переноса кислорода в атмосфере составляет около 2500 лет, если пренебречь обменом кислорода между атмосферой и поверхностными водами. Механизм круговорота кислорода достаточно прост. Полагают, что молекула кислорода (О2) , образующаяся при фотосинтезе, получает один свой атом от диоксида углерода, а другой - от воды; молекула кислорода, потребляемая при дыхании, отдает один свой атом диоксиду углерода, а другой - воде. Таким образом, круговорот кислорода завязан на процессы фотосинтеза и дыхания. Фотосинтез. 6СО2 + 6Н20 (свет, хлорофилл)= С6Н1206 + 602. Дыхание. С6Н1206 + 602 = 6СО2 + 6Н20 + энергия. Круговорот серы. Сера попадает в почву в результате естественного разложения некоторых горных пород (серный колчедан FeS2, медный колчедан CuFeS2), а также как продукт разложения органических веществ (главным образом растительного происхождения). Через корневые системы сера поступает в растения, в организме которых синтезируются содержащие этот элемент аминокислоты цистин, цистеин, метионин. В организме животных сера содержится в очень малых количествах и попадает в них с кормом. Сера из органических соединений попадает в почву благодаря разложению мертвых органических остатков микроорганизмами. В этом процессе органическая сера может быть восстановлена в H2S и минеральную серу или же окислена в сульфаты, которые поглощаются корнями растений, т. е. вновь вступают в круговорот. В наше время в круговорот вовлекается и сера промышленного происхождения (дымы), переносимая с дождевой водой. С появлением человека возник антропогенный круговорот или обмен веществ. Антропогенный круговорот (обмен) — круговорот (обмен) веществ, движущей силой которого является деятельность человека. В нем можно выделить две составляющие: биологическую связанную с функционированием человека как живого организма, и техническую, связанную с хозяйственной деятельностью людей (техногенный круговорот (обмен)). Вопрос №2 Приведите классификацию видов загрязнения биосферы. Различают загрязнения: - антропогенные; - природные (пыльные бури, вулканический пепел, селевые потоки и др.). Загрязнения, возникающие в процессе деятельности человека, являются главным фактором вредного воздействия на природную среду. В самом общем виде загрязнители и загрязнения окружающей природной среды классифицируются так: 1. По происхождению - механические – различные твердые частички или предметы (выброшенные как ненужные, отработанные, неиспользованные) на поверхности Земли, в почвах, воде, в Космосе (пыль, обломки машин и аппаратов); - химические – твердые, газообразные и жидкие вещества, химические элементы и соединения искусственного происхождения, которые поступают в биосферу и нарушают природные процессы круговорота веществ и энергии (различные атмосферные загрязнители, сточные воды, твердые отходы и др.; особенно опасные – химическое оружие); - физические – это изменения тепловых, электрических, электромагнитных, гравитационных, световых, радиационных полей в природной среде, ультразвуковое, инфразвуковое, лазерное, ионизирующее, ультрафиолетовое, электромагнитное излучение, шумы и вибрации, которые создает человек; - биологические – появление в природе в результате деятельности людей новых видов организмов (например, вирус СПИДа), повышение патогенности паразитов и возбудителей болезней, а также спровоцированное человеком катастрофическое размножение отдельных видов (например, вследствие необоснованной интродукции, нарушений карантина и др.); - информационные - информационный шум, ложная информация, факторы беспокойства и др. а также могут быть: - промышленные; - бытовые; - военные. 2. По продолжительности действия - стойкие – которые долго сохраняются в природе (пластмассы, полиэтилены, некоторые материалы, стекло, радиоактивные вещества с длительным периодом полураспада и др.); - средней стойкости - нестойкие - быстро распадаются, растворяются, нейтрализуются в природной среде под влиянием разных факторов и процессов; 3. По влиянию на биоту - прямого действия - непрямого действия 4. По характеру - запланированные (специально) - попутные - аварийно-случайные Подавляющая часть антропогенных воздействий носит целенаправленный характер, т.е. осуществляется человеком сознательно во имя достижения конкретных целей. Однако существуют стихийные, непроизвольные антропогенные воздействия (напр., процессы подтопления территории, возникающие после ее застройки и др.). В зависимости от особенностей циклов массообмена загрязняющий компонент может распространяться на всю поверхность планеты, на более или менее значительную территорию или иметь локальный характер. Т.е, экологические кризисы, являющиеся результатом загрязнения окружающей среды, могут быть трех видов: - глобальные (одной из проблем, имеющих глобальный характер, является возрастание содержания в атмосфере углекислого газа в результате техногенных выбросов. Наиболее опасным последствием этого явления может стать повышение температуры воздуха благодаря «парниковому эффекту»); - региональные (к загрязнениям регионального масштаба относятся многие отходы промышленных предприятий и транспорта. В первую очередь, это касается диоксида серы, который вызывает образование кислотных дождей, поражающих организмы растений и животных и вызывающих заболевания населения. Техногенные оксиды серы распределяются неравномерно и наносят ущерб отдельным районам. За счет переноса воздушных масс они зачастую пересекают границы государств и оказываются на территориях, удаленных от индустриальных центров); - локальные (в крупных городах и промышленных центрах воздух, наряду с оксидами углерода и серы, часто загрязнен оксидами азота и твердыми частицами, выбрасываемыми автомобильными двигателями и дымовыми трубами. Нередко наблюдается образование смога. Хотя эти загрязнения носят локальных характер, они затрагивают многих людей, компактно поживающих на таких территориях, кроме того, наносится ущерб окружающей природе). Вопрос №3 Что понимают под токсичностью химических элементов? Токсичность – это способность химического элемента или соединения вызывать нарушения физиологических функций организма, возникновение симптомов интоксикаций (отравления) или даже гибель. Степень токсичности вещества характеризуется величиной токсичной дозы - количеством вещества, отнесенного к единице массы животного или человека, которое может вызвать определенный токсический эффект. Чем меньше эта величина, тем выше токсичность. Например утилизация отходов солей талия приводит к смертельным случаям в 70%. В экспериментальной токсикологии чаще всего пользуются средней летальной дозой (DL50), при которых погибает 50% подопытных животных. Если же наблюдается 100%-иая их гибель, то такая доза или концентрация обозначается как абсолютная летальная (DL100). Степень токсичности загрязнителя характеризуется также предельно допустимой концентрацией (ПДК). Эта величина равна максимальному количеству вещества, которое при ежедневном воздействии на организм в течение длительного времени не вызывает в нем патологических изменений и нарушений нормальной жизнедеятельности. Существуют различные классификации веществ по степени их опасности. В промышленной токсикологии наиболее широко используется классификация, предусматривающая четыре класса: чрезвычайно опасные, высокоопасные, умеренно опасные и малоопасные вредные вещества. Величина токсической дозы зависит от способа введения вещества или путей его поступления в организм, от вида животных, возрастных, половых и индивидуальных особенностей, а также от конкретных условий воздействия вещества. Токсичные вещества могут обладать способностью к накоплению (кумуляции). В этом случае можно выделить несколько типов кумуляции: 1) материальная (накопление вещества в организме), 2) функциональная (происходит суммирование токсических эффектов), 3) смешанный тип (сочетание материальной и функциональной кумуляции). Под характером токсического действия вещества на организм обычно подразумевают особенности механизмов токсического действия, особенности патофизиологических процессов и симптомов интоксикации, динамику развития их во времени, а также другие стороны токсического действия веществ. Вопрос №4 Назовите основные группы приборов для регистрации радиоактивного излучения. Наблюдение и регистрация радиоактивных излучений (α, β, γ) основаны на их способности производить ионизацию или возбуждение атомов среды. Сцинтилляционный счетчик – детектор ядерных частиц основными элементами которого являются синтиллятор (кристаллофосфор, излучающий вспышки света при попадании в него частиц) и фотоэлектронный умножитель (ФЭУ), позволяющий преобразовать слабые световые вспышки в электрические импульсы, которые регистрируются электронной аппаратурой. Ионизационные счетчики – заполненные газом электрические конденсаторы – дектекторы частиц, основанные на способности заряженных частиц вызывать ионизацию газа, с последующим разделением продуктов ионизации в электрическом поле. Если счетчик регистрирует только ионы, образовавшиеся непосредственно под действием частиц, то такой счетчик называется импульсной ионизационной камерой. Счетчики, в которых основную роль играет ионизация, обусловленная столкновениями первичных ионов с атомами и молекулами газа, в результате чего возникает разряд в газе, называются газоразрядными счетчиками. Пример газоразрядного счетчика – счетчик Гейгера-Мюллера. Полупроводниковые счетчики – полупроводниковые диоды, прохождение через которые регистрируемых частиц, приводит к появлению электрического тока через диод. Камера Вильсона – цилиндр с плотно прилегающим поршнем, заполненный нейтральным газом. При резком (адиабатическом) расширении газ становится пересыщенным и на траекториях частиц, пролетевших через камеру, образуются треки из тумана, которые фотографируются. Пузырьковая камера – конструктивно похожая на камеру Вильсона и заполненная прозрачной перегретой жидкостью. Пролетающая через камеру заряженная частица вызывает резкое вскипание жидкости, и траектория частицы оказывается обозначенной цепочкой пузырьков газа – образуя трек, который как и в камере Вильсона, фотографируется. Эффективный объем пузырьковой камере 2-3 подряда больше, чем у камеры Вильсона, так как жидкости гораздо плотнее газов. Ядерные фотоэмульсии – толстослойные фотографические эмульсии, прохождение заряженных частиц через которые вызывает ионизациию, приводящую к образованию скрытого изображения в эмульсии. После проявления следы заряженных частиц обнаруживаются в виде цепочки зерен металлического серебра. Для исследований высокоэнергетических частиц используются стопы пластинок – большое число маркированных фотоэмульсионных пластинок, помещаемых на пути и после проявления промеряемых под микроскопом. Вопрос №5 Что такое экологические фонды? Экологические фонды – это система общественных и государственных организаций, которые ставят своей целью решение экологических проблем. Внебюджетные государственные экологические фонды находятся в единой государственной системе, включая федеральный экологический фонд, республиканские, краевые, областные и местные фонды. Источниками средств экологических фондов являются средства предприятий, учреждений, организаций, граждан, а также иностранных юридических лиц и граждан в виде: платы за нормативные и сверхнормативные (лимитные и сверхлимитные) выбросы, сбросы загрязняющих веществ в окружающую среду, размещение отходов и др. виды загрязнения; сумм, полученных по искам о возмещении вреда и штрафов за экологические правонарушения; средств от реализации конфискованных орудий охоты и рыболовства, незаконно добытой с их помощью продукции; полученных в виде дивидендов, процентов по вкладам, банковским депозитам, от долевого использования собственных средств фонда в деятельности предприятий и иных юридических лиц; инвалютных поступлений от иностранных юридических лиц и граждан. Важная сторона деятельности региональных экологических фондов — участие в мониторинге состояния окружающей среды, в мероприятиях по строительству природоохранных объектов и внедрению экологически приемлемых технологий, укреплению материальной базы природоохранных организаций. Экологические фонды реализуют программы поддержки информационно-просветительской деятельности в области охраны окружающей среды и рационального природопользования. Цель программы — обеспечить доступ общественности к экологической информации; способствовать становлению и развитию СМИ, специализирующихся в области охраны природы, повышению их роли в формировании экологического мировоззрения населения; содействовать проведению мероприятий, направленных на обеспечение охраны окружающей среды и рационального использования природных ресурсов. Основные виды деятельности экологических фондов в этой области: поддержка просветительных и информационных программ и проектов, реализуемых в СМИ; издание просветительной, справочной, нормативной правовой и иной литературы; создание специализированных циклов радио- и телепередач, кино- и видеофильмов; выпуск плакатов, буклетов и иной полиграфической продукции, направленной на популяризацию экологических знаний; создание и развитие систем массового распространения экологической информации; проведение просветительных, методических, научно-практических и иных информационных мероприятий, направленных на обеспечение охраны окружающей среды и рационального использования природных ресурсов. |
