7 вариант. 7. Вычислите в молях а 6,021022 молекул С
 Скачать 66.06 Kb. Скачать 66.06 Kb.
|
|
7.Вычислите в молях: а) 6,02∙1022 молекул С2Н2; б) 1,80∙1024 атомов азота; в) 3,01∙1023 молекул NH3. Какова молярная масса указанных веществ? Решение: а) Дано: N(С2Н6)= 6,02·1022молекул n(С2Н6) - ? Решение: 1 моль вещества – количество вещества, в котором содержится столько же молекул (атомов, сколько их содержится в 0,012 кг углерода). Моль любого вещества содержит одно и то же число молекул – число Авогадро (NA=6,02·1023моль-1). Молярная масса (М)– это масса 1 моль вещества, единицы измерения г/моль. Численно она совпадает с относительной молекулярной массой (Mr). Для нахождения количества вещества используем формулу 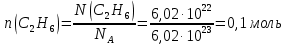 Мr(С2Н6)=2∙12+6∙1=30 Следовательно, М(С2Н6)=30 г/моль. б) Дано: N(N)= 1,8·1024томов n(N) - ? Решение: В данной задаче идёт речь об атомах азота, поэтому расчёт ведём именно для атомарного азота: 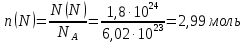 Mr(N)=14 Следовательно, М(N)=14 г/моль. в) Дано: N(NH3)= 3,01·1023атомов n(NH3) - ? Решение: 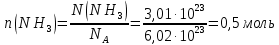 Mr(NH3)=14+3∙1=17 Следовательно, М(NH3)=17 г/моль. 27 Какие орбитали атома заполняются электронами раньше: 4dили 5s; 6sили 5р Почему? Напишите электронную формулу атома элемента с порядковым номером 43. Решение: Согласно правила Клечковского рассчитаем сумму главного и орбитального квантовых чисел для указанных в задании подуровней.
Сначала заполняется подуровень с меньшей суммой главного и орбитального квантовых чисел, то есть 5s -подуровень, а затем уровень с большей суммой главного и орбитального квантовых чисел, то есть 4d -подуровень.
При одинаковой сумме главного и орбитального квантовых чисел первым заполняется электронами подуровень, у которого меньше главное квантовое число, то есть сначала будет заполняться 5р-подуровень электронами, а потом уже 6s-подуровень. Электронная формула атома технеция (№ 43): 43Tc 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d5 47(53) Исходя из степени окисления атомов соответствующих элементов, дайте мотивированный ответ на вопрос: какой из двух гидроксидов является более сильным основанием: CuOH или Cu(OH)2; Fe(OH)2 или Fe(OH)3; Sn(OH)2 или Sn(OH)4? Напишите уравнения реакций, доказывающих амфотерность гидроксида олова (II). Решение: Сила оснований зависит от прочности связей Me–OH. Чем связь Me–OH менее прочная, тем более сильным будет основание. Чем больше степень окисления металла, тем более полярной будет связь Me–OH, соответственно чем больше степень окисления металла, тем более прочной будет связь Me–OH. То есть чем меньше степень окисления металла в гидроксиде, тем более сильным будет основание. Исходя из вышеизложенного: Cu+1OH более сильное основание, чем Cu+2(OH)2, так как +1<+2; Fe+2(OH)2 более сильное основание, чем Fe+3(OH)3, так как +2<+3; Sn+2(OH)2 более сильное основание, чем Sn+4(OH)4, так как +2<+4. Уравнения реакций, доказывающие амфотерность гидроксида олова (II): Sn(OH)2+2KOH=K2[Sn(OH)4] Sn(OH)2+2HCl=SnCl2+2H2O 67 (87) Кристаллический хлорид аммония образуется при взаимодействии газообразных аммиака и хлороводорода. Напишите термохимическое уравнение этой реакции, предварительно вычислив ее тепловой эффект. Сколько теплоты выделится, если в реакции было израсходовано 10 л аммиака в пересчете на нормальные условия? Ответ: 78,97 кДж. Решение: Дано: V(NH3)=10 л Q - ? Решение: Используя следствие из закона Гесса находим тепловой эффект химической реакции NH3(г) + HCl(г) = NH4Cl(к). Из закона Гесса следует: тепловой эффект реакции равен разности между теплотами образования всех веществ, указанных в правой части уравнения (конечных веществ или продуктов реакции), и теплотами образования всех веществ, указанных в левой части уравнения (исходных веществ), взятых с коэффициентами, равными коэффициентам перед формулами этих веществ в уравнении реакции ∆H0(NH3)=-46,19 кДж/моль ∆H0(HCl)=-92,31 кДж/моль ∆H0(NH4Cl)=-315,39 кДж/моль ∆Hх.р. =(1∙∆H0(NH4Cl))-(1∙∆H0( NH3)+1∙∆H0(HCl))=(1∙(-315,39))-(1∙(-46,19)+1∙(-92,31))=-176,89 кДж Термохимическое уравнение реакции: NH3(г) + HCl(г) = NH4Cl(к), ∆H = -176,89 кДж Находим количество теплоты, которое выделится при взаимодействии 10 л аммиака: NH3(г) + HCl(г) = NH4Cl(к), ∆H = -176,89 кДж По уравнению реакции 22,4 л 176,89 кДж По условию задачи 10 л х кДж 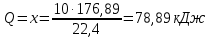 Ответ: в результате реакции выделится 78,89 кДж теплоты. 87(107). Прямая или обратная реакция будет протекать при стандартных условиях в системе 2NO(г) + O2 (г) ↔ 2NO2(г) Решение: Находим изменение энергии Гиббса системы: 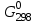 (NO2)=51,5 кДж/моль (NO2)=51,5 кДж/моль 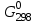 (NO)=86,6 кДж/моль (NO)=86,6 кДж/моль 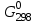 х.р.=(2∙ х.р.=(2∙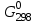 ( NO2))-(2∙ ( NO2))-(2∙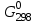 (NO))=(2∙51,2)-(2∙86,6)=-70,8 кДж (NO))=(2∙51,2)-(2∙86,6)=-70,8 кДж 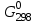 х.р. < 0, поэтому при стандартных условиях самопроизвольно протекает прямая реакция. х.р. < 0, поэтому при стандартных условиях самопроизвольно протекает прямая реакция.107(127) Как изменится скорость реакции, протекающей в газовой фазе, при повышении температуры на 60°С, если температурный коэффициент скорости данной реакции γ = 2? Решение: Дано: ∆t=600С γ=2 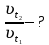 Решение: Используя правило Вант-Гоффа находим во сколько раз возрастёт скорость реакции при повышении температуры на 60оС: 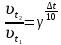 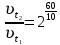 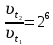 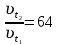 Следовательно, при повышении температуры на 60оС скорость реакции возрастает в 64 раза. Ответ: 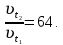 127(147) Для осаждения в виде AgCl всего серебра, содержащегося в 100 см3 раствора AgN03, потребуется 50 см3 0,2 н. раствора НС1. Какова молярная концентрация эквивалента раствора AgNO3? Какая масса AgCl выпала в осадок? Ответ: 0,1 н.; 1,433 г. Решение: Дано: V(AgNO3p-p)= 100 см3=0,1 дм3 V(HClp-p)= 50 см3 CЭКВ.(HCl)=0,2 моль/л СЭКВ.(AgNO3) - ? m(AgCl) - ? Решение: Запишем уравнение химической реакции, которая протекает при смешивании растворов соляной кислоты и нитрата серебра: AgNO3 + HCl = AgCl↓+ HNO3 Поскольку веществ во взаимодействие вступают в эквивалентных количествах, то, используя закон эквивалентов может найти молярную концентрацию эквивалентов нитрата серебра: 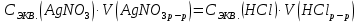 Следовательно, объёмы реагирующих растворов обратно пропорциональны солярной концентрации эквивалентов этих растворов. Исходя из этого, находим молярную концентрацию эквивалентов в растворе AgNO3: 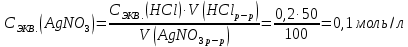 Находим количество эквивалентнов AgNO3, которое вступило во взаимодействие с раствором соляной кислоты: 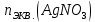 = =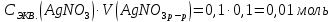 Согласно закона эквивалентов 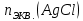 = =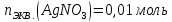 Находим молярную массу эквивалентна нитрата серебра: 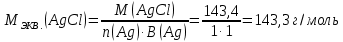 Находим массу хлорида серебра, которая выпала в осадок: 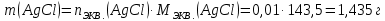 Ответ: СЭКВ.(AgNO3)=0,1 моль/л; m(AgCl)=1,435 г. 147(167)Вычислите температуру кипения 5%-ного раствора нафталина С10Н8 в бензоле. Температура кипения бензола 80,2°С. Эбулиоскопическая константа его 2,57°. Ответ: 81,25°С. Решение: Дано: W(C10H8)=5 % tкип.(C6H6)=80,2оС КЭ=2,57 tкип.(р-ра) - ? Решение: Допустим имеем 100 г раствора. Тогда масса нафталина в нём равна 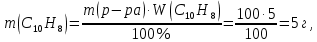 а масса воды 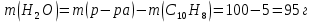 Находим изменение температуры кипения раствора нафталина в бензоле: 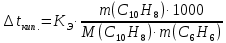 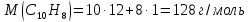 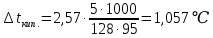 Находим температуру кипения раствора нафталина в бензоле: 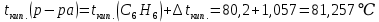 Ответ: tкип.(р-ра)=81,257оС. 167 (187) Составьте по три молекулярных уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями: а) Си2+ + S 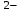 = CuS; = CuS;б) SiO 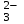 + 2 H+ = H2SiO3. + 2 H+ = H2SiO3.Решение: а) CuCl2+Na2S=CuS↓+2NaCl CuBr2+K2S= CuS↓+2KBr Cu(NO3)2+BaS= CuS↓+Ba(NO3)2 б) Na2SiO3+2HCl=H2SiO3↓+2NaCl K2SiO3+H2SO4= H2SiO3↓+K2SO4 3Na2SiO3+2H3PO4= 3H2SiO3↓+2Na3PO4 187 К 500 мл воды прибавили 20 мл 0,1 н раствора НС1. Найдите рН полученного раствора. Ответ: 2,4. Решение: Дано: CЭКВ.1(HCl)=0,1 н V1(p-pa)=20мл=0,02 л V(H2O)=500 мл=0,5 л рН2 - ? Решение: Находим молярную концентрацию HCl в 0,1 н. растворе: 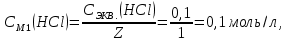 где Z – эквивалентность кислоты. Находим количество вещества соляной кислоты, которое содержится в 0,02 л 0,1 М раствора: 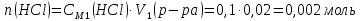 Находим объём конечного раствора: 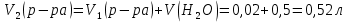 Находим концентрацию соляной кислоты в конечном растворе: 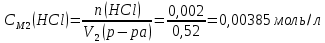 Находим концентрацию ионов Н+ в растворе: HCl – сильный электролит, поэтому в водном растворе диссоциирует полностью. HCl → H+ + Cl- По уравнению 1 моль 1 моль По условию 0,00385 моль х моль 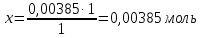 Следовательно, [H+]=0,00385 моль/л. Находим рН раствора: рН=-lg[H+] рН=-lg0,00385 рН=2,4 Ответ: рН=2,4. 207 Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей Рb(NО3)2, Na2CO3, Fe2(SO4)3. Какое значение рН (7 < рН < 7) имеют растворы этих солей? Решение: Рb(NО3)2 – соль слабого основания и сильной кислоты, поэтому в водном растворе подвергается гидролизу по катиону. ПЕРВАЯ СТУПЕНЬ ГИДРОЛИЗАPb(NO3)2 + HOH ⇄ PbOHNO3 + HNO3 Pb2+ + 2NO3- + HOH ⇄ PbOH+ + NO3- + H+ + NO3- Pb2+ + HOH ⇄ PbOH+ + H+ ВТОРАЯ СТУПЕНЬ ГИДРОЛИЗАPbOHNO3 + HOH ⇄ Pb(OH)2 + HNO3 PbOH+ + NO3- + HOH ⇄ Pb(OH)2 + H+ + NO3- PbOH+ + HOH ⇄ Pb(OH)2 + H+ В результате гидролиза образовались ионы водорода (H+), поэтому раствор имеет кислую среду (pH < 7). Na2CO3 – соль сильного основания и слабой кислоты, поэтому в водном растворе подвергается гидролизу по аниону. ПЕРВАЯ СТУПЕНЬ ГИДРОЛИЗАNa2CO3 + HOH ⇄ NaHCO3 + NaOH 2Na+ + CO32- + HOH ⇄ Na+ + HCO3- + Na+ + OH- CO32- + HOH ⇄ HCO3- + OH- ВТОРАЯ СТУПЕНЬ ГИДРОЛИЗАNaHCO3 + HOH ⇄ H2CO3 + NaOH Na+ + HCO3- + HOH ⇄ H2CO3 + Na+ + OH- HCO3- + HOH ⇄ H2CO3 + OH- В результате гидролиза образовались гидроксид-ионы (OH-), поэтому раствор имеет щелочную среду (pH > 7). Fe2(SO4)3 – соль слабого основания и сильной кислоты, поэтому в водном растворе подвергается гидролизу по катиону. ПЕРВАЯ СТУПЕНЬ ГИДРОЛИЗАFe2(SO4)3 + 2HOH ⇄ 2FeOHSO4 + H2SO4 2Fe3+ + 3SO42- + 2HOH ⇄ 2FeOH2+ + 2SO42- + 2H+ + SO42- Fe3+ + HOH ⇄ FeOH2+ + H+ ВТОРАЯ СТУПЕНЬ ГИДРОЛИЗА2FeOHSO4 + 2HOH ⇄ (Fe(OH)2)2SO4 + H2SO4 2FeOH2+ + 2SO42- + 2HOH ⇄ 2Fe(OH)2+ + SO42- + 2H+ + SO42- FeOH2+ + HOH ⇄ Fe(OH)2+ + H+ ТРЕТЬЯ СТУПЕНЬ ГИДРОЛИЗА(Fe(OH)2)2SO4 + 2HOH ⇄ 2Fe(OH)3 + H2SO4 2Fe(OH)2+ + SO42- + 2HOH ⇄ 2Fe(OH)3 + 2H+ + SO42- Fe(OH)2+ + HOH ⇄ Fe(OH)3 + H+ В результате гидролиза образовались ионы водорода (H+), поэтому раствор имеет кислую среду (pH < 7). 227Реакции выражаются схемами: HNО3 + Са NH4NО3 + Са(NO3)2 + Н2О; K2S + КМnО4 + H2SО4 S + K2SО4 + МnSО4 + Н2О. Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое— восстановителем; какое вещество окисляется, какое —восстанавливается. Решение: HN+5O3 + Ca0 →N-3H4NO3 + Сa+2(NO3)2 + Н2О Ca0 – 2е-→Ca+2 4 восстановитель, процесс окисления 8 N+5+8е-→N-3 1 окислитель, процесс восстановления 10HNO3 + 4Ca →NH4NO3 + 4Сa(NO3)2 + 3Н2О HNO3 – окислитель, так как присоединяет 8 электронов и восстанавливается. Са – восстановитель, так как отдаёт 2 электрона и окисляется. K2S-2 + КМn+7О4 + H2SО4 → S0 + K2SО4 + Mn+2SО4 + H2О. S-2 – 2е-→S0 5 восстановитель, процесс окисления 10 Mn+7+5-→Mn+2 2 окислитель, процесс восстановления 5K2S + 2КМnО4 + 8H2SО4 → 5S + 6K2SО4 + 2MnSО4 + 8H2О. КМnО4 – окислитель, так как присоединяет 5 электронов и восстанавливается. K2S – восстановитель, так как отдаёт 2 электрона и окисляется. 247Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС медно-кадмиевого гальванического элемента, в котором [Cd2+] = 0,8 моль/л, а [Сu2+] = 0,01 моль/л. Ответ: 0,68 В. Решение: Сравним стандартные электродные потенциалы электродов: E0Cu2+/Cu=0,34 B E0Cd2+/Cd=-0,40 B Кадмий имеет стандартный электродный потенциал равный -0,40 В. Он меньше, чем стандартный электродный потенциал медного электрода, поэтому кадмий выступает в роли анода, а медный электрод в роли катода. Схема гальванического элемента имеет вид: A(-) Cd| Cd+2 (0,8 моль/л) || Сu+2 (0,01 моль/л)|Cu (+)K Следовательно, на электродах протекают следующие процессы: А(-): Cd0 - 2 e- = Cd2+ 1 окисление 2 К(+): Cu2+ + 2 e- = Cu0 2 восстановление Суммарная токообразующая реакция: Cd0+Cu2+→ Cd2++ Cu0 Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста: Е0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Определим электродные потенциалы кадмия и меди, опущенные в растворы их солей заданной концентрации: ECd2+/Cd = E0Cd2+/Cd + 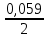 ∙lg0,8=-0,40+0,0295·(-0,1) =-0,40295 B ∙lg0,8=-0,40+0,0295·(-0,1) =-0,40295 BECu2+/Cu =E0Cu2+/Cu+ 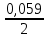 ∙lg0,01=0,34+0,0295·(-2)=0,281 B ∙lg0,01=0,34+0,0295·(-2)=0,281 BДля определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода, получим: ЭДС=Eкатода- Eанода= ECu2+/Cu – ECd2+/Cd = 0,281 -(-0,40295)≈0,122 В 267На сколько уменьшится масса серебряного анода, если электролиз раствора AgNO3 проводить при силе тока 2 А в течение 38 мин 20 с? Составьте электронные уравнения процессов, происходящих на графитовых электродах. Ответ: 5,14 г. Решение: Рассмотрим процесс электролиза водного раствора нитрата серебра на инертных электродах. Рассчитаем электродные потенциалы выделения водорода и кислорода на электродах с учётом перенапряжения: Выделение водорода протекает с перенапряжением, для графита оно равно 0,78 В, поэтому 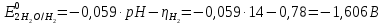 . .Выделение кислорода протекает с перенапряжением, для графита оно равно 1,17 В, поэтому  =1,23-0,059∙рН+ =1,23-0,059∙рН+ =1,23-0,059∙0+1,17=2,4 В). =1,23-0,059∙0+1,17=2,4 В).AgNO3→Ag++NO3- K(-): Ag+, H2O A(+): NO3-, H2O  NO3- - ионы не разряжаются NO3- - ионы не разряжаются 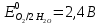 Так как 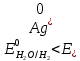 , Следовательно, может протекать , Следовательно, может протекатьпроисходит восстановление в первую только процесс окисления очередь ионов Ag+: воды: Ag++1e-=Ag0 2H2O -4ē = О 2+ 4 H+ Суммарное уравнение электролиза: 4AgNO3+2Н2О→ 4Ag + О2 +4HNO3 Обобщенный закон Фарадея связывает количество вещества, образовавшегося при электролизе, со временем электролиза и силой тока: 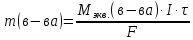 , ,m - масса образовавшегося вещества , г; Мэкв.- молярная масса эквивалента вещества, г/моль; I - сила тока, А; t - время электролиза, с; F - константа Фарадея (96500 Кл/моль). Находим на сколько уменьшится масса серебряного анода, если электролиз раствора AgNO3 проводить при силе тока 2 А в течение 38 мин. 20 с (2300 c): 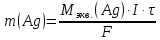 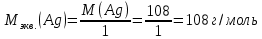 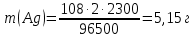 287Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары магний — никель. Какие продукты коррозии образуются в первом и во втором случаях? Решение: Чтобы определить какой металл выступает в роли анода, а какой в роли катода сравним их стандартные электродные потенциалы. E0Mg2+/Mg=-2,36 B E0Ni2+/Ni=-0,25 B Поскольку E0Mg2+/Mg < E0Ni2+/Ni, то магний – анод, а никель – катод. Схема коррозионного гальванического элемента с кислородной деполяризацией: A(-) Mg|H2O, O2 |Ni (+)K Электродные процессы, протекающие в нейтральной среде с доступом кислорода: А(-): Mg0 – 2ē → Mg2+ 2 процесс окисления 4 K(+): 2Н2О + О2 + 4ē → 4ОН– 1 процесс восстановления Суммарная реакция коррозии: 2Mg+2Н2О + О2 → 2Mg(ОН)2 Образующиеся ионы магния связываются с гидроксид-ионами, с образованием гидроксида магния: Mg(ОН)2 – продукт коррозии в нейтральной среде. Схема коррозионного гальванического элемента с водородной деполяризацией: А(-) Mg|H2O,Н+|Ni (+)K Электродные процессы, протекающие в кислой среде: А(-): Mg0 – 2ē → Mg2+ 1 процесс окисления 2 K(+): 2Н+ + 2ē → Н2 1 процесс восстановления Суммарная реакция коррозии: Mg0 + 2H+→ Mg2+ + Н2↑ Поскольку не указана кислота, в которую погружена гальванопара магний-цинк, то будем считать, что продуктом коррозии в кислой среде является соль магния (Mg2+ ). Например, Mg+2HCl→MgCl2+H2↑ 307Вычислите жесткость воды, зная, что в 600 л ее содержится 65,7 г гидрокарбоната магния и 61.2 г сульфата кальция. Ответ: 3 ммоль/л. Решение: Дано: m(Mg(HCO3)2)=65,7 г =65700 мг m(CaSO4)=61,2 г =61200 мг V(H2O)=600 л Ж - ? Решение: Находим молярную массу эквивалента гидрокарбоната магния:  Находим молярную массу эквивалента сульфата кальция:  Находим жесткость воды: 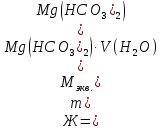 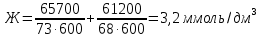 |
