контрольная по химии. А Напишите электронную формулу атома ртути Hg
 Скачать 0.6 Mb. Скачать 0.6 Mb.
|
|
№24 а)Напишите электронную формулу атома ртути Hg. б)Распределите по квантовым ячейкам электроны двух последнихуровней атома ртути, соблюдая принцип Паули и правило Гунда. в)Зная, что ртуть в соединениях может проявлять высшую валентность, равную II, определите, на каких подуровнях находятся валентные электроны атома ртути и укажите эти электроны. Напишите значения четырех квантовых чисел для всех валентных электронов атома ртути А) Электронная формула атома ртути в порядке возрастания энергий орбиталей: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 Электронная формула атома ртути в порядке следования уровней: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 6s2 Сокращенная электронная конфигурация Hg: [Xe] 4f14 5d10 6s2 Б) Распределение электронов по орбиталям выглядит следующим образом: +80Hg)2)8)18)32)18)2; Валентными электронами атома золота считаются электроны, расположенные на 5d— и 6s— подуровнях. Энергетическая диаграмма основного состояния принимает следующий вид:
(В)
N = 5, L = 2, Ml = -2, Ms = ½ №29 а)Определите число связей в молекуле H2S2O3. 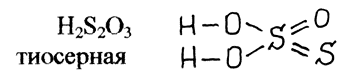 Количество Сигма-связей 6 Количество Пи-связей 2 б)Какая геометрическая конфигурация молекулы SrCl2? кубическая в)Почему молекулы Cl 2 и I 2 неполярны, а молекула ICl, состоящая из иода и хлора, полярна? Ответ обоснуйте. Любая молекула, состоящая из двух одинаковых атомов, автоматически обладает центром симметрии, который располагается на середине расстояния между этими атомами. А если в молекуле есть центр симметрии, то она не может быть полярной. Молекула представляет собой так называемый диполь, то есть два поля, одно из которых положительно заряжено, другое отрицательно, то есть при образовании химической связи электронная плотность (или пара) сместилась к какому-то атому соответственно отдалившись при этом от другого. И вот это смещение контролирует электроотрицательность - мера способности атома элемента смещать на себя образовавшуюся электронную пару. Посмотрим что у нас за молекулы рассматриваются: Cl₂, I₂ и ICl Как наверное заметили, во всех трех связь ковалентная. Теперь, рассмотрим каждую молекулу по отдельности: Cl₂. Молекула образована двумя одинаковыми атомами, значит смещения пары не будет, так как электроотрицательность одинакова и если будем вычитать электроотрицательность, то получим 0 - молекула неполярна I₂ Молекула образована одинаковыми атомами. Молекула неполярна (см. случай с хлором) ICl Молекула образована йодом и хлором, тут уже не одинаковые атомы. Посмотрим значение электроотрицательности хлора. ЭО (Cl) = 3,16 ЭО (I) = 2,66 Видим, что значение ЭО разное, значит в ходе образования связи один из атомов (с большим значением ЭО стянет на себя пару) то есть на хлор уйдет вся пара. И из-за этого у хлора будет отрицательный заряд, а у йода положительный. I⁺Cl⁻ ⇒ молекула представляет собой диполь - а значит она полярна г)Определите число связей в молекулах C2H6, C2H4, C2H2, H2. №78 а)Сколько эквивалентов HClбудет нейтрализовано 200 мл 10%-ногораствора KOH(1,08 г/мл)? б)Каким количеством граммов Ca(OH)2можно заменить 0,5 эквивалента NaOH? в)На осаждение хлора, содержащегося в 6,66 г соли, израсходовано10,88 г AgNO3. Вычислите эквивалентную массу соли. На осаждение хлора, содержащегося в 0,666 г соли, израсходовано 1,088 г нитрата серебра. Вычислите молярную массу эквивалента соли. M экв. AgNO3 в данной р-ии = M AgNO3 = 170 г/моль; по з. экв-в, M экв. соли = 0.666*(170/1.088) = 104.0625 г/моль. №105 а)Zn + HNO3(разб.) = В результате взаимодействия цинка с разбавленной азотной кислотой (Zn + HNO3 (разб) = ?) происходит образование нитрата цинка и воды, а также выделение оксида азота (I). Молекулярное уравнение реакции имеет вид:  Запишем ионное уравнение, учитывая, что простые вещества, оксиды и вода на ионы не распадаются, т.е. не диссоциируют.  Данная реакция относится к окислительно-восстановительным, поскольку химические элементы цинк и азот изменяют свои степени окисления. Схемы электронного баланса выглядят следующим образом:   Цинк – тридцатый элемент Периодической таблицы. Обозначение – Zn от латинского «zincum». Расположен в четвертом периоде, IIB группе. Относится к металлам. Заряд ядра равен 30. Электронная конфигурация выглядит следующим образом:  Главные природные соединения цинка, из которых его добывают, — минералы галмей и цинковая обманка. Общее содержание цинка в земной коре составляет приблизительно 0,01% (масс.). Цинк – голубовато-серебристый металл (рис. 1). При комнатной температуре он довольно хрупок, но при  он хорошо гнется и прокатывается в листы. При нагревании выше он хорошо гнется и прокатывается в листы. При нагревании выше  цинк становится очень хрупким. На воздухе он покрывается тонким слоем оксида или основного карбоната, предохраняющим его от дальнейшего окисления. Вода почти не действует на цинк. цинк становится очень хрупким. На воздухе он покрывается тонким слоем оксида или основного карбоната, предохраняющим его от дальнейшего окисления. Вода почти не действует на цинк.Цинк проявляет амфотерные свойства; реагирует с кислотами, щелочами. Сильный восстановитель; реагирует с кислородом, галогенами, халькогенами, нитратами металлов в щелочной среде. б)KMnO4+ Cr2(SO4)3+ H2SO4= Cr2(SO4)3+KMnO4+H2SO4=K2Cr2O7+MnSO4+K2SO4+H2O. ДСергейД ДСергейД. 5Cr2(SO4)3+6KMnO4+56KOH---->10K2CrO4+6K2MnO4+15K2SO4+28H2O Cr2(SO4)3+2KMnO4+4KOH---->. 2K2CrO4+2MnO2+3K2SO4+2H2O в)Pt + HNO3+ HCl = H2[PtCl6] + 3Pt + 18HCl + 4HNO3 → 3H2[PtCl6] + 4NO + 8H2O3 Pt + 4 HNO3 + 18 HCl → 3 H2[PtCl6] + 4 NO + 8 H2OЭто реакция комплексообразования: H2[PtCl6] представляет собой сформированный комплекс. Это окислительно-восстановительная (редокс) реакция: 3 Pt0 - 12 e- → 3 PtIV (окисление) 4 NV + 12 e- → 4 NII (восстановле́ние) Pt является восстановителем, HNO3 является окислителем. №128 а)В 1 л раствора содержится 10,6 г Na2CO3. Определите молярность инормальность раствора. Эквивалентное число z для соли равно произведению числа атомов металла в ее составе и степени окисления металла Na2CO3 z=2*1=2 M(Na2CO3)= 23*2+12+16*3=46+12+48=94+12=106 г/моль Молярная масса эквивалента M/z=106/2=53 г/моль Количество эквивалентов вещества nэк (Na2CO3)= m/Mэкв= 10.6/53= 0.2 моль Молярную концентрацию эквивалента Сэк (В) находят как отношение количества эквивалентов вещества nэк (В) к объему раствора Vp Cэк= 0.2 моль/1 литр= 0.2 моль/литр или 0.2 н (сравниваем с ответом) Источники chem-astu.ru/chair/study/equivalent/4_Equiv-Mass-Compound.shtml chimical-docs.ru/index.php?action=full&id=143 Титр Т показывает, сколько граммов растворённого вещества содержится в 1 мл или в 1 см3 раствора T= m/V= 10.6 г/1000 мл= 10.6*10^-3 г/мл (сравниваем с ответом) б)Вычислите массовый процент раствора, если 10 г NaCl растворили в 125 мл воды. Определите массовую долю вещества в растворе, полученного растворением 10 г хлорида натрия (NaCl) в 250 мл воды Начало формы Конец формы Начало формы M р-ра=10+250=260 (грамм) w=10:250×100=4% Ответ:массовая доля =4% Конец формы Начало формы Конец формы в)При 50 °С давление водяного пара равно 92,51 мм рт.ст. Рассчитайте, каково должно быть давление пара раствора, содержащего один моль хлористого натрия в 100 г воды, если кажущаяся степень диссоциации NaClв этом растворе равна 70% №155 а)Вычислите рН 0,015 н. раствора хлоруксусной кислоты СН2ClСООН, К= 1,4 ·10-3 .Вычислить рН 0,02М раствора уксусной кислоты, если Кд равна 1,75*10-5 1. [H+]=√(K*C)=√1.75*10^-5 *0.02=5.9*10^-4 моль/л pH= - lg[H+]=3.23  б)Сколько граммов Ва(OH)2надо взять, чтобы получить 425 мл раствора с рН=10,52? №178 178.CH4г+ Н2Oг= COг+ 3H2г 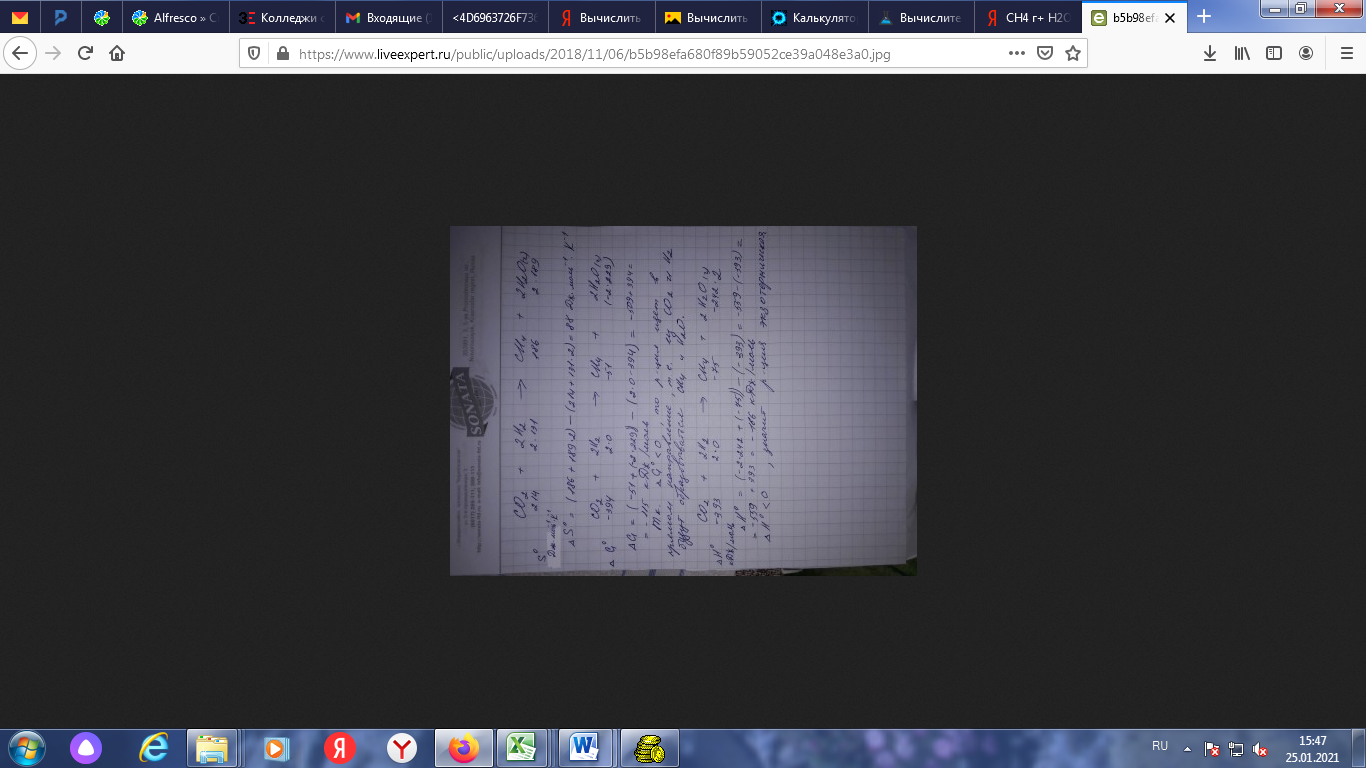 №204 а)2SO2(г) + O2(г) ↔2SO3(г) Посчитаем количество газообразных продуктов в правой и левой частях реакции ( по коэффициентам). 3 и 2. Отсюда видно,что если давление понизить,то равновесие сместится влево, т.к. система стремится восстановить равновесие в системе Данная реакция протекает с уменьшением объема. При уменьшении давления объем увеличивается, следовательно, равновесие смещается в сторону увеличения объема. В данной реакции в сторону исходных веществ, т.е. влево. б)Вычислите константу равновесия, если начальные концентрации SО2, O2, SO3 равны соответственно 1,4 моль/л, 0,36 моль/л, 0 моль/л. Равновесие установилось при концентрации SO3, равной 0,4 моль/л вычислить константу равновесия обратимой реакции 2so2+o2=2so3 ,если равновесная концентрация [so3]=0,04.а исходные концентрации веществ [so2]=1.[o2]=0.8 K = [SO3]^2 / [SO2]^2*[O2] прореагировало SO2= 0.04 моль/л, О2 = 0.04/2 = 0.02 моль/л равновесные концентрации : [SO2] = 1 -0.04 = 0.96 моль/л [O2] = 0.8 -0.02 = 0.78 моль/л K = (0.04)^2 / (0.96)^2*0.78 = ...считайте В системе 2SO2 + O2 = 2SO3; начальные концентрации SO2 и O2 соотвественно равны 0.03 моль/л и 0.025 моль/л Равновесная концентрация SO2 равна 0.01 моль/л; Вычислить константу равновесия и равновесные концентрации SO3 и O2. 1. Смотреть ответ. raja96 raja96. Если осталось so2 0.01 то значит вступило в реакцию 0.03-0.01=0.02 а кислорода вступило 0.02/2=0.01 и в равновесии кислорода осталось 0.025-0.01=0.015 а so3 у нас 0.02 образовалось потом на формулу поставиш коэфиценты в степень поднимиш 0.02(2)/0.01(2)*. 0.015=266.667 so3=0.02 o2=0.015 ровновесные конц. 209 Напишите в молекулярной и краткой ионной форме уравнения гидролиза солей. а) CuCl2 CuCl2 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону. Первая ступень (стадия) гидролиза Молекулярное уравнение CuCl2 + HOH ⇄ CuOHCl + HCl Полное ионное уравнение Cu2+ + 2Cl- + HOH ⇄ CuOH+ + Cl- + H+ + Cl- Сокращенное (краткое) ионное уравнение Cu2+ + HOH ⇄ CuOH+ + H+ Вторая ступень (стадия) гидролиза Молекулярное уравнение CuOHCl + HOH ⇄ Cu(OH)2 + HCl Полное ионное уравнение CuOH+ + Cl- + HOH ⇄ Cu(OH)2 + H+ + Cl- Сокращенное (краткое) ионное уравнение CuOH+ + HOH ⇄ Cu(OH)2 + H+ В результате гидролиза образовались ионы водорода (H+), поэтому раствор имеет кислую среду (pH < 7). Источник: https://gomolog.ru/baza-znanii/gidroliz-solei/hlorida-medi-(II).html б) Na3PO4 Первая стадия гидролизаМолекулярное уравнение: Na3PO4 + HOH ⇄ Na2HPO4 + NaOH Полное ионное уравнение: 3Na+ + PO43- + HOH ⇄ 2Na+ + HPO42- + Na+ + OH- Краткое ионное уравнение: PO43- + HOH ⇄ HPO42- + OH- Вторая стадия гидролизаМолекулярное уравнение: Na2HPO4 + H2O ⇄ NaH2PO4 + NaOH Полное ионное уравнение: 2Na+ + HPO42- + H2O ⇄ Na+ + H2PO4- + Na+ + OH- Краткое ионное уравнение: HPO42- + H2O ⇄ H2PO4- + OH- Третья стадия гидролизаМолекулярное уравнение: NaH2PO4 + H2O ⇄ H3PO4 + NaOH Полное ионное уравнение: Na+ + H2PO4- + H2O ⇄ H3PO4 + Na+ + OH- Краткое ионное уравнение: H2PO4- + H2O ⇄ H3PO4 + OH- Т.к. в результате гидролиза образовались гидроксид-ионы (OH-), то раствор имеет щелочную среду (pH > 7). в) Fe(CH3COO)2 Fe(2+) + H2O <=> Fe(OH)(+) + H(+) CH3COO(-) + H(+) <=> CH3COOH (равновесие смещено в прямом направлении) Fe(OH)(+) + H2O => Fe(OH)2 + H(+) CH3COO(-) + H(+) <=> CH3COOH (равновесие смещено в прямом направлении Теоретически, тут протекает ступенчатый гидролиз. На каждой ступени происходит взаимодействие с 1 молекулой воды. В упрощенной форме (как раз, что и требуется от вас) первая ступень будет выглядеть: Fe(CH3COO)3 + H2O = Fe(OH)(CH3COO)2 + CH3COOH Fe3+ + 3CH3COO- + H2O = Fe(OH)2+ + 2CH3COO- + CH3COOH Fe3+ + CH3COO- + H2O = Fe(OH)2+ + CH3COOH Так же возможны еще 2 ступени. Попробуйте сами, мы проверим. 259. Рассчитать ЭДС следующих гальванических элементов: Ni | Ni(NO3)20,01 н. ||CdSO40,02 н. | Cd 264 Латунь, как известно, содержит 60% Cu и 40% Zn. Определите, в каких средах (щелочной, кислой, нейтральной) происходит коррозия латуни. Напишите уравнения реакций, протекающих на анодных и катодных участках при коррозии этой детали в щелочной, кислой и нейтральной средах. Кислородная. Анод — цник, растворяется. Катод — медь, на ней восстанавливается кислород воздуха, растворенный в воде: Анод: Zn — 2e = Zn(2+) Катод: 2H2O + O2 + 2e = 4OH(-) Водородная. Анод — ценк, растворяется. Катод — медь, на нем восстанавливается водород воды: Анод: Zn — 2e = Zn(2+) Катод: 2Н2О + 2е = Н2 + 2ОН(-) 294 Вычислите время, необходимое для выделения 11,17 г железа из 1 л 1 М раствора FeSO4током в 1,34 А. Определите, сколько граммов железа осталось ещё в электролите. Вычислите время, необходимое для выделения 11,17 г железа из 1 л 1 М раствора FeSO4 током в 1,34 Аt=Q/I=m*F/(Mэ*I)=8, 36 часа. w(Fe)=M(Fe)/M(FeSO4)=0,368 или 36,8% c(FeSO4)=n/V=>n(FeSO4)=1 моль n=m/M=>m(FeSO4)=152 г mост. (Fe)=w*m(FeSO4)-11,17 г = 44,3 г | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
