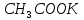химия. А в другом оксиде 69,55 кислорода. Вычислить эквивалент азота в каждом из оксидов. Решение
 Скачать 58.98 Kb. Скачать 58.98 Kb.
|
|
2-вариант Задание-2 В одном оксиде азота содержится 36,35 % кислорода, а в другом оксиде 69,55 % кислорода. Вычислить эквивалент азота в каждом из оксидов. Решение Значит на азот приходится 100%-36,35%=63,65%. Молярная масса азота равна 14 г/моль. Делим процентное соотношение азота в оксиде на молярную массу азота, чтобы узнать соотношение молекул азота в оксиде. 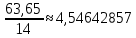 Теперь узнаем соотношение молекул кислорода в оксиде Теперь узнаем соотношение молекул кислорода в оксиде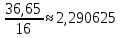 Значит примерно отношение азота к кислороду будет Значит примерно отношение азота к кислороду будетТо есть примерно в оксиде будет две части азота и одна часть кислорода. Это закись азота 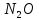 . Другой оксид здесь не подойдет. Здесь валентность кислорода как более электроотрицательного элемента будет -2. Значит у азота валентность будет +1. Молярная масса эквивалента азота будет равна . Другой оксид здесь не подойдет. Здесь валентность кислорода как более электроотрицательного элемента будет -2. Значит у азота валентность будет +1. Молярная масса эквивалента азота будет равна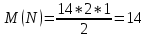 г/моль. г/моль.Так как здесь две молекулы азота. Задание-22 Соли. Дайте определение, состав, строение и номенклатура. Классификация оксидов. Приведите примеры. Составьте графические формулы. Ответ Соли - сложные вещества, состоящие из атомов металлов (иногда входит водород или гидроксильная группа) и кислотных остатков. Например, NaCl – хлорид натрия, СаSO4 – сульфат кальция и т. д. Практически все соли являются ионными соединениями, поэтому в солях между собой связаны ионы кислотных остатков и ионы металла: Na+Cl– – хлорид натрияCa2+SO42– – сульфат кальция и т.д. Соль является продуктом частичного или полного замещения металлом атомов водорода кислоты. Отсюда различают следующие виды солей:  Классификация солей 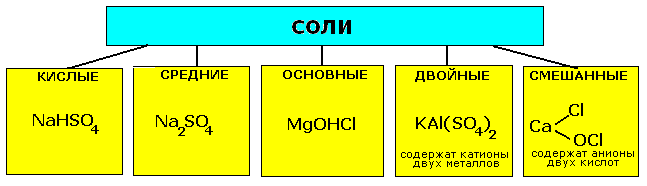
Чаще всего мы будем работать со средними солями: Названия солей для средней соли - название кислотного остатка + название металла + указываем валентность для металла с переменной валентностью Na2SO4- сульфат натрия, CuSO4- сульфат меди (II) для кислой соли – «гидро» или «дигидро» + название кислотного остатка + название металла + указываем валентность для металла с переменной валентностью NaHSO4 – гидросульфат натрия; NaH2PO4 – дигидроортофосфат натрия для основной соли – «гидроксо» + название кислотного остатка + название металла + указываем валентность для металла с переменной валентностью Mg(OH)Cl - гидроксохлорид магния ПОЛУЧЕНИЕ
Задание-42 Напишите электронные формулы атомов мышьяка и ванадия. На каких подуровнях расположены их валентные электроны? Решение: Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов nlx, где n - главное квантовое число, l - орбитальное квантовое число (вместо него указывают соответствующее буквенное обозначение - s, p, d, f), x - число электронов в данном подуровне (орбитали). При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией - меньшая сумма n+1 (правило Клечковского). Последовательность заполнения энергетических уровней и подуровней следующая: 1s>2s>2р>3s>3р>4s>3d>4р>5s>4d>5р>6s>(5d1) >4f>5d>6р>7s>(6d1-2)>5f>6d>7р Так как число электронов в атоме того или иного элемента равно его порядковому номеру в таблице Д.И. Менделеева, то для элементов мышьяка (Аs порядковый № 33) и ванадия( V -порядковый № 23) электронные формулы имеют вид: V23 1s22s22р63s23р64s23d3 Аs33 1s22s22р63s23р64s23d104р3 Валентные электроны ванадия - 4s23d3 - находятся на 4s и 3d подуровнях; Валентные электроны мышьяка 4s24р3 находятся на 4s и 4р подуровнях. Таким обра-зом, эти элементы не являются электронными аналогами и не должны размещаться в одной и той же подгруппе. Но на валентных орбиталях атомов этих элементов находится одинаковое число электронов - 5. Поэтому оба элемента помещают в одну и ту же группу периодической системы Д.И.Менделеева. Задание-62 Дайте объяснение закономерному уменьшению дипольного момента в молекулах 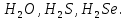 Дипольный момент молекулы характеризует способность молекул ориентироваться в электрическом поле между положительным и отрицательным электродами. Из данных молекул самое большое значение дипольного момента у молекулы воды 1,85D. 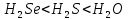 Задание -92 При получении одного грамм-эквивалента 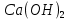 из CaO и из CaO и 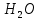 выделяется 33,26 кдж теплоты. Вычислите теплоту образования CaO, зная, что теплота образования выделяется 33,26 кдж теплоты. Вычислите теплоту образования CaO, зная, что теплота образования 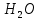 равна -285,91 кдж/моль. равна -285,91 кдж/моль.Ответ CaO (к)+ 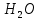 (ж)= (ж)=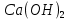 (к); (к); ΔH реакции = 33,26 кДЖ Вычислить теплоту образования оксида кальция , если: ΔH( 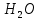 ) = -285,91 кДж/моль и ΔH ) = -285,91 кДж/моль и ΔH 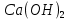 = -986 кДж/моль. = -986 кДж/моль.ΔHреакции = ΔHCa(OH)2 - (ΔHH2O + ΔHCaO) 33,26=-986-(-285,91+ 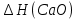 ) )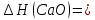 -733,35 -733,35Задание -102 Как изменится скорость реакции при понижении температуры от 100 ˚С до 40˚С, если температурный коэффициент реакции равен 2?ОтветЗависимость скорости химической реакции от температуры определяет правило Вант-Гоффа, которым мы воспользуемся при решении задачи. v2/v1 = γ∆t/10 |


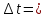
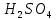 .
.