ВКР. ВКР Мерзоев. Актуальность исследования
 Скачать 127.99 Kb. Скачать 127.99 Kb.
|
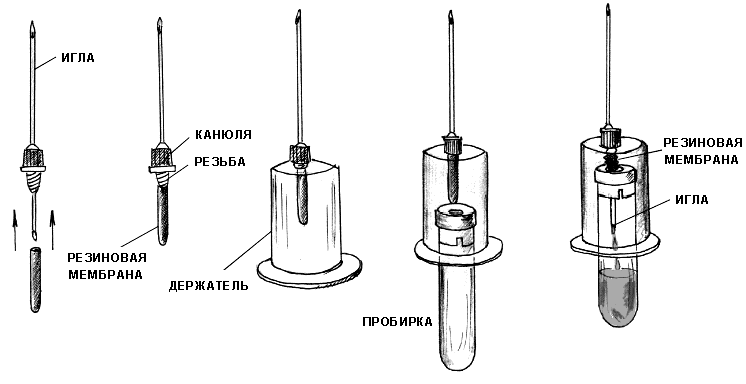 Рисунок 2.1 - Вакуумная система для взятия крови Для биохимических исследований производили забор крови в пробирки с литий-гепарином (с зелёным колпачком), а для клинических – с ЭДТА (сиреневый колпачёк). Цветная кодировка пробирок очень удобна, она сводит к минимуму вероятность ошибки. Преимущество в применении вакуумных систем для забора крови в сравнении с традиционными способами отбора крови состоит в следующем: безопасность и комфорт как для животного, так и для ветеринарного специалиста; менее выраженные болевые ощущения; вакуумные пробирки герметичны и не бьются; время процедуры – около 10 секунд – высокая производительность труда; надежная и простая маркировка пробирок; удобство при перевозке пробирок; отсутствие прямого контакта с кровью. Методика забора крови из яремной вены: Для взятия крови животное фиксировали в стойле. Вставлять иглу на границе, где происходит переход верхней трети шеи в среднюю. Первым делом необходимо вызвать достаточный уровень наполнения вены и минимизировать ее подвижность. Для этих целей рекомендуется сдавить вену при помощи резинового жгута либо пальцев. Во время прокола потребуется держать в руке шприц с иглой таким образом, чтобы направление иглы совпадало с линией хода прокалываемой вены. Необходимо следить за тем, чтобы срез иглы был направлен вверх, в сторону головы. Иглу стоит вставлять под углом от 20 до 30 градусов. Если игла попала в вену, то из нее начнет вытекать кровь. Перед тем как извлечь иглу из яремной вены коровы, стоит предварительно снять резиновый жгут, а вену пережать пальцами. Пережимать необходимо чуть выше того места, где находится игла. Иглу постепенно извлекают, а место укола рекомендуется некоторое время сдавливать ватным тампоном, что позволит предотвратить образование гематом на теле животного. В завершении процедуры место венепункции дезинфицируют спиртом либо настойкой йода и обрабатывают раствором «Коллодия». Клинический анализ крови. Определяли скорость оседания эритроцитов, содержание гемоглобина, количество эритроцитов и лейкоцитов в 1 мкл. крови и проводили определение лейкоцитарного профиля. Определение количества гемоглобина проводили с использованием гемометра Сали. Ход определения. В пустую пробирку гемометра, до деления 10, наливали 0,1 н. раствора соляной кислоты. Исследуемую кровь набирали в капиллярную пипетку до метки и вносили в пробирку с кислотой. После чего аккуратным втягиванием и выдуванием верхнего слоя кислоты промывали капиллярную пипетку от остатков крови. Кровь в пробирке тщательно перемешивали, ударяя пальцами по дну пробирки. После перемешивания пробу выдерживали 5 мин. Затем прибавляли небольшими порциями дистиллированную воду, до тех пор пока цвет разбавленной крови не сравнялся со цветом эталона. Цифра на уровне жидкости в пробирки с разбавленной пробой крови соответствует содержанию гемоглобина в г/л. Определение скорости оседания эритроцитов (СОЭ) методом Вестергрена. Ход определения. Смешивали 1,6 мл стабилизированной крови с 0,4 мл 3,8 % раствора лимоннокислого натрия. Затем пробу набирали в пробирку длинной 300 мм и 3 мм в диаметре. Пипетку заполняли до нулевой отметки и размещали вертикально в штативе. Определение производится по высоте столбика плазмы, образовавшегося за 1 час. Подсчёт форменных элементов крови (эритроцитов и лейкоцитов). Ход определения. Пробы крови в пробирках перемешивали. После чего набирали кровь в соответствующий смеситель до метки. Затем пробу крови разбавляли разводящей жидкостью. Для подсчёта эритроцитов применяли 0,9 % р-р поваренной соли, лейкоцитов – 3 % р-р уксусной кислоты с добавлением 1 % р-р генцианвиолета (1 мл на 100 мл р-ра уксусной кислоты). Разведённую пробу вносили в камеру Горяева и подсчитывали под микроскопом при увеличении 200-300 раз. Количество форменных элементов подсчитывали по формуле X = (A x 4000 x B) / Б, где Х – количество форменных элементов в 1 мм3; А – количество форменных элементов в определённом объёме камеры; Б – количество сосчитанных маленьких квадратов; В – разведение крови. Определение лейкоцитарного профиля. Ход определения. Готовили мазки крови на предметных стёклах. Мазки высушивали на воздухе и фиксировали в метаноле. Окраску мазков проводили иетодомРомановского-Гимзе. В сыворотке крови коров определяли уровень общего белка, содержание белковых фракций, мочевины, креатинина и иммуноглобулинов и кетоновых тел. Биохимические исследования проводили на автоматическом анализаторе IDEXX VetTest. Выбор данного прибора для проведения исследования объясняется простотой выполнения исследовательской процедуры и точностью результатов анализа. Пробо подготовка: Центрифугировали пробирки при 3000 об./мин. В течении 10 мин. После центрифугирования отбирали плазму для дальнейших исследований. Выполнение биохимических исследований: В меню анализатора VetTestвыберли команду «NEW SAMPLE» и, следуя подсказкам на экране введите информацию о пациенте. Выполнив запрос вставляли слайды для проведения анализа. Взяв дозатор из держателя надели на него новый пластиковый наконечник. Держа дозатор в вертикальном положении, путём нажатия на кнопку, отбирали образец плазмы для исследования. Во время проведения этой процедуры раздавался звуковой сигнал подтверждающий забор образца в наконечник. После 3-х сигналов - аккуратно, «скручивающим» движением протерали наконечник дозатора безворсовой салфеткой. Проверяли отобранный образец, чтобы убедиться в отсутствии воздушных пузырей. Помещали дозатор в держатель на анализаторе. Остальная часть анализа происходила автоматически. 5.2 Результаты исследований В послеотёльный период у животных как опытной, так и контрольной группы не было выявлено тяжёлых послеродовых осложнений (послеродовый парез, выпадение матки, послеродовая горячка и т.д.) сопровождающихся резким изменение общего состояния животного. У всех животных габитус, аппетит и темперамент соответствовал их физиологическому периоду. При проведении термометрии среди коров опытной группы повышение ректальной температуры до уровня 39,6 С0 и выше было зафиксировано у 3 животных. В контрольной группе лихорадка была выявлена у 4 животных. Всем животным с повышенной температурой были применены противомикробные жаропонижающие препараты согласно протоколов лечения острого послеродового метрита. Схема лечения острого послеотёльного метрита: 1. Эфикур (Цефтанит, Цефтиосан) 10,0 п/к 2. Айнил (Летайнил) 15,0 в/м 3. Окситоцин 5,0 в/м 4. Эндометромаг Т 200,0 внутриматочно. Продолжительность курса составляла 3 дня. Продолжительность периода повышенной температуры среди животных опытной группы составила у 2 голов – 2 дня, у 1 гол. – 3 дня. Контрольной группы – 1 животное – 1 день, 1 – 2 дня, 2 – 3 дня. Чаще повышение температуры фиксировали в период 3-5 сутки после отёла (Рисунок 2.2 и Рисунок 2.3). 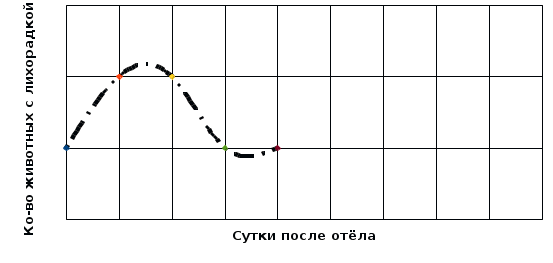 Рисунок 2.2 - Количество коров опытной группы с повышенной температурой 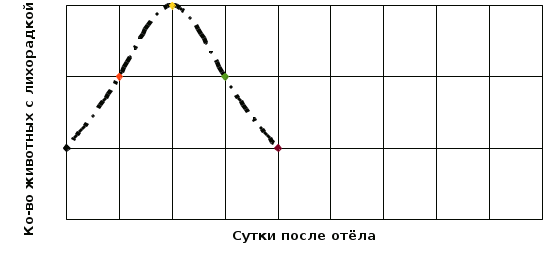 Рисунок 2.3 - Количество коров контрольной группы с повышенной температурой Результаты ректальных исследований. При проведении ректальных исследований на 10 день было выявлено по 2 коровы, в опытной и контрольных группах, с признаками острого метрита: матка увеличена, стенки её напряжённые, при массаже матки – выделяется обильный геморрагический экссудат. Больным животным было назначено следующее лечение: 1. Эфикур (Цефтанит, Цефтиосан) 10,0 п/к 2. Айнил (Летайнил) 15,0 в/м 3. Эндометромаг Био 200,0 внутриматочно. Ректальными исследования проводимыми на 30 день была выявлена одна корова с признаками эндометрита из животных контрольной группы: матка увеличена, стенки её напряжённые, при массаже матки – умеренное выделение гнойно-катарального экссудата. Проведено лечение: 1. Внутриматочно ввели «Метрикур» 1 дозу. 2. Внутримышечно «Эстрофан» 3,0. Результаты биохимических исследований. В контрольной и опытной группах коров содержание общего белка в плазме крови находилось в пределах нормы, но в контрольной группе содержание белка было на 1,82 % выше (Таблица 2.1). При анализе белковых фракций установлено повышенное содержание глобулинов в плазме крови животных обеих групп, при снижении уровня альбуминовой фракции. Таблица 2.1 Результаты биохимических исследований в плазме крови
* р ˂ 0,05 Увеличение уровня глобулинов мы связываем с повышением содержания иммуноглобулинов. Так, в сыворотке крови повышалось содержание иммуноглобулинов на 2,86%. Это можно объяснить воспалительными процессами в половой системе коров, в результате чего уровень их в плазме крови повышается у больных животных в ответ на наличие и развитие микроорганизмов в матке. В контрольной и опытной группе коров наблюдается повышение содержания всех трех фракций глобулина и снижение уровня альбумина. По этой причине в исследуемых образцах, как опытной, так и контрольной группы наблюдается нарушение соотношения альбуминовой и глобулиновой фракций. В опытной группе уровень глобулиновой фракции на 5,12 % ниже, чем в контроле. Снижение содержания альбумина в плазме крови новотельных коров можно объяснить как нарушением работы печени, так может быть и следствием всасывания токсических продуктов из очага воспаления в кровь. Увеличение количества α-глобулинов имеет место при острых воспалительных процессах и при обострении болезней с хроническим течением. Увеличение количества β-глобулинов имеет место при хронических воспалительных процессах и токсическом поражении печени. Рост же количества γ-глобулинов объясняется токсическим поражением печени, длительным течением септического процесса и иммунологической реакцией организма коров на наличие бактериальной инфекции в организме. В связи с увеличением общего содержания глобулинов и снижением альбумина происходит снижение отношения альбумин / глобулин соответственно на 7,27% по сравнению с контрольной группой (Р <0,05) по сравнению с контрольной группой. В сыворотке крови всегда содержится мочевина как следствие дезаминирования аминокислот в печени. В опытной группе коров увеличение мочевины составило 23,10%. Рост уровня мочевины в крови больных коров может свидетельствовать о нарушении функции почек, которыми она выводится из организма или об усиленное образование ее в печени при разрушении белка вследствие энергетического дефицита. Следующий критерий, по которому можно судить о состоянии белкового обмена - креатинина. В контрольной группе наблюдали увеличение его уровня в сыворотке крови по сравнению с опытом на 2,85 %, что можно объяснить почечной недостаточностью и нарушением проходимости мочевыводящих путей, которые возможны при воспалительных процессах в половых органах животных. Во всех группах животных уровень АЛТ и АСТ не превышает физиологическую норму. В контрольной группе коров активность АЛТ в сыворотке крови снизилась на 6,06%, а АсАТ - на 9,38%. По результатам контрольной дойки, проведённой на 30 день после отела, была зафиксирована большая молочная продуктивность животных опытной группы. Разница суточного надоя составила 1,3 л (6,7 %). Снижение уровня производительности у коров контрольной группы свидетельствует о субклинических воспалительных процессах и об их негативном влиянии на продуктивность при несвоевременном или недостаточно эффективном диагностике и лечении. Результаты клинических исследований крови. Показатели красных клеток крови животных обеих групп находятся в пределах физиологической нормы (Таблица 2.2). Отмечается умеренный лейкоцитоз в крови животных опытной и контрольной групп. Это объясняется как воспалительными процессами в половых органах новотельных животных, так и перестройкой иммунной системы животных после отёла. У животных группы контроля среднее содержание лейкоцитов в крови на 5,0 % превышало этот показатель в опытной группе. Также наблюдается повышение скорости оседания эритроцитов в крови животных обеих групп, что также указывает на воспалительные процессы, протекающие в организмах животных. Таблица 2.2 Клинические показатели крови животных контрольной и опытной групп
|
