алканы. Конспект урока по химии на тему _Алкадиены_ (10 класс).. Алкадиены (диолефины). 10 класс
 Скачать 45.99 Kb. Скачать 45.99 Kb.
|
|
Тема: Алкадиены (диолефины). 10 класс Цели уроков: - расширить знания учащихся об углеводородах - дать понятие о непредельных углеводородах, их классификации; - познакомить учащихся с особенностями строения алкадиенов, способами образования δ- и π-связей; - знать общую формулу алкадиенов, физические и химические свойства, способы получения и области применения алкадиенов; - уметь записывать молекулярные, структурные и электронные формулы алкадиенов, обозначать распределение электронной плотности в молекуле; - уметь называть вещества класса алкадиенов по систематической номенклатуре и по названию записывать формулы; - знать четыре вида изомерии для алкадиенов, уметь составлять формулы различных изомеров, называть их; - уметь доказывать химические свойства алкадиенов, записывать уравнения реакций, уметь их сравнивать со свойствами алканов и алкенов; Ход урока: I. Изучение нового материала. Алкадиены – органические соединения, углеводороды алифатического (ациклического) непредельного характера, в молекуле которых между атомами углерода – две двойные связи, и которые соответствуют общей формуле: CnH2n-2, где n =3 или n >3 1 2 3 4 CH2 == CH –– CH == CH2 бутадиен - 1,3Для алкенов характерна sp2-гибридизация. У бутадиена-1,3 у четырех негибридных p-электронов образуется общее π -электронное облако, в результате чего происходит делокализация двойных связей в молекуле, связи между молекулами C1 и C2, C3 и C4 удлиняются (по сравнению с двойной связью – 0,134 нм), а связь между C2 и C3 укорачивается (по сравнению с одинарной связью – 0,154 нм): 1 2 3 4 CH2 = = = CH = = = CH = = = CH2 0,136нм 0,146 нм 0,136 нм Такая особенность строения называется эффектом сопряжения двойных связей и определяет реакционную способность алкадиенов. В названии алкенов содержится суффикс –диен («две» «двойные связи»), обозначающий принадлежность соединения к данному классу. Классификация алкадиенов:
В определении названия алкадиена (как и у всех непредельных углеводородов) положение кратной связи имеет при нумерации преимущество перед остальными. Для алкадиенов характерны следующие виды изомерии: Структурная изомерия: а) изомерия углеродного скелета 1 2 3 4 5 1 2 3 4 CH2 = CH – CH = CH – CH3 CH2= C – CH = CH2 | CH3 пентадиен-1,3 2-метилбутадиен-1,3 (изопрен) б) изомерия положения кратной связи 1 2 3 4 5 1 2 3 4 5 CH2=CH – CH = CH – CH3 CH3–CH = C = CH – CH3 пентадиен-1,3 пентадиен-2,3 в) изомерия положения заместителей (Hal, - NO2, SO2-OH и др.) 1 2 3 4 5 1 2 3 4 5 CH2=CH – C = CH – CH3 CH2=CH – CH = C – CH3 | | Cl Cl 3-хлорпентадиен-1,3 4-хлорпентадиен-1,3 Пространственная изомерия: а) геометрическая изомерия 5 4 3 2 1 CH3 – CH = C – CH = CH2 | CH3 3-метилпентадиен-1,3 CH3 CH3 H CH3 \ / \ / C = C H C = C H / \ / / \ / H C = C CH3 C = C / \ / \ H H H H цис-изомер транс-изомер Межклассовая изомерия (с циклоалкенами и алкинами) 1 2 3 4 5 CH2=CH – CH = CH – CH3 CH = CH пентадиен-1,3 | | CH2 CH2 CH ≡ C – CH2 – CH2 – CH3 \ / CH2 пентин-1 циклопентен Физические свойства. Бутадиен-1,3 и пропадиен – газы; 2-метилбутадиен-1,3 - летучая жидкость; алкадиены с изолированными двойными связями – жидкости; высшие алкадиены – твердые вещества. Химические свойства. Химические свойства алкадиенов с изолированными связями протекают так же, как и у алкенов – только в два этапа, а у алкадиенов с сопряженными связями - с некоторыми особенностями: способность присоединять молекулы как в положения 1 и 2 (подобно алкадиенам с изолированными связями – 1,2-присоединение), так и в положении 1 и 4 (перераспределение двойной связи – 1,4-присоединение) – зависит от условий и способа проведения реакций. Реакции присоединения Гидрирование а) с изолированными связями 1 2 3 4 5 5 4 3 2 1 CH2=CH – CH2 – CH = CH2 + H – H à CH3 – CH2 – CH2 – CH = CH2 пентадиен-1,4 пентен-1 5 4 3 2 1 CH3 – CH2 – CH2 – CH = CH2 + H – H à CH3 – CH2 – CH2 – CH2 – CH3 пентен-1 пентан б) с сопряженными связями 1 2 3 4 5 1 2 3 4 5 CH2 = CH – CH = CH – CH3 + H – H à CH3 – CH = CH – CH2 – CH3 пентадиен-1,3 пентен-2 1 2 3 4 5 CH3 – CH = CH – CH2 – CH3 + H – H à CH3 – CH2 – CH2 – CH2 – CH3 пентен-2 пентан Галогенирование а) с изолированными связями 1 2 3 4 5 5 4 3 2 1 CH2=CH – CH2 – CH = CH2 + Br – Br à CH2Br – CHBr – CH2 – CH = CH2 пентадиен-1,4 4.5-дибромпентен-1 5 4 3 2 1 5 4 3 2 1 CH2Br – CHBr – CH2 – CH = CH2 + Br – Br à CH2Br – CHBr – CH2 – CHBr – CH2Br 4,5-дибромпентен-1 1,2,4,5-тетрабромпентан б) с сопряженными связями 1 2 3 4 5 1 2 3 4 5 CH2 = CH – CH = CH – CH3 + Br – Br à CH2Br – CH = CH – CHBr – CH3 пентадиен-1,3 1.4-дибромпентен-2 1 2 3 4 5 1 2 3 4 5 CH2Br – CH = CH – CHBr – CH3 + Br – Br à CH2Br – CHBr – CHBr – CHBr – CH3 1,4-дибромпентен-2 1,2,3,4-тетрабромпентан 3. Гидрогалогенирование (по правилу Марковникова: при присоединении веществ с полярной ковалентной связью типа HX (где X – это -Hal, -OH и т.д.) к несимметричным непредельным углеводородам по месту разрыва П-связи атом водорода присоединяется к наиболее гидрированному атому углерода, а X – к наименее гидрированному атому углерода) а) с изолированными связями 1 2 3 4 5 5 4 3 2 1 CH2=CH – CH2 – CH = CH2 + H – Br à CH3 – CHBr – CH2 – CH = CH2 пентадиен-1,4 4-бромпентен-1 5 4 3 2 1 5 4 3 2 1 CH3 – CHBr – CH2 – CH = CH2 + H – Br à CH3 – CHBr – CH2 – CHBr – CH3 4-бромпентен-1 2,4-дибромпентан б) с сопряженными связями 1 2 3 4 5 1 2 3 4 5 CH2 = CH – CH = CH – CH3 + H – Br à CH3 – CH = CH – CHBr – CH3 пентадиен-1,3 4-бромпентен-2 1 2 3 4 5 5 4 3 2 1 CH3 – CH = CH – CHBr – CH3 + H – Br à CH3 – CH2 – CHBr – CHBr – CH3 4-бромпентен-2 2,3-дибромпентан 5 4 3 2 1 à CH3 – CHBr – CH2 – CHBr – CH3 2,4-дибромпентан 4. Гидратация (по правилу Марковникова). а) с изолированными связями 1 2 3 4 5 5 4 3 2 1 CH2=CH – CH2 – CH = CH2 + H – OH à CH3 – CH OH – CH2 – CH = CH2 пентадиен-1,4 пентен-1ол-4 5 4 3 2 1 5 4 3 2 1 CH3 – CH OH – CH2 – CH = CH2 + H – OH à CH3 – CH OH – CH2 – CH OH – CH3 пентен-1ол-4 пентандиол-2,4 б) с сопряженными связями 1 2 3 4 5 1 2 3 4 5 CH2 = CH – CH = CH – CH3 + H – OH à CH3 – CH = CH – CH OH – CH3 пентадиен-1,3 пентен-2ол-4 1 2 3 4 5 5 4 3 2 1 CH3 – CH = CH – CH OH – CH3 + H – OH à CH3 – CH2 – CH OH – CH OH – CH3 пентен-2ол-4 пентандиол-2,3 5 4 3 2 1 à CH3 – CH OH – CH2 – CH OH – CH3 пентандиол-2,4 5. Сульфирование (по правилу Марковникова). а) с изолированными связями 1 2 3 4 5 5 4 3 2 1 CH2=CH – CH2 – CH = CH2 + H – O-SO2-OH à CH3 – CH – CH2 – CH = CH2 | O-SO2-OH 5 4 3 2 1 5 4 3 2 1 CH3 – CH – CH2 – CH = CH2 + H – O-SO2-OH à CH3 – CH – CH2 – CH – CH3 I | | O-SO2-OH O-SO2-OH O-SO2-OH б) с сопряженными связями 1 2 3 4 5 1 2 3 4 5 CH2 = CH – CH = CH – CH3 + H – O-SO2-OH à CH3 – CH = CH – CH – CH3 | O-SO2-OH 1 2 3 4 5 5 4 3 2 1 C 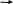 H3 – CH = CH – CH – CH3 + H – O-SO2-OH à CH3 – CH2 – CH – CH – CH3 H3 – CH = CH – CH – CH3 + H – O-SO2-OH à CH3 – CH2 – CH – CH – CH3 | | | O-SO2-OH HO-2OS-O O-SO2-OH 5 4 3 2 1 CH3 – CH – CH2 – CH – CH3 | | O-SO2-OH O-SO2-OH 6. Алкилирование (смесь различных продуктов): 1 2 3 4 6 5 4 3 2 1 CH3 – CH3 + CH2=C – CH = CH2 à CH3 – CH2 – CH2 – CH – CH = CH2 | | CH3 CH3 этан 3-метилбутадиен-1,3 2 - метилгексен-1 6 5 4 3 2 1 1 2 3 4 5 6 7 8 CH3 –CH2 –CH2 –CH –CH=CH2 + CH3–CH3 à CH3 –CH2 –CH2 –CH –CH2 –CH2 –CH2 –CH3 | | CH3 CH3 3-метилгексен-1 этан 4-метилоктан 7. Взаимное алкилирование, при разных температурах образуются разные соединения, например: 1 2 3 4 1 2 3 4 1 2 3 4 5 6 7 8 CH2=CH–CH=CH2 + CH2=CH–CH=CH2 à CH2=CH–CH=CH – CH2–CH2–CH=CH2 бутадиен-1,3 октатриен-1,3,7 Реакции окисления. Горение. t0 2C4H6 + 11 O2 (избыток) à 8 CO2 + 6 H2O t0 2C4H6 + 7 O2 (недостаток) à 8 CO + 6 H2O t0 2C4H6 + 3 O2 (сильный недостаток) à 8 C + 6 H2O Частичное окисление кислородом воздуха с образованием эпоксидов и диэпоксидов. t0, Kt 2 CH2=CH – CH = CH2 + O2 ––à CH2 – CH – CH = CH2 \ / O эпоксибутен-1 (или окись бутена-1) t0, Kt 2 CH2 – CH – CH = CH2 + O2 ––à CH2 – CH – CH – CH2 \ / \ / \ / O O O диэпоксибутан (или диокись бутана) Окисление кислородом окислителя в щелочной среде. из KMnO4 4 3 2 1 CH2=CH – CH = CH2 + [O] + H – OH ––––––––à CH2– CH – CH = CH2 | | OH OH (бутен-1диол-1,2) из KMnO4 4 3 2 1 CH2 –CH – CH = CH2 + [O] + H – OH ––––––––à CH2– CH – CH – CH2 | | | | | | OH OH OH OH OH OH (бутантетраол-1,2,3,4) Обесцвечивание щелочного раствора KMnO4 – это качественная реакция на непредельные углеводороды. Реакции полимеризации. t0, kt n CH2 = CH – CH=CH2 ––––––– à (– CH2 – CH = CH – CH2 –)n бутадиен-1,3 бутадиеновый каучук H H H CH2 – \ / \ / C = C C = C / \ / \ – H2C CH2 – – H2C H цис-конфигурация транс-конфигурация VI. Получение. 1. Метод Лебедева (1932г.) – дегидратация и дегидрирование 450oC, Al2O3, ZnO 2 CH3 – CH2 – OH ––––––––––––––––à CH2=CH – CH = CH2 + H2O + H2 этанол бутадиен-1,3 2. Способ дегидрирования. 500-600⁰C, Kt CH3– CH2 – CH2 – CH3 –––––––––––à CH2=CH – CH = CH2 + H2 н-бутан бутадиен-1,3 (проходит в две стадии) 500-600⁰C, Kt CH3– CH – CH2 – CH3 –––––––––––à CH2=CH – CH = CH2 + H2 | | CH3 CH3 2-метилбутан 2-метилбутадиен-1,3 (изопрен) 500-600⁰C, MgO, ZnO CH2 = CH – CH2 – CH3 ––––––––––––––––à CH2=CH – CH = CH2 + H2 бутен-1 бутадиен-1,3 3. Способ дегидрогалогенирования дигалогенпроизводного алкана. Br Br | | спирт, to CH2 – CH2 – CH2 – CH2 + 2 KOH –––––––à CH3 = CH – CH = CH3 + 2 KBr + 2 H2O 1,4-дибромбутан бутадиен-1,3 Br Br | | спирт, to CH2 – CH2 – CH – CH3 + 2 KOH –––––––à CH3 = CH – CH = CH3 + 2 KBr + 2 H2O 1,3-дибромбутан бутадиен-1,3 (При использовании 2,3-дибромбутана или 2,2-дибромпропана – образуются соответствующие алкины) VI. Применение. Диеновые углеводороды применяются в производстве синтетических каучуков, из которых в том числе делают и резину (Приложение 1-2). II. Закрепление знаний, умений и навыков Домашние задания: §14 (с.112-118); записи в тетради; упражнения 4 и 5 (с.120) – письменно; задачи 6 (с.120). Приложение 1 « Знакомство европейцев с каучуком». Каучук существует столько лет, сколько и сама природа. Окаменелые остатки каучуконосных деревьев, которые были найдены, имеют возраст около трёх миллионов лет. Каучук на языке индейцев тупи-гуарани означает «слёзы дерева» («кау» – дерево, «учу» – плакать, течь). Каучуковые шары из сырой резины найдены среди руин цивилизаций инков и майя в Центральной и Южной Америке, возраст этих шаров не менее 900 лет. Первое знакомство европейцев с натуральным каучуком произошло почти пять веков назад. Собственно, история каучука началась, как ни странно, с детского мячика и школьной резинки. В 1493 году корабль Христофора Колумба во время второго путешествия в Америку пристал к острову, названному именем Эспаньола (Гаити). Высадившись на берег, испанцы были удивлены весёлой игрой индейцев, похожей на наш баскетбол. Они в такт песне подбрасывали чёрные шары, которые, упав на землю, делали, словно живые, высокие и забавные прыжки. Взяв эти шары в руки, испанцы нашли, что они довольно тяжелы, липки и пахнут дымом. Индейцы скатывали их из загустевшего млечного сока, вытекавшего из порезов на коре дерева гевеи. Колумб привёз несколько кусков этого удивительного вещества на родину, но в те времена он никого не заинтересовал. Индейцы делали из него непромокаемые калоши, которые в жару прилипали к ногам, а, растянувшись, больше уже не сжимались. Много лет испанцы пытались повторить водонепроницаемые вещи (обувь, одежду, головные уборы) индейцев, но все попытки были неудачными. Первые попытки сделать каучуковую обувь вызывали только смех. Галоши или сапоги хорошо служили в дождь, но стоило выглянуть и припечь солнцу, как они растягивались, начинали прилипать. В мороз же такая обувь становилась хрупкой, как стекло. Следующие два века каучук для Европы был просто любопытной заморской диковинкой. В 1731 году правительство Франции отправило математика и географа Шарля Кондамина в географическую экспедицию по Южной Америке. В 1736 он отправил обратно во Францию несколько образцов каучука вместе с описанием продукции, производимой из него людьми, населяющими Амазонскую низменность. После этого резко возрос научный интерес к изучению этого вещества и его свойств. В 1770 году британский химик Джозеф Пристли впервые нашёл ему применение: он обнаружил, что каучук может стирать то, что написано графитовым карандашом. Тогда такие куски каучука называли гуммиластиком («смолой эластичной»). В 1791 году английский фабрикант Самуэль Пил запатентовал способ сделать одежду водонепроницаемой с помощью обработки её раствором каучука в скипидаре. Во Франции к 1820 г. научились изготовлять подтяжки и подвязки из каучуковых нитей, сплетённых с тканью. В Англии британский химик и изобретатель Чарльз Макинтош пропитал каучуком плотную материю, и она стала непромокаемой. Так появились первые плащи-макинтоши, а потом и первые галоши, и сумки для перевозки почты. Правда, потом стал очевиден большой недостаток всей этой продукции, делавший ее совершенно непригодной: в сильную жару материал становился слишком мягким, а в холодную погоду затвердевал, как камень. В США вещи из каучука стали популярными в 1830-х годах, резиновые бутылки и обувь, сделанные южноамериканскими индейцами, импортировались в больших количествах. Другие резиновые изделия завозились из Англии, а в 1832 году в городе Роксбери штата Массачусетс Джон Хаскинс и Эдвард Шафе организовали первую «каучуковую» фабрику в США. Открытие в 1839 году резины, полученной от нагревания каучука и серы, привело к широкому её применению. Внимание капиталистов всех стран обратилось на добычу каучука. Бразилия оказалась владетельницей громадных богатств. Чтобы сохранить их, правительство Бразилии издало закон, запрещающий под страхом смерти вывоз семян и молодых деревьев гевеи. Но было поздно. По совету ботаника Дж. Гукера, англичанин Викгем поехал в 1876 году на берега Амазонки, где собрал 70000 семян Гевеи и тайком доставил их в ботанический сад в Кью. Семена были высеяны, но взошло только 4%. Однако через несколько дней сеянцы достигли полуметровой высоты. Затем они были отправлены на остров Цейлон, а оттуда разосланы на Яву, в Бирму, Австралию и др. В нашей стране не было известно природных источников для получения натурального каучука, а из других стран каучук к нам не завозился. Впервые в промышленных масштабах синтетический каучук был получен выдающимся русским ученым С.В Лебедевым. «История открытия вулканизации резины». История открытия Чарльзом Гудийром вулканизации резины – одна из самых запутанных и непостижимых историй. Этот человек не имел права на успех. Он не обладал нужными знаниями и подготовкой. Он сталкивался с трудностями, перед которыми спасовал бы любой другой. Часто он даже не знал, чего добивался. Гудийр начал опыты с бразильской эластичной смолой, изготовляя дома тонкие пленки при помощи скалки для теста. Он смешивал сырую смолу с любым попадавшимся под руку веществом: солью, перцем, сахаром, песком, касторовым маслом, даже с супом – следуя великолепному логическому заключению, что рано или поздно он перепробует все, что есть на земле, и наконец наткнется на удачное сочетание. Житель Нью-Хэвена Ральф Стил одолжил Гудийру денег, и тот открыл на них лавку. На полках красовались сотни пар галош. Но в первый же жаркий день они растаяли и превратились в дурно пахнущее месиво. Гудийр закрыл свою лавку и занялся опытами, смешивая с резиновой смолой множество веществ: орешник, сыр, чернила и все это никуда не годилось, за исключением магнезии. Когда он смещал фунт магнезии с фунтом резиновой смолы, получился материал белее резиновой смолы и гибкий и прочный, как кожа. Он изготовил из него обложки для книг, чехлы для роялей, показал публике, получил горячее одобрение, смеялся от радости – и через месяц убедился, что его вновь постигла полная неудача. В то время Гудийр думал, что его рецепт с магнезией можно еще как-то усовершенствовать. Он кипятил смесь смолы и магнезии в водном растворе негашеной извести и получал пласты резины, которая была гораздо глаже и прочнее прежней. Газеты восхваляли его как человека, спасшего резиновую промышленность. Но через три недели Гудийр обнаружил, что одной капли самой слабой кислоты – даже яблочного сока – было достаточно, чтобы нейтрализовать негашеную известь и разрушить материал. Многократные опыты требовали денег, и в итоге исследователь оказался в долговой тюрьме; именно там, продолжая опыты, он обнаружил, что липкость исчезает, если посыпать каучук серой и высушить его. Уже выйдя из тюрьмы, Гудийр, опять же по рассеянности, положил кусочек каучука с серой не на стол, а на горячую плиту. Ошибка оказалась открытием, потому что на плите Гудийр обнаружил не липкую смесь, а сухой мягкий упругий кусок… уже резины. Под действием серы при умеренном нагревании каучук приобретал большую прочность, твердость, становился менее чувствительным к переменам температуры. Процесс назвали вулканизацией, а вулканизированный каучук – резиной. Вот как описывала первые испытания нового материала дочь Гудийра: «Я случайно увидела, что отец держит у огня маленький кусочек резины, и заметила, что в тот день он был необычайно взволнован каким-то открытием. Он вышел из дома и прибил кусок гвоздем к стене. Стояли сильные холода. На следующее утро отец принес этот кусочек в дом и торжествующе поднял его над головой. Резина была такой же гибкой, как и раньше. Это доказывало ценность открытия». Вулканизация резины послужила толчком для развития электропромышленности, так как резина является прекрасным материалом для изоляции. Еще при жизни Гудийра в Соединенных Штатах, Англии, Франции и Германии выросли корпуса огромных фабрик, на которых работало более шестидесяти тысяч человек и изготовлялось пятьсот видов различных резиновых изделий, в общей сложности на 8 миллионов долларов в год. Окрыленный успехом, Гудийр стал тратить больше, чем зарабатывал. Он умер в 1860 году, оставив после себя двести тысяч долларов долгу, но друзья уже не считали его сумасшедшим. «Гудйер Тайр энд Раббер» (Goodyear Tyre and Rubber), резинотехническая фирма США. Основана в 1898. Главный производитель синтетического каучука в США, выпускает также военную продукцию; 1-е место в мире по производству шин. |
