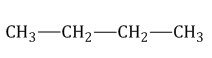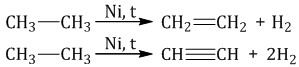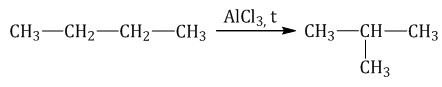алканы. Алканы. Алканы Алканы это предельные углеводороды, содержащие только одинарные связи между атомами СС в молекуле, т е. содержащие максимальное количество водорода. Гомологический ряд алканов
 Скачать 364.25 Kb. Скачать 364.25 Kb.
|
|
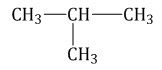
Алканы Алканы – это предельные углеводороды, содержащие только одинарные связи между атомами С–С в молекуле, т.е. содержащие максимальное количество водорода. Гомологический ряд алканов Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом. Самый первый представитель гомологического ряда алканов – метан CH4. , или Н–СH2–H. Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана. Общая формула гомологического ряда алканов CnH2n+2. Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества. Все алканы легче воды, не растворимы в воде и не смешиваются с ней. Строение алканов В молекулах алканов встречаются химические связи C–H и С–С. Связь C–H ковалентная слабополярная, связь С–С – ковалентная неполярная. Это одинарные σ-связи. Атомы углерода в алканах образуют по четыре σ-связи. Следовательно, гибридизация атомов углерода в молекулах алканов – sp3: 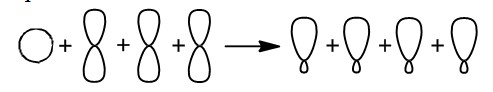 При образовании связи С–С происходит перекрывание sp3-гибридных орбиталей атомов углерода:  При образовании связи С–H происходит перекрывание sp3-гибридной орбитали атома углерода и s-орбитали атома водорода:  Четыре sp3-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным. Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109о 28′ друг к другу: 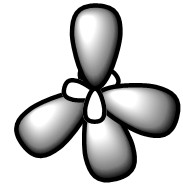 Это соответствует тетраэдрическому строению молекулы.
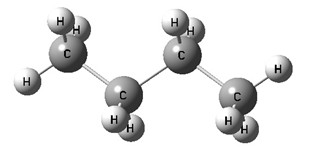
 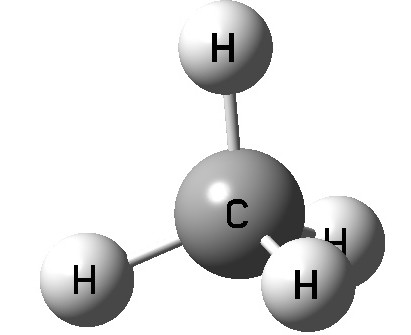 Молекулам линейных алканов с большим числом атомов углерода соответствует зигзагообразное расположение атомов углерода.
 Изомерия алканов Структурная изомерия Для алканов характерна структурная изомерия – изомерия углеродного скелета. Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул. Изомеры углеродного скелета отличаются строением углеродного скелета.
С увеличением числа атомов углерода в молекуле увеличивается количество изомеров, соответствующих данной формуле. Количество изомеров в ряду алканов:
Оптическая изомерия Если атом углерода в молекуле связан с четырьмя различными заместителями (атомами или атомными группами), например: 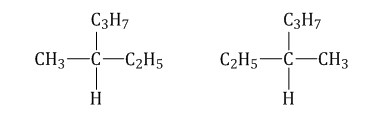 то возможно существование двух соединений с одинаковой структурой, но различным пространственным строением.Молекулы таких соединений относятся друг к другу, как зеркальные изображение и предмет. При этом никаким вращением нельзя получить одну молекулу из другой. 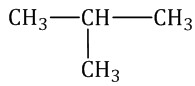 Номенклатура алканов Номенклатура алкановВ названиях алканов используется суффикс -АН.
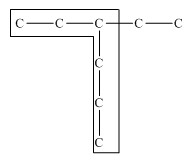
Для простейших алканов (метан, этан, пропан, бутан и изобутан) используют тривиальные названия. Начиная с пятиатомного углероводорода, в названии неразветвленных (нормальных) алканов используют корень, который показывает число атомов углерода в молекуле, и добавляют соответствующий суффикс (для алканов – ан, для алкенов – ен, и т.д.). Название разветвленных алканов строится по следующим правилам: 1. Выбирают главную углеродную цепь. При этом считают, что углеводородные радикалы, которые не входят в главной цепь, являются в ней заместителями. При этом главная цепь должна быть самой длинной. Например, в молекуле на рисунке главной является цепь, отмеченная на рисунке а:
Главная цепь должна быть самой разветвленной. Например, в молекуле, изображенной на рисунках а и б, выделены цепи с одинаковым числом атомов углерода. Но главной будет цепь, изображенная на рисунке а, т.к. от нее отходит 2 заместителя, а от цепи на рисунке б – только один:
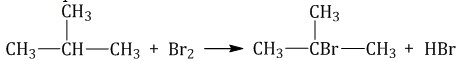
2. Нумеруют атомы углерода в главной цепи так, чтобы атомы углерода, которые соединены с заместителями, получили минимальные возможные номера. Причем нумерацию следует начинать с более близкого к старшей группе конца цепи. 3. Называют все радикалы, указывая впереди цифры, которые обозначают их расположение в главной цепи. Например, 2-метилпропан:  Для одинаковых заместителей эти цифры указывают через запятую, при этом количество одинаковых заместителей обозначается приставками ди- (два), три- (три), тетра- (четыре), пента- (пять) и т.д. Например, 2,2-диметилпропан или 2,2,3-триметилпентан. 4. Названия заместителей со всеми приставками и цифрами располагают в алфавитном порядке. Например: 2,2-диметил-3-этилпентан. 5. Называют главную углеродную цепь, т.е. соответствующий нормальный алкан. Например, название молекулы на рисунке:  2,2,4-триметил-4-этилгексан Химические свойства алканов Алканы– предельные углеводороды, поэтому они не могут вступать в реакции присоединения. Для предельных углеводородов характерны реакции: разложения, замещения, окисления. Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов. Поэтому для алканов характерны только радикальные реакции. Алканы устойчивы к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагируют с концентрированными кислотами, щелочами, бромной водой. 1. Реакции замещения В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С. 1.1. Галогенирование Алканы реагируют с хлором и бромом на свету или при нагревании. При хлорировании метана сначала образуется хлорметан: 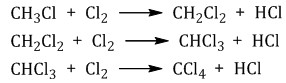
При хлорировании алканов с углеродным скелетом, содержащим более 3 атомов углерода, образуется смесь хлорпроизводных.
Бромирование протекает более медленно и избирательно.
Реакции замещения в алканах протекают по свободнорадикальному механизму. Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон. Первая стадия. Инициирование цепи. Под действием кванта света или при нагревании молекула галогена разрывается на два радикала: Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом. Вторая стадия. Развитие цепи. Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород. При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора: 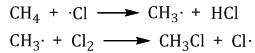 Третья стадия. Обрыв цепи. При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается. Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала: 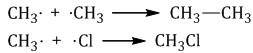 1.2. Нитрование алканов Алканы взаимодействуют с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140оС и под давлением. Атом водорода в алкане замещается на нитрогруппу NO2. При этом процесс протекает также избирательно. С третичный–Н > С вторичный–Н > С первичный–Н
2. Реакции разложения 2.1. Дегирирование и дегидроциклизация Дегидрирование – это реакция отщепления атомов водорода. В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др. Уравнение дегидрирования алканов в общем виде: CnH2n+2 → CnH2n-х + (х+1)H2 При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
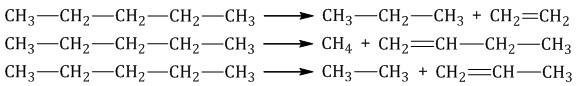
При дегидрировании бутана под действием металлических катализаторов образуется смесь продуктов. Преимущественно образуется бутен-2: Если бутан нагревать в присутствии оксида хрома (III), преимущественно образуется бутадиен-1,3: Алканы с более длинным углеродным скелетом, содержащие 5 и более атомов углерода в главной цепи, при дегидрировании образуют циклические соединения. При этом протекает дегидроциклизация – процесс отщепления водорода с образованием замкнутого цикла. Пентан и его гомологи, содержащие пять атомов углерода в главной цепи, при нагревании над платиновым катализатором образуют циклопентан и его гомологи: 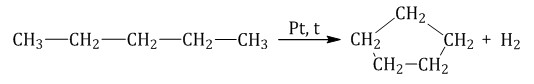 Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды. Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол: 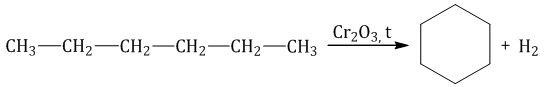 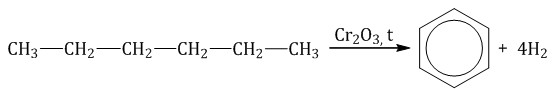 Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол: 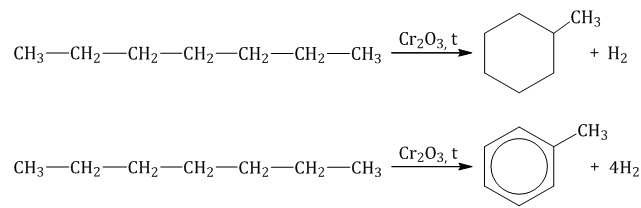 2.2. Пиролиз (дегидрирование) метана При медленном и длительном нагревании до 1500оС метан разлагается до простых веществ: Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен: Пиролиз метана – промышленный способ получения ацетилена. 2.3. Крекинг Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы с более короткой углеродной цепью и алкены. Крекинг бывает термический и каталитический. Термический крекинг протекает при сильном нагревании без доступа воздуха. При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.
Каталитический крекинг проводят при более низкой температуре в присутствии катализаторов. Процесс сопровождается реакциями изомеризации и дегидрирования. Катализаторы каталитического крекинга – цеолиты (алюмосиликаты кальция, натрия). 3. Реакции окисления алканов Алканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.). 3.1. Полное окисление – горение Алканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты. CH4 + 2O2 → CO2 + 2H2O + Q Уравнение сгорания алканов в общем виде: CnH2n+2 + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С. Например, горение пропана в недостатке кислорода: 2C3H8 + 7O2 → 6CO + 8H2O Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода: CH4 + O2 → C + 2H2O Эта реакция используется для получения сажи. 3.2. Каталитическое окисление Каталитическое окисление бутана – промышленный способ получения уксусной кислоты: При каталитическом окислении метана кислородом возможно образование различных продуктов в зависимости от условий проведения процесса и катализатора. Возможно образование метанола, муравьиного альдегида или муравьиной кислоты: 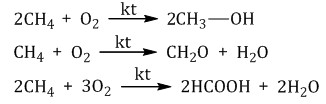 Важное значение в промышленности имеет паровая конверсия метана: окисление метана водяным паром при высокой температуре. Продукт реакции – так называемый «синтез-газ». 4. Изомеризация алканов Под действием катализатора и при нагревании неразветвленные алканы, содержащие не менее четырех атомов углерода в основной цепи, могут превращаться в более разветвленные алканы.
Получение алканов 1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца) Это один из лабораторных способов получения алканов. При этом происходит удвоение углеродного скелета.
Реакция больше подходит для получения симметричных алканов. При проведении синтеза со смесью разных галогеналканов образуется смесь разных алканов.
2. Электролиз солей карбоновых кислот (электролиз по Кольбе) Это электролиз водных растворов солей карбоновых кислот. В общем виде: 2R–COONa + 2H2O → H2 + 2NaOH + 2CO2 + R–R В водном растворе ацетат натрия практически полностью диссоциирует: CH3COONa → CH3COO– + Na+ При этом на катод притягиваются катионы натрия Na+ и молекулы воды H2O. Разряжаться на катоде будут молекулы воды: Kатод(-): 2H2O + 2e = H2 + 2OH– На аноде окисляются ацетат-ионы, а именно, атом углерода карбоксильной группы. При этом от карбоксильной группы отрывается углекислый газ и остаются метильные радикалы, которые образуют газообразный этан: Aнод(+): 2CH3COO– – 2e = 2CO2 + CH3–CH3 Суммарное уравнение электролиза водного раствора ацетата натрия: 2CH3COONa + 2H2O = H2 + 2NaOH + 2CO2 + CH3–CH3 4. Декарбоксилирование солей карбоновых кислот (реакция Дюма) Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении. R–COONa + NaOH → R–H + Na2CO3 Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты. При взаимодействии ацетата натрия с гидроксидом натрия при сплавлении образуется метан и карбонат натрия: 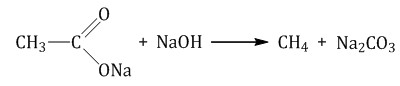 5. Гидрирование алкенов, алкинов, циклоалканов, алкадиенов При гидрировании этилена образуется этан: При полном гидрировании ацетилена также образуется этан: При гидрировании циклопропана образуется пропан: 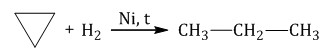 6. Синтез Фишера-Тропша Из синтез-газа (смесь угарного газа и водорода) при определенных условиях (катализатор, температура и давление) можно получить различные углеводороды: nCO + (3n+1)H2 = CnH2n+2 + nH2O Это промышленный процесс получения алканов. 7. Получение алканов в промышленности В промышленности алканы получают из нефти, каменного угля, природного и попутного газа. При переработке нефти используют ректификацию, крекинг и другие способы. |