алкены конспект. В алкенах атомы углерода находятся во втором валентном состоянии sр
 Скачать 63.9 Kb. Скачать 63.9 Kb.
|
|
Алкены — непредельные углеводороды, в молекулах которых между углеродными атомами имеется одна двойная связь. Они содержат в своей молекуле меньшее число водородных атомов, чем соответствующие им алканы (с тем же числом углеродных атомов), поэтому такие углеводороды называют непредельными или ненасыщенными. Алкены образуют гомологический ряд с общей формулой CnH2n. Простейшим представителем этиленовых углеводородов, его родоначальником является этилен (этен) С2Н4. По названию первого представителя этого ряда такие углеводороды называют этиленовыми. В алкенах атомы углерода находятся во втором валентном состоянии (sр2-гибридизация). В этом случае между углеродными атомами возникает двойная связь, состоящая из одной s- и одной p-связи. Длина и энергия двойной связи равны соответственно 0,134 нм и 610 кДж/моль. Все валентные углы 120º). Для алкенов характерны два вида изомерии: структурная и пространственная. Виды структурной изомерии: изомерия углеродного скелета 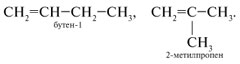 , , изомерия положения двойной связи межклассовая изомерия 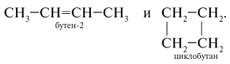 . . Геометрическая изомерия — один из видов пространственной изомерии. Изомеры, у которых одинаковые заместители (при разных углеродных атомах) расположены по одну сторону от двойной связи, называют цис-изомерами, а по разную — транс-изомерами: 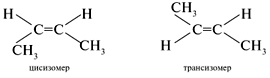 . .По систематической номенклатуре названия алкенов производят заменой суффикса -ан в соответствующих алканах на суффикс -ен (алкан — алкен, этан — этен, пропан — пропен и т.д.). Выбор главной цепи и порядок названия тот же, что и для алканов. Однако в состав цепи должна обязательно входить двойная связь. Нумерацию цепи начинают с того конца, к которому ближе расположена эта связь. Например: СH3 | H3C—CH2—C—CH==CH2 H3C—C==CH—CH—CH2—CH3 | | | CH3 CH3 CH3 3,3-диметилпентен-1 2,4-диметилгексен-2 Химические свойства алкенов определяются двойной углерод-углеродной связью. π-Связь, как наименее прочная и более доступная, при действии реагента разрывается, а освободившиеся валентности углеродных атомов затрачиваются на присоединение атомов, из которых состоит молекула реагента. Для алкенов характерны реакции присоединения, окисления, полимеризации. Реакции присоединения. гидрирование:Н2С=СН2 + H2 → Н3С—СН3 Присоединение галогенов(хлорирование, бромирование, иодирование ит.д.): Н2С=СН2 + Cl2 → Cl−H2C—CH2−Cl Присоединение брома к алкенам (реакция бромирования) — качественная реакция на непредельные углеводороды. При пропускании через бромную воду непредельных углеводородов желтая окраска исчезает. Присоединение галогеноводородов:H2С=СН2 + НВr → Н3С—CH2Вr Присоединение галогенводородов к гомологам этилена идет по правилу В.В.Марковникова: при обычных условиях водород галогенводорода присоединяется по месту двойной связи к наиболее гидрогенизированному атому углерода при двойной связи, а галоген — к менее гидрогенизированному. СН3−HСδ+=Сδ−Н2 + Н+Вr − → Н3С—CHВr−СН3 Правило Марковникова соблюдается при присоединении к несимметричным алкенам и других электрофильных реагентов (H2O, H2SО4, НСl и др.). Присоединение воды (реакция гидратации): H3C—CH=CH2 + H—OH → H3C—CH—CH3 | OH Реакции окисления. Алкены окисляются легче, чем алканы. Продукты, образованные при окислении алкенов, и их строение зависят от строения алкенов и от условий проведения реакции. Горение: Н2С=СН2 + 3O2 → 2СO2 + 2Н2O При действии на этилен водного раствора КМnO4 (при нормальных условиях) происходит образование двухатомного спирта — этиленгликоля: 3H2C=CH2 + 2KMnO4 + 4H2O → 3HOCH2—CH2OH + 2MnO2 + KOH Эта реакция является качественной: фиолетовая окраска раствора перманганата калия изменяется при добавлении к нему непредельного соединения. Реакция полимеризации. Процесс соединения многих одинаковых молекул в более крупные называется реакцией полимеризации. 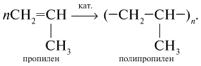 Алкены широко используются в качестве мономеров для получения многих высокомолекулярных соединений (полимеров). В природе алкены встречаются редко. Алкены – этен, пропен и бутен – при обычных условиях (20 °С, 1 атм) – газы, от С5Н10 до С18Н36 – жидкости, высшие алкены – твердые вещества. Алкены нерастворимы в воде, хорошо растворимы в органических растворителях. Обычно газообразные алкены выделяют из газов нефтепереработки (при крекинге) или попутных газов, а также из газов коксования угля. В промышленности алкены получают дегидрированием алканов в присутствии катализатора. 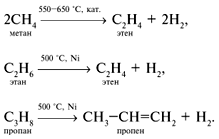 Из лабораторных способов получения можно отметить следующие: Из галогенопроизводных алканов: 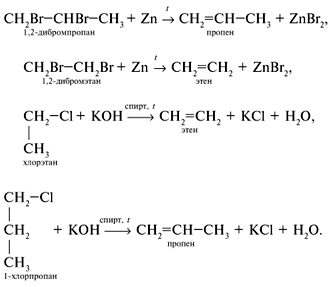 . .2. Дегидратация спиртов (отщепление воды). В качестве катализатора используют кислоты (серную или фосфорную) или А12O3 (в таких реакциях водород отщепляется от наименее гидрогенизированного (с наименьшим числом водородных атомов) углеродного атома (правило А.М.Зайцева): |
