Алканы алканы, имея общую формулу СnH2n2
 Скачать 0.85 Mb. Скачать 0.85 Mb.
|
|
АЛКАНЫ Алканы, имея общую формулу СnH2n+2 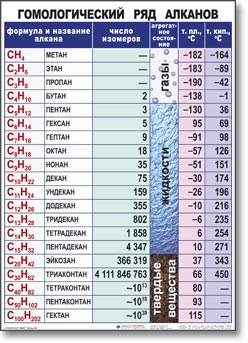 Суффикс -ан является характерным для названия всех алканов. Начиная с пятого гомолога, название алкана образуется из греческого числительного, указывающего число атомов углерода в молекуле, и суффикса -ан: пентан С5Н12, гексан С6Н14, гептан С7Н16, октан С8Н18, нонан С9Н20, декан С10Н22 и т.д. Гомологи отличаются молекулярной массой, и следовательно, физическими характеристиками. С увеличением числа углеродных атомов в молекуле алкана (с ростом молекулярной массы) в гомологическом ряду наблюдается закономерное изменение физических свойств гомологов (переход количества в качество): повышаются температуры кипения и плавления, увеличивается плотность. Алканы от СН4 до С4Н10– газы, от С5Н12 до С17Н36 – жидкости, далее – твердые вещества. Химические свойства Историческое название алканов - "парафины" - означает " не имеющие сродства". Алканы химически мало активны. для них наиболее характерны реакции замещения. Галогенирование Галогенирование алканов – реакция замещения одного или более атомов водорода в молекуле алкана на галоген. Продукты реакции называют галогеналканами или галогенопроизводными алканов. Реакция алканов с хлором и бромом идет на свету или при нагревании. Хлорирование метана: При достаточном количестве хлора реакция продолжается дальше и приводит к образованию смеси продуктов замещения 2-х, 3-х и 4-х атомов водорода: Реакция галогенирования алканов протекает по радикальному цепному механизму, т.е. как цепь последовательных превращений с участием свободно-радикальных частиц. При хлорировании или бромировании алкана с вторичными или третичными атомами углерода легче всего идет замещение водорода у третичного атома, труднее у вторичного и еще труднее у первичного. Это объясняется большей устойчивостью третичных и вторичных углеводородных радикалов по сравнению с первичными вследствие делокализации неспаренного электрона. Нитрование алканов (реакция Коновалова) На алканы действует pазбавленная азотная кислота пpи нагpевании и давлении. В pезультате пpоисходит замещение атома водоpода на остаток азотной кислоты – нитpогpуппу NO2. Эту pеакцию называют pеакцией нитpования, а пpодукты pеакции – нитpосоединениями. RH + HNO3 → RNO2 + H2O. 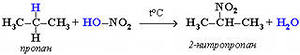 Крекинг – процесс термического разложения углеводородов, в основе которого лежат реакции расщепления углеродной цепи крупных молекул с образованием соединений с более короткой цепью. C6H14 → C2H6 + C4H8 Крекинг алканов является основой переработки нефти с целью получения продуктов меньшей молекулярной массы, которые используются в качестве моторных топлив, смазочных масел и т.п., а также сырья для химической и нефтехимической промышленности. В общем виде этот процесс можно выразить схемой: CnH2n+2 CmH2m + CpH2p+2, где m + p = n Изомеризация алканов Алканы нормального строения под влиянием катализаторов и при нагревании способны превращаться в разветвленные алканы без изменения состава молекул, т.е. вступать в реакции изомеpизации. В этих pеакциях участвуют алканы, молекулы которых содержат не менее 4-х углеродных атомов. Например, изомеризация н-пентана в изопентан (2-метилбутан) происходит при 100°С в присутствии катализатора хлорида алюминия: 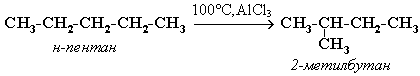 Исходное вещество и продукт реакции изомеризации имеют одинаковые молекулярные формулы и являются структурными изомерами (изомерия углеродного скелета). Дегидрирование алканов При нагревании алканов в присутствии катализаторов (Pt, Pd, Ni, Fe, Cr2O3, Fe2O3, ZnO) происходит их каталитическое дегидрирование – отщепления атомов водорода за счет разрыва связей С—Н. Низшие алканы, содержащие в цепи от 2-х до 4-х атомов углерода, при нагревании над Ni-катализатором отщепляют водород от соседних углеродных атомов и превращаются в алкены: 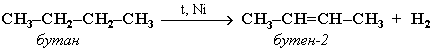 Горение Получение алканов Алканы выделяют из природных источников (природный и попутный газы, нефть, каменный уголь). Используются также синтетические методы. 1. Крекинг нефти (промышленный способ) 2.Гидpиpование непpедельных углеводоpодов:  3.Газификация твердого топлива (при повышенной температуре и давлении, катализатор Ni): 4.Синтез более сложных алканов из галогенопpоизводных с меньшим числом атомов углеpода: (реакция Вюpца) 5. Из солей карбоновых кислот, сплавление со щелочью (реакция Дюма) 6. Разложение карбидов металлов (метанидов) водой: Применение алканов Предельные углеводороды находят широкое применение в самых разнообразных сферах жизни и деятельности человека. Газообразные алканы (метан и пpопан-бутановая смесь) используются в качестве ценного топлива. Жидкие углеводоpоды составляют значительную долю в моторных и ракетных топливах и используются в качестве растворителей. Вазелиновое масло (смесь жидких углеводоpодов с числом атомов углерода до 15) - пpозpачная жидкость без запаха и вкуса, используется в медицине, паpфюмеpии и косметике. Вазелин (смесь жидких и твеpдых пpедельных углеводоpодов с числом углеpодных атомов до 25) пpименяется для пpиготовления мазей, используемых в медицине. Паpафин (смесь твеpдых алканов С19-С35) - белая твеpдая масса без запаха и вкуса (т.пл. 50-70 °C) - пpименяется для изготовления свечей, пpопитки спичек и упаковочной бумаги, для тепловых пpоцедуp в медицине. Служит сырьём при получении органических кислот и спиртов, моющих средств и поверхностно-активных веществ. Нормальные предельные углеводороды средней молекулярной массы используются как питательный субстрат в микробиологическом синтезе белка из нефти. Большое значение имеют галогенопроизводные алканов, которые используются как растворители, хладоагенты и сырье для дальнейших синтезов. В современной нефтехимической промышленности предельные улеводороды являются базой для получения разнообразных органических соединений, важным сырьем в процессах получения полупродуктов для производства пластмасс, каучуков, синтетических волокон, моющих средств и многих других веществ. ЦИКЛОАЛКАНЫ Циклоалканы (циклопаpафины, нафтены, цикланы, полиметилены) – предельные углеводороды с замкнутой (циклической) углеродной цепью. Атомы углерода в циклоалканах, как и в алканах, находятся в sp3–гибридизованном состоянии и все их валентности полностью насыщены. По правилам международной номенклатуры в циклоалканах главной считается цепь углеродных атомов, образующих цикл. Название строится по названию этой замкнутой цепи с добавлением приставки "цикло" (циклопропан, циклобутан, циклопентан, циклогексан и т.д.). При наличии в цикле заместителей нумерацию атомов углерода в кольце проводят так, чтобы ответвления получили возможно меньшие номера. Так, соединение 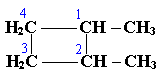 следует назвать 1,2-диметилциклобутан, а не 2,3-диметилциклобутан, или 3,4-диметилциклобутан. Общая формула циклоалканов СnH2n. 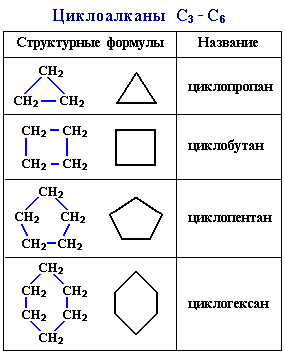 Изомерия циклоалканов Для циклоалканов характерны как структурная, так и пространственная изомерия. Структурная изомеpия 1. Изомерия углеродного скелета: а) кольца 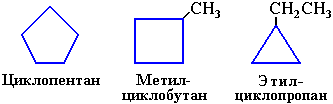 б) боковых цепей 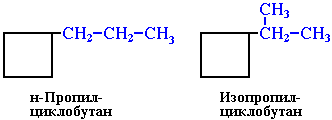 2. Изомерия положения заместителей в кольце: 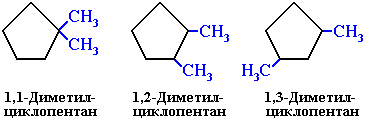 3. Межклассовая изомерия с алкенами: 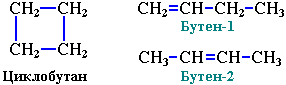 Пространственная изомерия Цис-транс-изомерия, обусловленная различным взаимным расположением в пространстве заместителей относительно плоскости цикла. В цис-изомерах заместители находятся по одну сторону от плоскости кольца, в транс-изомерах – по разные: 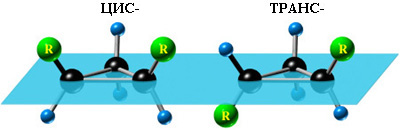 Свойства циклоалканов Физические свойства циклоалканов закономерно изменяются с ростом их молекулярной массы. Пpи ноpмальных условиях циклопpопан и циклобутан – газы, циклоалканы С5 – С16 – жидкости, начиная с С17, – твердые вещества. Температуры кипения циклоалканов выше, чем у соответвующих алканов. Это связано с более плотной упаковкой и более сильными межмолекулярными взаимодействиями циклических структур. Химические свойства циклоалканов сильно зависят от размера цикла, определяющего его устойчивость. Трех- и четырехчленные циклы (малые циклы), являясь насыщенными, тем не менее, резко отличаются от всех остальных предельных углеводородов. Валентные углы в циклопропане и циклобутане значительно меньше нормального тетраэдрического угла 109°28’, свойственного sp3-гибридизованному атому углерода. 1. Реакции гидрирования 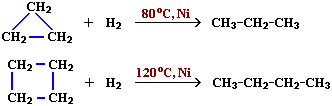 2. Циклопропан и его производные присоединяют галогены и галогеноводороды: 3. Реакции замещения 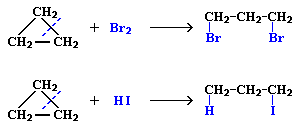 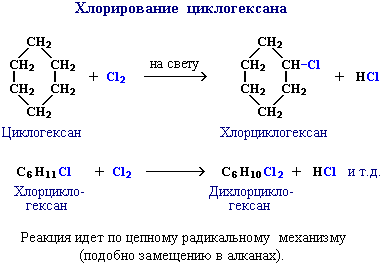 4. Реакции дегидрирования 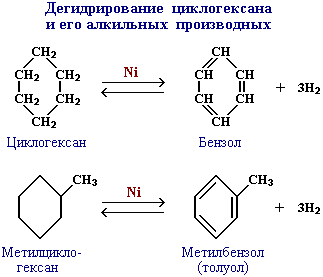 Получение циклоалканов 1. Циклоалканы содержатся в значительных количествах в нефтях некоторых месторождений (отсюда произошло одно из их названий - нафтены). При переработке нефти выделяют главным образом циклоалканы С5 - С7. 2. Действие активных металлов на дигалогензамещенные алканы (внутримолекулярная реакция Вюрца) приводит к образованию различных циклоалканов: (вместо металлического натрия часто используется порошкообразный цинк). АЛКЕНЫ Алкены (этиленовые углеводороды, олефины) - непредельные алифатические углеводороды, молекулы которых содержат двойную связь. Общая формула ряда алкенов CnH2n. Простейшие представители: 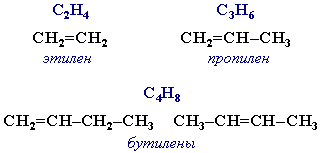 В отличие от предельных углеводородов, алкены содержат двойную связь С=С. В образовании такой связи участвуют атомы углерода в sp2-гибридизованном состоянии. Номенклатура алкенов По систематической номенклатуре названия алкенов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса –ан на –ен: Главная цепь выбирается таким образом, чтобы она обязательно включала в себя двойную связь (т.е. она может быть не самой длинной). Нумерацию углеродных атомов начинают с ближнего к двойной связи конца цепи. Цифра, обозначающая положение двойной связи, ставится обычно после суффикса –ен. Например: 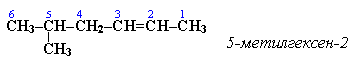 Для простейших алкенов применяются также исторически сложившиеся названия: этилен (этен), пропилен (пропен), бутилен (бутен-1), изобутилен (2-метилпропен) и т.п. В номенклатуре различных классов органических соединений наиболее часто используются следующие одновалентные радикалы алкенов: 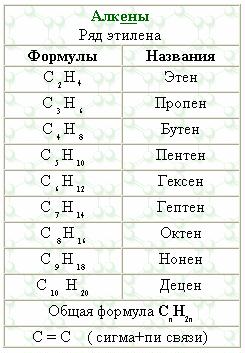 Структурная изомерия алкенов 1. Изомерия углеродного скелета (начиная с С4Н8): 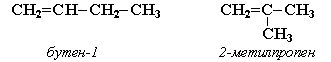 2. Изомерия положения двойной связи (начиная с С4Н8) 3. Межклассовая изомерия с циклоалканами, начиная с С3Н6: 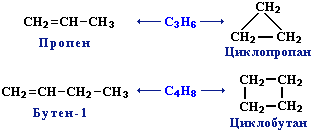 Пространственная изомерия 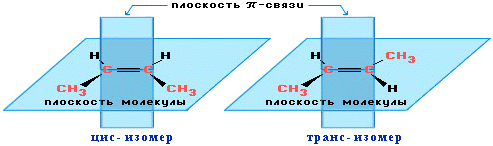 Свойства алкенов  Получение алкенов В природе алкены встречаются в значительно меньшей степени, чем предельные углеводороды, по-видимому, вследствие своей высокой реакционной способности. Поэтому их получают с использованием различных реакций. I. Крекинг алканов: II. Отщепление (элиминирование) двух атомов или групп атомов от соседних атомов углерода с образованием между ними p-связи. Дегидрогалогенирование галогеналканов при действии спиртового раствора щелочи Дегидратация спиртов при повышенной температуре (выше 140° C) в присутствии водоотнимающих реагентов 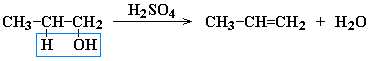 Реакции элиминирования идут в соответствии с правилом Зайцева: Отщепление атома водорода в реакциях дегидрогалогенирования и дегидратации происходит преимущественно от наименее гидрогенизированного атома углерода. Современная формулировка: реакции отщепления идут с образованием более замещенных при двойной связи алкенов. Такие алкены обладают более низкой энергией. 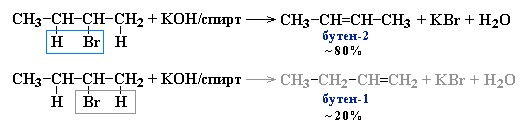 Дегалогенирование дигалогеналканов, имеющих атомы галогена у соседних атомов углерода, при действии активных металлов : Дегидрирование алканов при 500°С: 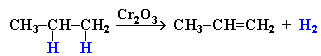 Применение Пропилен (пропен) Н2С=СН2–СН3 и бутилены (бутен-1 и бутен-2) используются для получения спиртов и полимеров. Изобутилен (2-метилпропен) Н2С=С(СН3)2 применяется в производстве синтетического каучука 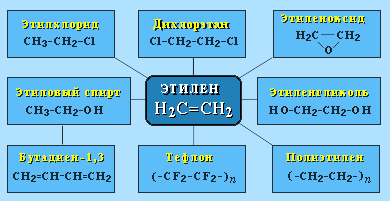 Этилен применяется как средство для ускоренного созревания фруктов. АЛКАДИЕНЫ Алкадиены (диены) – непредельные алифатические углеводороды, молекулы которых содержат две двойные связи. Общая формула алкадиенов СnH2n-2. Свойства алкадиенов в значительной степени зависят от взаимного расположения двойных связей в их молекулах. По этому признаку различают три типа двойных связей в диенах. 1.Изолированные двойные связи разделены в цепи двумя или более σ-связями: СН2=СН–СН2–СН=СН2 Разделенные sp3-атомами углерода, такие двойные связи не оказывают друг на друга взаимного влияния и вступают в те же реакции, что и двойная связь в алкенах. Таким образом, алкадиены этого типа проявляют химические свойства, характерные для алкенов. 2. Кумулированные двойные связи расположены у одного атома углерода: СН2=С=СН2 (аллен) Подобные диены (аллены) относятся к довольно редкому типу соединений. 3.Сопряженные двойные связи разделены одной σ-связью: СН2=СН–СН=СН2 Сопряженные диены представляют наибольший интерес. Они отличаются характерными свойствами, обусловленными электронным строением молекул, а именно, непрерывной последовательностью 4-х sp2-атомов углерода. Отдельные представители этих диенов широко используются в производстве синтетических каучуков и различных органических веществ. Номенклатура алкадиенов Названия алкадиенов производят от названий соответствующих алканов (с тем же числом атомов углерода), в которых последняя буква заменяется окончанием –диен. Местоположение двойных связей указывается в конце названия, а заместителей – в начале названия. Например: 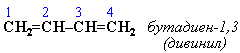 Название "дивинил" происходит от названия радикала –СН=СН2 "винил". Изомерия сопряженных диенов 1. Изомерия положения сопряженных двойных связей: 2. Изомерия углеродного скелета 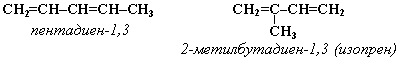 3. Межклассовая изомерия с алкинами и циклоалкенами. Например, формуле С4Н6 соответствуют следующие соединения: 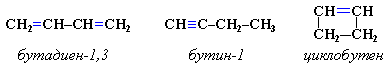 Пространственная изомерия Диены, имеющие различные заместители при углеродных атомах у двойных связей, подобно алкенам, проявляют цис-транс-изомерию. 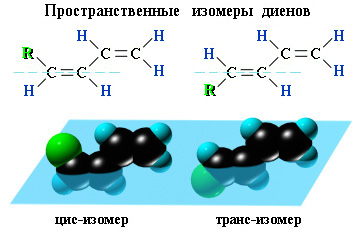 Молекула бутадиена-1,3 СН2=СН-СН=СН2 содержит четыре атома углерода в sp2-гибридизованном состоянии и имеет плоское строение. 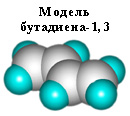 Аналогично построены молекулы изопрена: 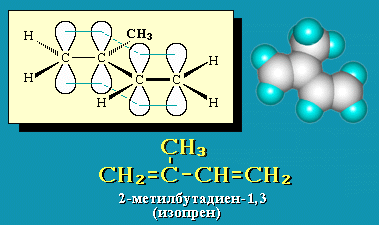 химические свойства 1. Гидрирование 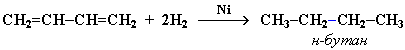 2. Галогенирование 3. Диеновый синтез (реакция Дильса-Альдера) 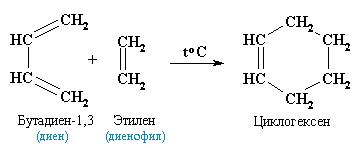 Дивинил и изопрен вступают в полимеризацию и сополимеризацию (т.е. совместную полимеризацию) с другими непредельными соединениями, образуя каучуки. Каучуки – это эластичные высокомолекулярные материалы (эластомеры), из которых методом вулканизации (нагреванием с серой) получают резину. Натуральный каучук – природный высокомолекулярный непредельный углеводород состава (С5Н8)n, где n составляет 1000-3000 единиц. Установлено, что этот полимер состоит из повторяющихся звеньев 1,4-цис-изопрена и имеет стереорегулярное строение: Резина – это вулканизованный каучук с наполнителем (сажа). Суть процесса вулканизации заключается в том, что нагревание смеси каучука и серы приводит к образованию трехмерной сетчатой структуры из линейных макромолекул каучука, придавая ему повышенную прочность. Атомы серы присоединяются по двойным связям макромолекул и образуют между ними сшивающие дисульфидные мостики: 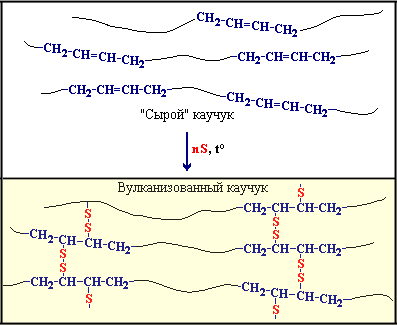 Получение алкадиенов 1. 2. 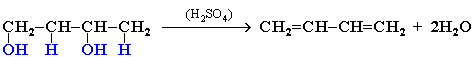 АЛКИНЫ Алкины (ацетиленовые углеводороды) – непредельные алифатические углеводороды, молекулы которых содержат тройную связь C≡C. Общая формула алкинов с одной тройной связью СnH2n-2 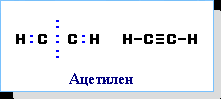 Номенклатура алкинов По систематической номенклатуре названия ацетиленовых углеводородов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса –ан на –ин: 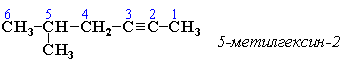 Для простейших алкенов применяются также исторически сложившиеся названия: ацетилен (этин), аллилен (пропин), кротонилен (бутин-1), валерилен (пентин-1). В номенклатуре различных классов органических соединений наиболее часто используются следующие одновалентные радикалы алкинов: Изомерия алкинов Структурная изомерия 1. Изомерия положения тройной связи (начиная с С4Н6): 2. Изомерия углеродного скелета (начиная с С5Н8): 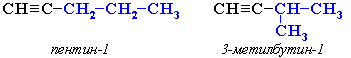 3. Межклассовая изомерия с алкадиенами и циклоалкенами, начиная с С4Н6: 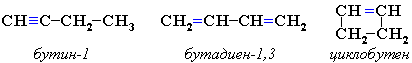 Пространственная изомерия относительно тройной связи в алкинах не проявляется, т.к. заместители могут располагаться только одним способом – вдоль линии связи. Физические свойства. Температуры кипения и плавления ацетиленовых углеводородов увеличиваются с ростом их молекулярной массы. При обычных условиях алкины С2Н2-С4Н6 – газы, С5Н8-С16Н30 – жидкости, с С17Н32 – твердые вещества. Температуры кипения и плавления алкинов выше, чем у соответствующих алкенов. 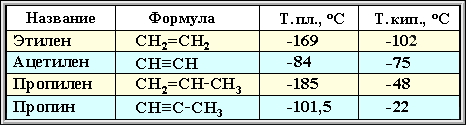 Реакции присоединения к алкинам 1. Гидратация (реакция Кучерова) 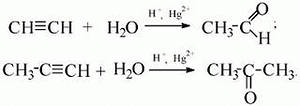 2. 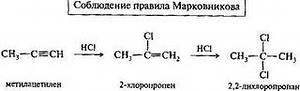 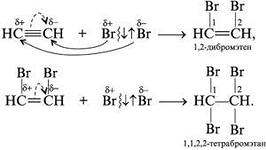 Полимеризация Полимеризация3. 4. Димеризация под действием водно-аммиачного раствора CuCl: 5. Тримеризация ацетилена над активированным углем приводит к образованию бензола (реакция Зелинского): 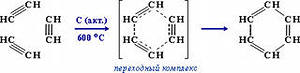 6. Получение 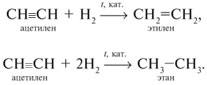 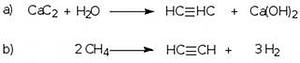 Применение алкинов Наибольшее практическое значение имеют ацетилен H–C≡C–H и винилацетилен CH2=CH–C≡CH. Ацетилен используется для получения самых разнообразных веществ: 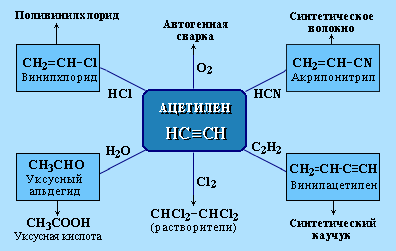 |
