Алкадиены 3. СnH2n2
 Скачать 287.31 Kb. Скачать 287.31 Kb.
|
|
Алкадиены Определение. Алкадиены (диены) – непредельные алифатические углеводороды, молекулы которых содержат две двойные связи. Общая формула алкадиенов СnH2n-2. Общая формула алкадиенов CnH2n-2. В названии углеводородов этого класса присутствует суффикс –диен. СТРОЕНИЕ 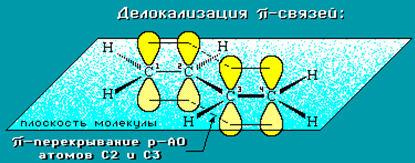 ГИБРИДИЗАЦИЯ Если двойные связи сопряженные, то имеет место sp2-гибридизация. В сопряженных диенах p-электронные облака двойных связей перекрываются между собой и образуют единое p-электронное облако. В сопряженной системе p-электроны уже не принадлежат определенным связям, они делокализованы по всем атомам, поэтому структуру диенов можно изобразить следующим образом (на примере бутадиена) : Пунктирные линии показывают область делокализации электронов и обозначают промежуточный порядок связи между С-С и С = С. Цепь сопряжения может включать большое число двойных связей. Чем она длиннее, тем больше делокализация p-электронов и тем устойчивее молекула. Свойства алкадиенов в значительной степени зависят от взаимного расположения двойных связей в их молекулах. По этому признаку различают три типа двойных связей в диенах. 1.Изолированные двойные связи разделены в цепи двумя или более σ-связями: СН2=СН–СН2–СН=СН2 Разделенные sp3-атомами углерода, такие двойные связи не оказывают друг на друга взаимного влияния и вступают в те же реакции, что и двойная связь в алкенах. Таким образом, алкадиены этого типа проявляют химические свойства, характерные для алкенов. 2. Кумулированные двойные связи расположены у одного атома углерода: СН2=С=СН2 (аллен) Подобные диены (аллены) относятся к довольно редкому типу соединений. 3.Сопряженные двойные связи разделены одной σ-связью: СН2=СН–СН=СН2 Сопряженные диены представляют наибольший интерес. Они отличаются характерными свойствами, обусловленными электронным строением молекул, а именно, непрерывной последовательностью 4-х sp2-атомов углерода.  Изомеризация, сопровождающаяся перемещением двойной связи Реакции изомеризации алкинов и алкадиенов характеризуются большим разнообразием, возможны все виды изомеризации скелетная, цис-транс-, и перемещение двойных и тройных связей, изменение характера связей — переход тройных связей в двойные, реакции циклизации. В чистом виде отдельные разновидности изомеризации алкинов и алкадиенов практически не наблюдаются и часто сопровождаются другими видами изомеризации. Используемые катализаторы аналогичны катализаторам изомеризации алкенов Номенклатура алкадиенов По правилам IUPAC главная цепь молекулы алкадиена должна включать обе двойные связи. Нумерация атомов углерода в цепи проводится так, чтобы двойные связи получили наименьшие номера. Названия алкадиенов производят от названий соответствующих алканов (с тем же числом атомов углерода), в которых последняя буква заменяется окончанием –диен. Местоположение двойных связей указывается в конце названия, а заместителей – в начале названия. Например: 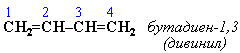 Название "дивинил" происходит от названия радикала –СН=СН2 "винил". 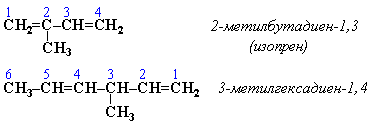 СПОСОБЫ ПОЛУЧЕНИЯ  Физические свойства алкадиеновНизшие диены — бесцветные легкокипящие жидкости. 1,3-Бутадиен и аллен (1,2 — пропадиен) — легко сжижающиеся газы, обладающие неприятным запахом. Высшие диены представляют собой твердые вещества. Получение алкадиеновОсновные способы получения алкадиенов – дегидрирование алканов (1), реакция Лебедева (2), дегидратация гликолей (3), дегалагенирование дигалогенпроизводных (4) алкенов и реакции перегруппировки (5): CH3-CH2-CH2-CH3 → CH2 = CH-CH = CH2 (1); 2C2H5OH → CH2 = CH-CH = CH2 + 2H2O + H2 (2); CH3-CH(OH)-CH2-CH2-OH → CH2 = CH-CH = CH2 + 2H2O (3); СH2 = C(Br)-CH2-Br + Zn → CH2 = C = CH2 + ZnBr2 (4); HC≡C-CH(CH3)-CH3 + NaOH → CH2 = C = CH(CH3)-CH3 (5). Основная сфера использования диенов и их производных – это производство каучука. Химические свойства алкадиеновДля алкадиенов характерны реакции, протекающие по механизмам электрофильного и радикального присоединения, причем, наиболее реакционноспособными являются сопряженные алкадиены. Галогенирование. При присоединении к алкадиенам хлора или брома образуются тетрагалогеноалканы, причем, возможно образование продуктов как 1,2-, так и 1,4- присоединения. Соотношение продуктов зависит от условий проведения реакции: типа растворителя и температуры. CH2 = CH-CH = CH2 + Br2 (гексан) → CH2(Br)-CH(Br)-CH = CH2 + CH2(Br)-CH = CH-CH2-Br При температуре -80С соотношение продуктов 1,2 – и 1,4 – присоединения – 80/20%; -15С – 54/46%; +40С – 20/80%; +60С – 10/90%. Присоединение галогенов возможно и по радикальному механизму – под действием УФ-излучения. В этом случае также происходит образование смеси продуктов 1,2 – и 1,4 – присоединения. Гидрогалогенирование протекает подобно галогенированию, т.е. с образованием смеси продуктов 1,2 – и 1,4 – присоединения. Соотношение продуктов в основном зависит от температуры, так, при высоких температурах преобладают продукты 1,2 – присоединения, а при низких — 1,4 – присоединения. CH2 = CH-CH = CH2 +HBr → CH3-CH(Br)-CH = CH2 + CH3-CH = CH-CH2-Br |
