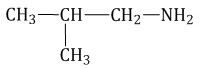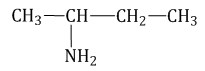Амины1. Амины это органические производные аммиака nh
 Скачать 220.04 Kb. Скачать 220.04 Kb.
|
|
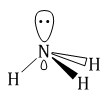
Амины – это органические производные аммиака NH3, в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы. R-NH2, R1-NH-R2, R1-N(R2)-R3 Строение аминов 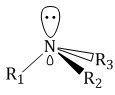 Атом азота находится в состоянии sp3-гибридизации, поэтому молекула имеет форму тетраэдра. Также атом азота в аминах имеет неподелённую электронную пару, поэтому амины проявляют свойства органических оснований. Классификация аминов По количеству углеводородных радикалов, связанных с атомом азота, различают первичные, вторичные и третичные амины. По типу радикалов амины делят на алифатические, ароматические и смешанные.
Номенклатура аминов Названия аминов образуют из названий углеводородных радикалов и суффикса амин. Различные радикалы перечисляются в алфавитном порядке. При наличии одинаковых радикалов используют приставки ди и три. CH3-NH2 Метиламин СH3CH2-NH2 Этиламин CH3-CH2-NH-CH3 Метилэтиламин (CH3)2NH Диметиламин Первичные амины могут быть названы как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы -NH2. В этом случае аминогруппа указывается в названии приставкой амино-:
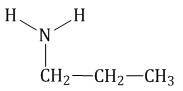
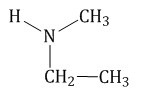
Для смешанных аминов, содержащих алкильные и ароматические радикалы, за основу названия обычно берется название первого представителя ароматических аминов – анилин. Например, N-метиланилин: 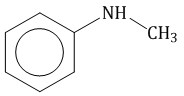 Символ N- ставится перед названием алкильного радикала, чтобы показать, что этот радикал связан с атомом азота, а не является заместителем в бензольном кольце. Изомерия аминов Для аминов характерна изомерия углеродного скелета, изомерия положения аминогруппы и изомерия различных типов аминов. Изомерия углеродного скелета Для аминов характерна изомерия углеродного скелета (начиная с С4H9NH2).
Изомерия положения аминогруппы Для аминов характерна изомерия положения аминогруппы (начиная с С3H9N).
Изомерия между типами аминов
Физические свойства аминов При обычной температуре низшие алифатические амины CH3NH2, (CH3)2NH и (CH3)3N – газы (с запахом аммиака), средние гомологи – жидкости (с резким рыбным запахом), высшие – твердые вещества без запаха. Ароматические амины – бесцветные жидкости с высокой температурой кипения или твердые вещества. Первичные и вторичные амины образуют слабые межмолекулярные водородные связи: 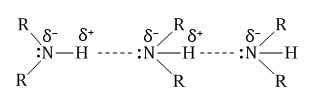 Это объясняет относительно более высокую температуру кипения аминов по сравнению с алканами с близкой молекулярной массой. Амины также способны к образованию водородных связей с водой: 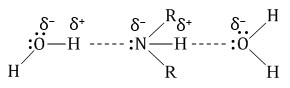 Поэтому низшие амины хорошо растворимы в воде. С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается. Ароматические амины в воде не растворяются. Химические свойства аминов
1. Основные свойства аминов
Это объясняется тем, что радикалы СН3–, С2Н5– увеличивают электронную плотность на атоме азота: Это приводит к усилению основных свойств.
1.1. Взаимодействие с водой В водном растворе амины обратимо реагируют с водой. Среда водного раствора аминов — слабощелочная: 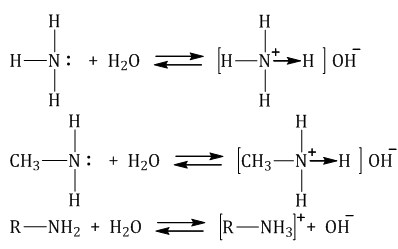 1.2. Взаимодействие с кислотами Амины реагируют с кислотами, как минеральными, так и карбоновыми, и аминокислотами, образуя соли (или амиды в случае карбоновых кислот): При взаимодействии аминов с многоосновными кислотами возможно образование кислых солей: 1.3. Взаимодействие с солями Амины способны осаждать гидроксиды тяжелых металлов из водных растворов.
2. Окисление аминов Амины сгорают в кислороде, образуя азот, углекислый газ и воду. Например, уравнение сгорания этиламина: 3. Взаимодействие с азотистой кислотой Первичные алифатические амины при действии азотистой кислоты превращаются в спирты:
Вторичные амины (алифатические и ароматические) образуют нитрозосоединения — вещества желтого цвета: 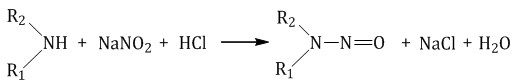 4. Алкилирование аминов Первичные амины способны взаимодействовать с галогеналканами с образованием соли вторичного амина: 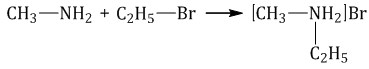 Из полученной соли щелочью выделяют вторичный амин, который можно далее алкилировать до третичного амина. Особенности анилина Анилин С6H5-NH2 – это ароматический амин. 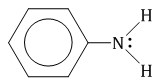
При 18 оС в 100 мл воды растворяется 3,6г анилина. Раствор анилина не изменяет окраску индикаторов.
Бензольное кольцо уменьшает основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком: Анилин не реагирует с водой, но реагирует с сильными кислотами, образуя соли: 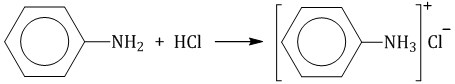 Бензольное кольцо в анилине становится более активным в реакциях замещения, чем у бензола. Реакция с галогенами идёт без катализатора во все три орто- и пара- положения.
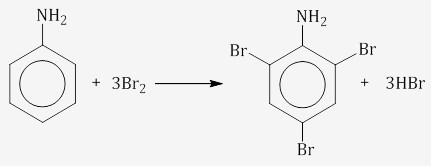 Получение аминов Восстановление нитросоединений Первичные амины можно получить восстановлением нитросоединений. Гидрирование водородом: Восстановление сульфидом аммония: Алюминий в щелочной среде. Алюминий реагирует с щелочами с образованием гидроксокомплексов. В щелочной и нейтральной среде получаются амины. Восстановлением нитробензола получают анилин. Металлами в кислой среде – железом, оловом или цинком в соляной кислоте. При этом образуются не сами амины, а соли аминов: Амины из раствора соли выделяют с помощью щелочи: Алкилирование аммиака и аминов При взаимодействии аммиака с галогеналканами происходит образование соли первичного амина, из которой действием щелочи можно выделить сам первичный амин. Если проводить реакцию с избытком аммиака, то сразу получится амин, а галогеноводород образует соль с аммиаком: Гидрирование нитрилов Таким образом получают первичные амины. Возможно восстановление нитрилов водородом на катализаторе: . Соли аминов Соли аминов — это твердые вещества без запаха, хорошо растворимые в воде, но не растворимые в органических растворителях (в отличие от аминов). При действии щелочей на соли аминов выделяются свободные амины: Соли аминов вступают в обменные реакции в растворе: Взаимодействие с аминами. Соль амина с более слабыми основными свойствами может реагировать с другим амином, образуя новую соль (более сильные амины вытесняют менее сильные из солей): 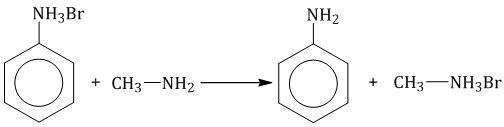 |