Лекция_34_Нитросоединения. Лекция 34 нитросоединения нитросоединениями называются производные углеводородов общей формулы
 Скачать 0.85 Mb. Скачать 0.85 Mb.
|
|
15. Нитросоединения Лекция 34 НИТРОСОЕДИНЕНИЯ Нитросоединениями называются производные углеводородов общей формулы R-NO2, имеющие в своем составе нитрогруппу, непосредственно связанную с алифатическим или ароматическим углеводородным радикалом.  Рис. 34.1. Нитросоединения 34.1. Классификация и номенклатура нитросоединений Классификация. В зависимости от природы углеводородного радикала, с которым связана нитрогруппа, различают: алифатические нитросоединения насыщенные (нитроалканы) СН3—NО2 - нитрометан СН3—СН2—NО2 - нитроэтан ненасыщенные (нитроалкены, нитроалкины) 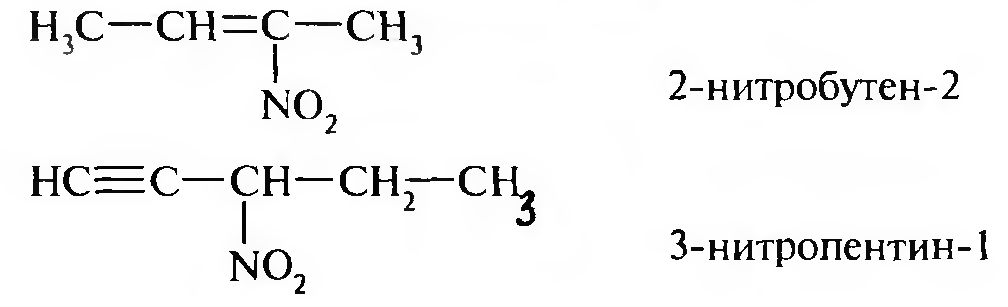 34.2. Ненасыщенные нитросоединения: нитроалкены и нитроалкины 2) ароматические нитросоединения Ароматические нитросоединения делятся на две группы: - соединения, содержащие нитрогруппу, связанную с атомом углерода ароматического ядра; - соединения, содержащие нитрогруппу в боковой цепи: 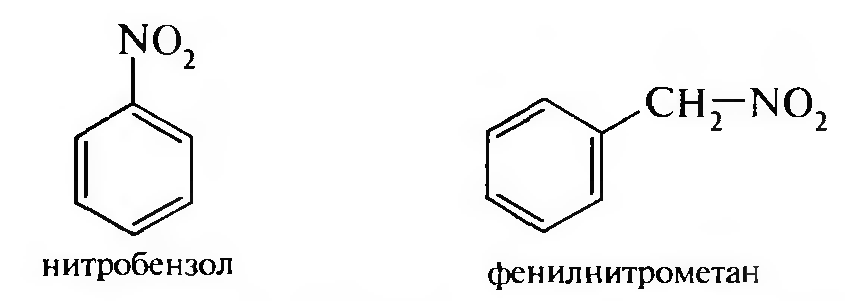 34.3. Ароматические нитросоединения В зависимости от того, у какого (первичного, вторичного или третичного) атома углерода находится нитрогруппа, нитросоединения бывают первичные, вторичные или третичные.  34.5. Первичные, вторичные и третичные алифатические нитросоединения Номенклатура. Названия нитросоединений образуют путем добавления префикса нитро- к названию соответствующего углеводорода с указанием положения нитрогруппы: 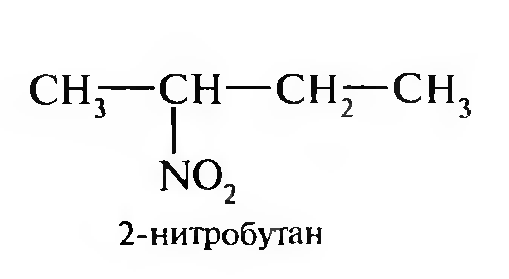 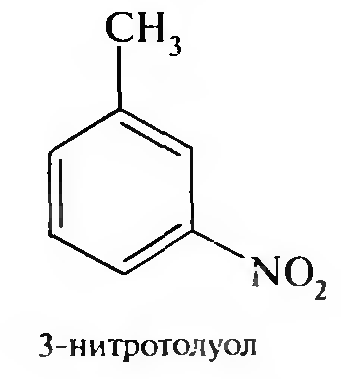 34.6. Номенклатура нитросоединений Нитроарены, содержащие нитрогруппу в боковой цепи, рассматривают как производные предельных углеводородов, содержащих в качестве заместителей ароматический радикал и нитрогруппу: 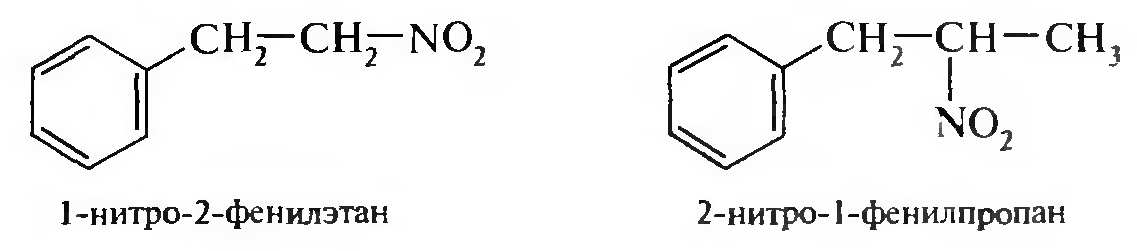 34.7. Номенклатура нитроаренов, содержащих нитрогруппу в боковом радикале 34.2. Электронно-структурная формула нитросоединений Нитрогруппа имеет плоское строение, атомы азота и кислорода находятся в состоянии sp2-гибридизации. Электронное строение нитрогруппы можно представить с помощью граничных (резонансных) структур: 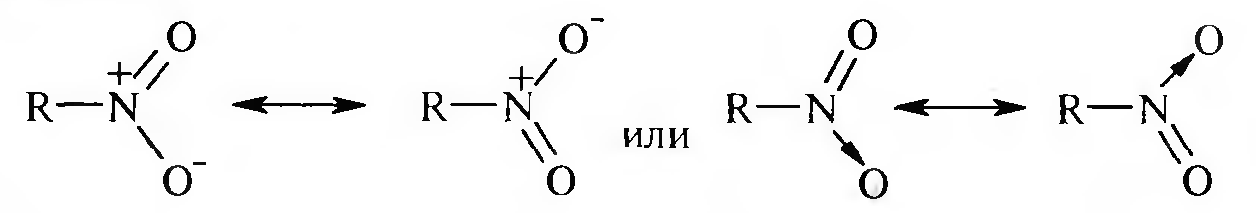 34.8. Нитрогруппа: резонансные структуры Один из атомов кислорода соединен с атомом азота двойной связью, а другой — семиполярной связью (от англ. semi — наполовину), т. е. связь нитрогруппы является полуполярной. В действительности вследствие сопряжения оба атома кислорода в нитрогруппе равноценны, поэтому ее строение можно представить следующим образом: 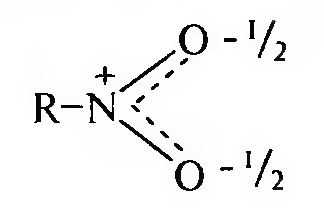 34.9. Электронно-структурная формула нитрогруппы 34.3. Нитросоединения алифатического ряда К нитросоединениям алифатического ряда относятся вещества, у которых нитрогруппа связана с линейными углеводородами. 34.3.1. Способы получения Нитрование алканов (реакция Коновалова). На предельный углеводород действуют разбавленной азотной кислотой (10—25%) при повышенной температуре и давлении. 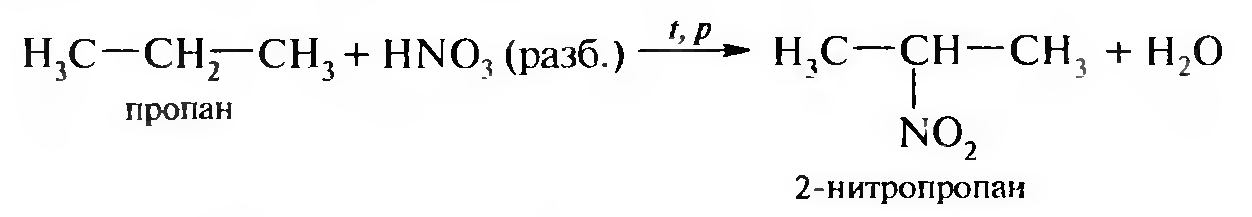 Действие солей азотистой кислоты на галогенопроизводные алканов: Данную реакцию целесообразно проводить в среде апротонного растворителя для уменьшения образования побочных продуктов — эфиров азотистой кислоты. Окисление трет-алкиламинов. Данный способ используют только для получения третичных нитросоединений: 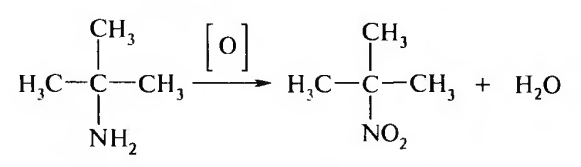 Физические свойства. Нитроалканы по физическим свойствам — бесцветные жидкости или вещества желтого цвета. Причиной окрашивания является наличие хромофора — группы –NO2. Нитроалканы имеют приятный запах, ядовиты. Мало растворимы в воде, растворимы в большинстве органических растворителей. 34.3.2. Химические свойства Для нитросоединений характерны два ряда реакций: - реакции с участием нитрогруппы; - реакции с участием подвижных атомов водорода при Сα-углеродном атоме. 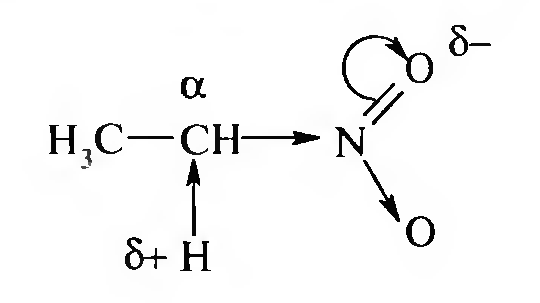 34.10. Структурная формула нитроалканов: активные центры Таутомерия и образование солей. Благодаря наличию подвижного атома водорода при α-углеродном атоме первичные и вторичные нитросоединения являются таутомерными веществами. 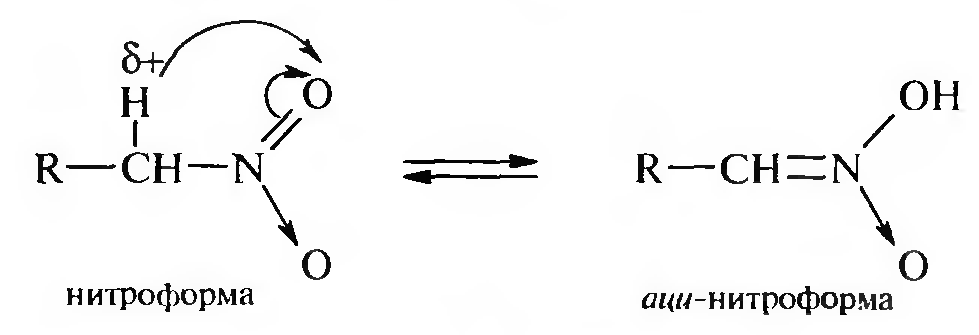 34.11. Таутомерия нитроалканов: аци-нитро-таутомерия В растворе между этими формами устанавливается динамическое равновесие. Такой вид таутомерии получил название — аци-нитро-таутоме- рии. В нейтральной среде равновесие почти полностью смещено в сторону нитроформы. В щелочной среде равновесие смещается в сторону аци- нитроформы. Так, первичные и вторичные нитроалканы растворяются в водном растворе щелочи, образуя соли нитроновых кислот. 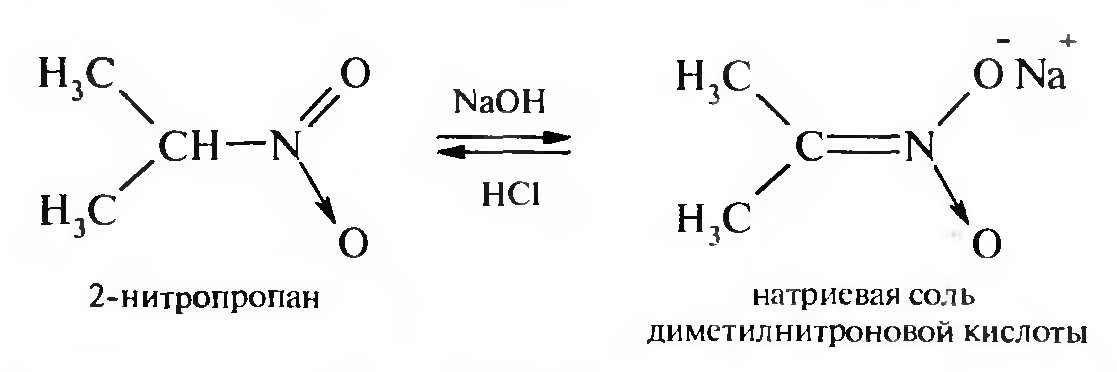 34.12. Соли нитроновых кислот Соли нитроновых кислот легко разрушаются минеральными кислотами с образованием исходных нитроалканов. Третичные нитросоединения в виду отсутствия подвижных атомов водорода при α-углеродном атоме не способны к таутомерии, а следовательно не взаимодействуют со щелочами. Реакция с азотистой кислотой. Первичные, вторичные и третичные нитросоединения по разному относятся к действию азотистой кислоты. В реакцию с HNО2 вступают только те нитросоединения, у которых есть подвижные атомы водорода при α-углеродном атоме. Первичные нитропроизводные образуют алкилнитроловые кислоты: 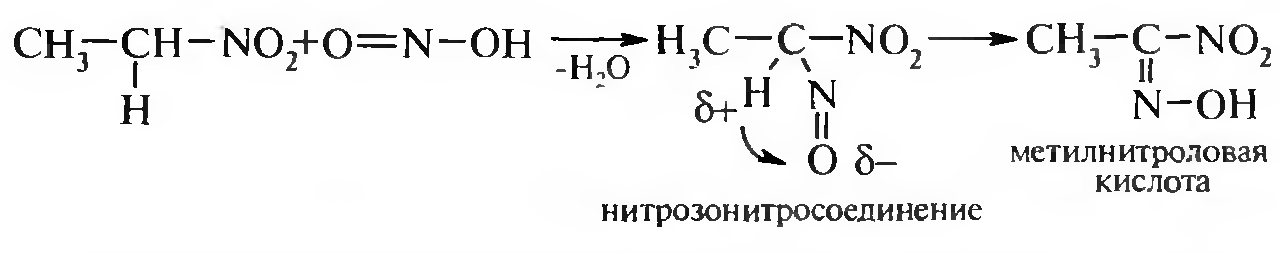 34.13. Схема реакции взаимодействия первичных нитроалканов с азотистой кислотой Нитроловые кислоты растворяются в щелочах, образуя соли, окрашенные в красный цвет. Вторичные нитросоединения с азотистой кислотой образуют псев- донитролы (нитрозо-нитросоединения): 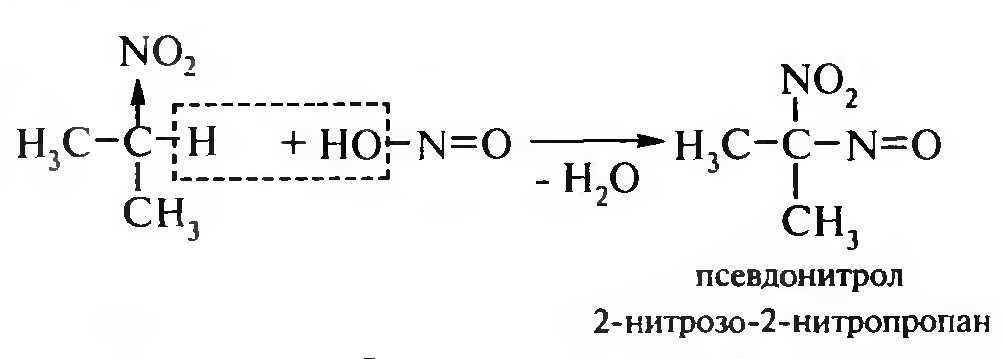 34.14. Схема реакции взаимодействия вторичных нитроалканов с азотистой кислотой Третичные нитросоединения не реагируют с азотистой кислотой. !!! Реакцию с азотистой кислотой используют для отличия первичных. вторичных и третичных нитросоединений друг от друга. Реакция конденсации с альдегидами и кетонами. За счет подвижных атомов водорода в α-положении нитросоединения (метиленовая компонента) способны в слабощелочной среде вступать в реакции конденсации с альдегидом с образованием нитроспиртов (нитроалканолов): 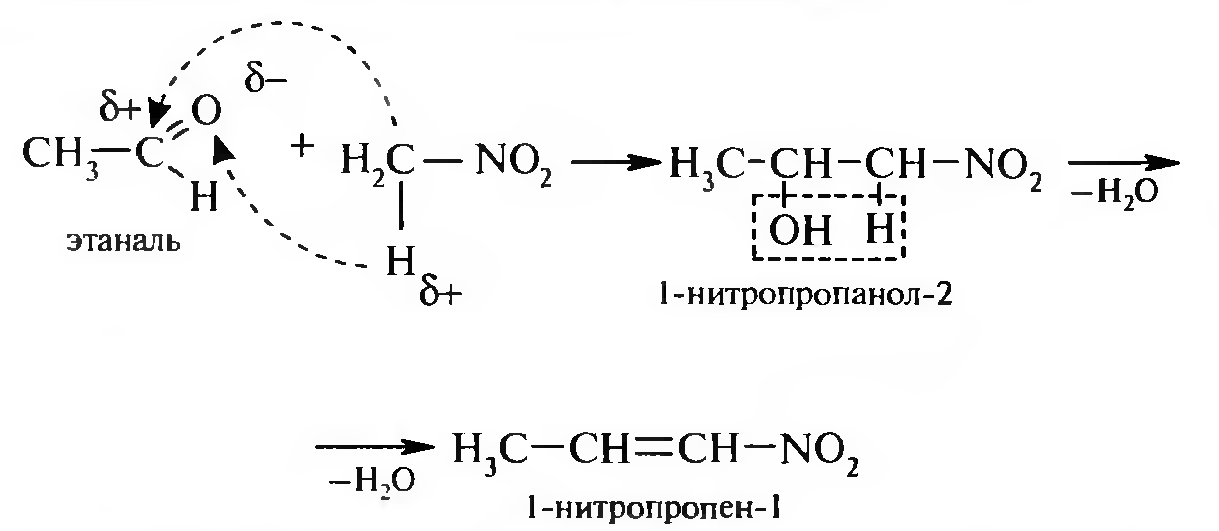 34.15. Схема реакции конденсации с альдегидами и кетонами Нитроспирты легко дегидратируются с образованием непредельных нитросоединений. Реакция восстановления. При восстановлении нитроалканов образуются алкиламины: 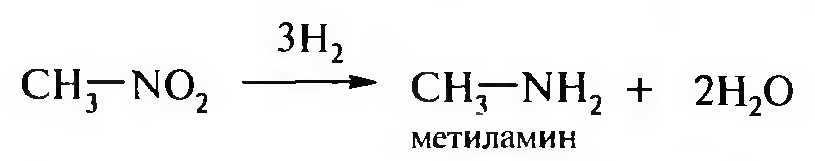 34.16. Схема реакции восстановления нитроалканов Нитросоединения алифатического ряда обладают сильным местным раздражаюшим действием и являются относительно токсичными веществами. Они относятся к клеточным ядам общего действия, особенно опасны для печени. Очень токсичны хлорсодержащие нитропарафины и непредельные нитросоединения. 34.4. Нитросоединения ароматического ряда (нитроарены) К нитросоединениям алифатического ряда относятся вещества, у которых нитрогруппа связана с ароматическим кольцом или входит в состав бокового радикала аренов . 34.4.1. Способы получения Нитрованиеаренов. Нитросоединения, содержащие нитрогруппу, связанную с ароматическим радикалом, получают нитрованием аренов смесью концентрированных азотной и серной кислот, называемой «нитрующей смесью». Реакция протекает по механизму электрофильного замещения (SЕ).  Максимально в бензольное ядро можно ввести три нитрогруппы. Нитрогруппа настолько дезактивирует бензольное ядро, что для введения второй нитрогруппы требуются более жесткие условия, а третья вводится с большим трудом. Введение нитрогруппы в боковую цепь. Введение нитрогруппы в боковую цепь осуществляется по реакции Коновалова разбавленной азотной кислотой при повышенной температуре и давлении. Реакция протекает по радикальному механизму (SR). 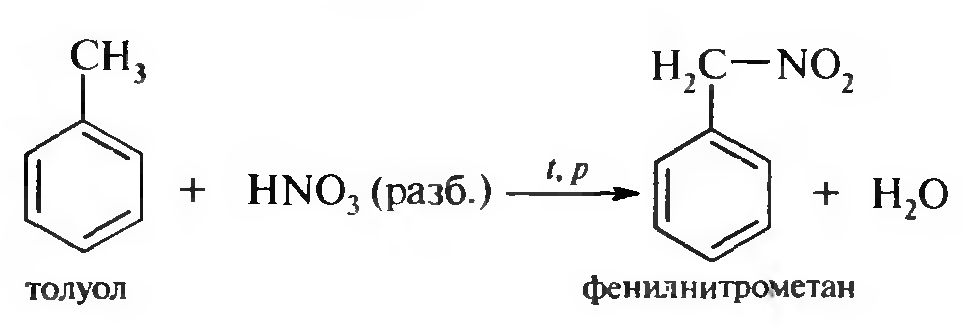 Другим способом введения нитрогруппы в боковую цепь является реакция взаимодействия алкилгалогенидов с солями азотистой кислоты: 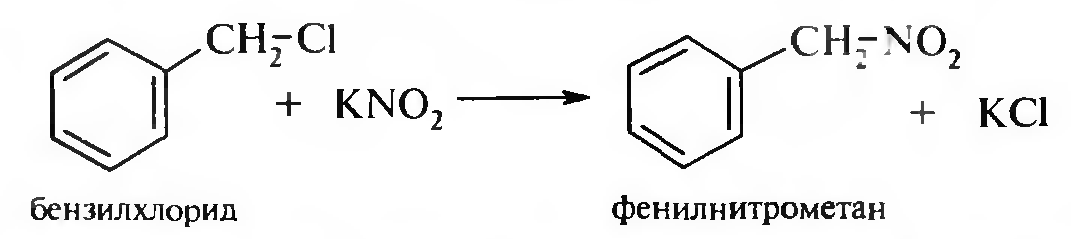 Физические свойства. По физическим свойствам нитросоединения ароматического ряда — это жидкие или кристаллические бесцветные или окрашенные в желтый цвет вещества с приятным запахом горького миндаля, не растворимые в воде, имеют высокие температуры кипения и плавления. 34.4.2.Химические свойства Обладая электроноакцепторными свойствами (-/, -М), нитрогруппа в целом понижает электронную плотность бензольного ядра, тем самым уменьшает его реакционную способность в реакциях электрофильного замещения (SЕ) и создает возможность для протекания реакций, идущих по механизму нуклеофильного замещения (SN). Для нитроаренов возможны реакции по нитрогруппе и по ароматическому ядру. Реакции с участием нитрогруппы Реакция восстановления (реакция Зинина). При восстановлении ароматических нитросоединений образуются ароматические амины. В зависимости от pH реакционной среды процесс восстановления может идти по двум направлениям, отличающимся образованием разных промежуточных продуктов. В нейтральной и кислой среде (pH < 7) в качестве промежуточных соединений образуются ароматические нитрозосоединения и арилгид- роксиламины: 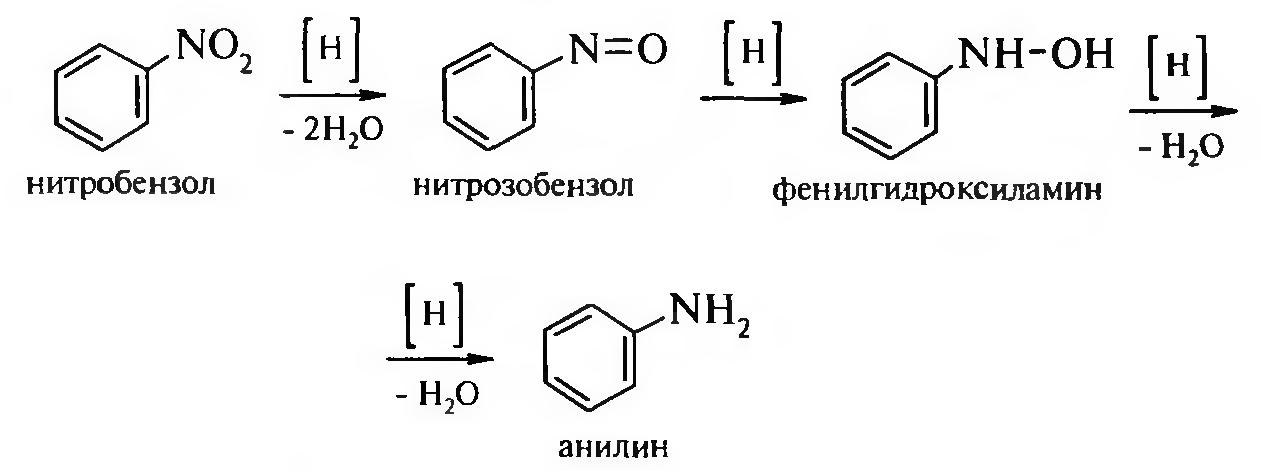 34.16. Схема реакции восстановления нитроаренов в кислой и нейтральной среде В щелочной среде (pH >7) происходит конденсация образующихся в процессе реакции нитрозосоединений с арилгидроксиламином и образуются азоксисоединения. Последние присоединяют водород и превращаются в гидразосоединения, которые, в свою очередь, легко переходят в ариламины: 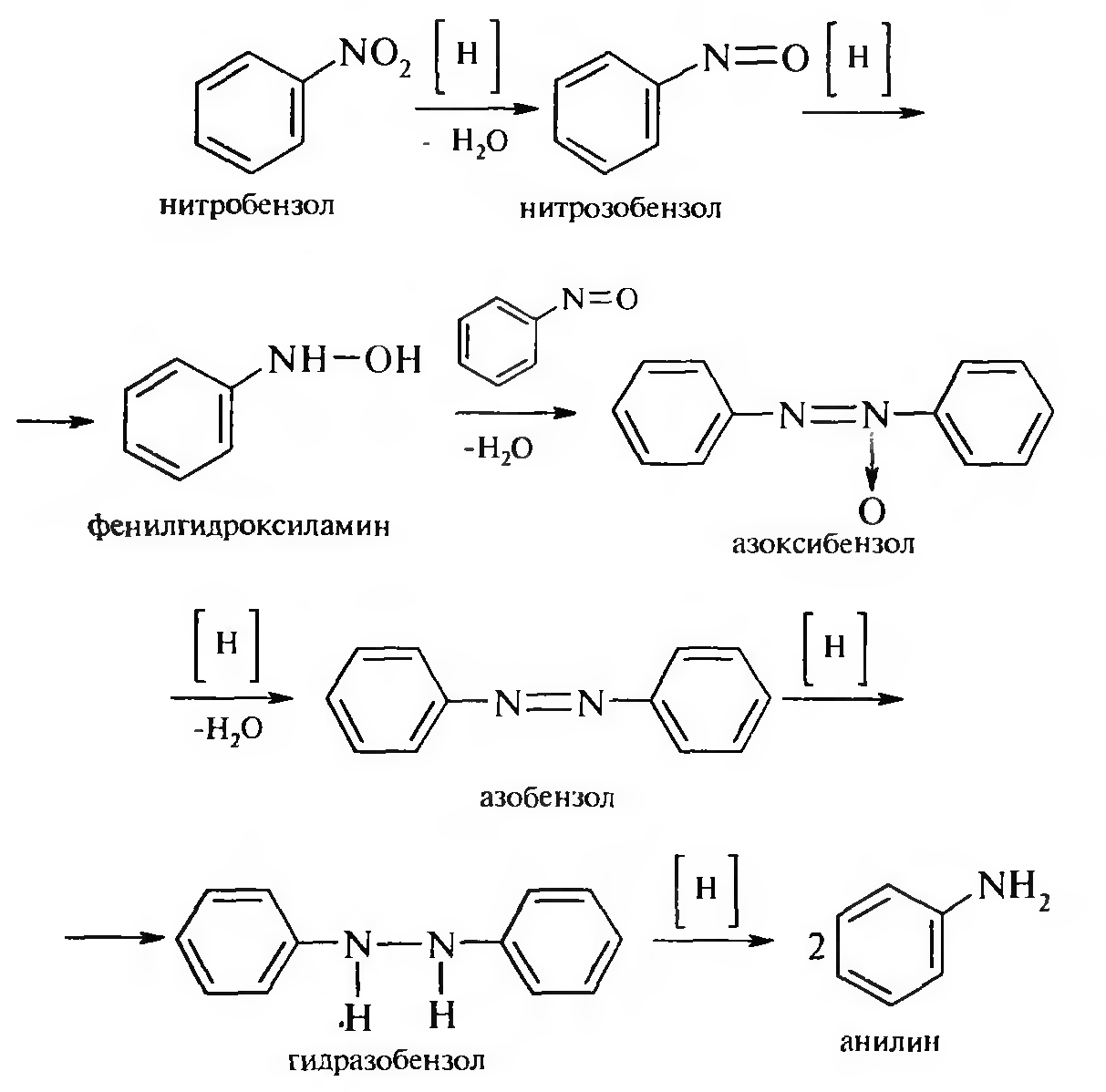 34.16. Схема реакции восстановления нитроаренов в щелочной среде Реакцию восстановления нитроаренов в щелочной среде (рН>7) можно остановить на любой из приведенных стадий. Она служит основным способом получения азо- и гидразосоединений. Реакция открыта в 1842 году русским ученым Н.Н. Зининым. Реакции по ароматическому ядру Реакции электрофильного замещения (SE). Под влиянием нитро- группы (-/; -М) понижается реакционная способность бензольного ядра в реакциях электрофильного замещения. Так, нитробензол не алкилируется в условиях реакции Фриделя — Крафтса, но может вступать в реакции нитрования, галогенирования, сульфирования с образованием мета-замещенных нитроаренов: 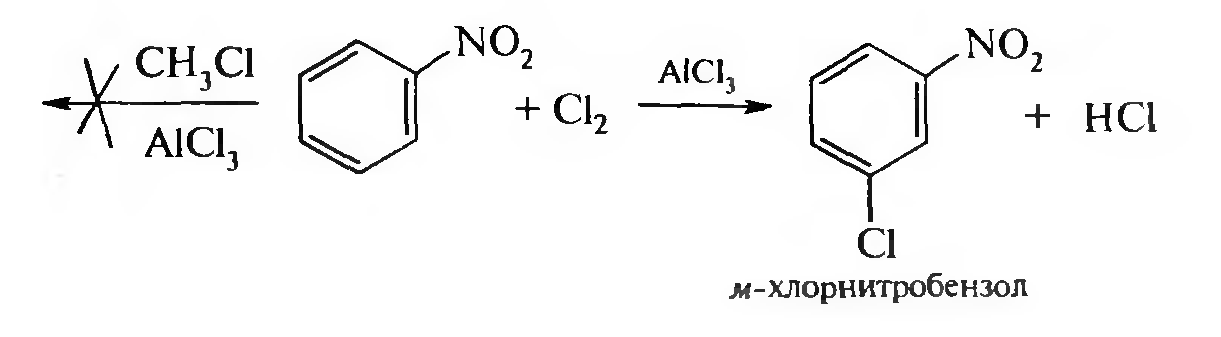 34.17. Реакции электрофилного замещения: галогенирование Реакции нуклеофильного замещения (SN). Пониженная электронная плотность в ароматическом ядре нитроаренов создает возможность для протекания реакций нуклеофильного замещения в аренах. В реакциях SN нитрогруппа направляет заместитель в орто- и пара-положения: 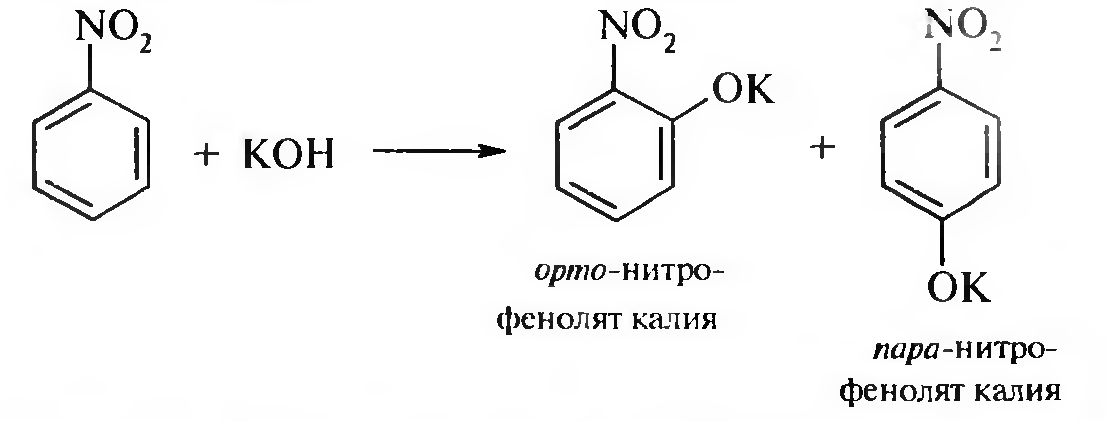 34.18. Реакции нуклеофильного замещения: образование нитрофенолята калия Соединения, содержащие две и более нитрогруппы, придают повышенную подвижность атомам водорода, находящимся в орто- и пара-положениях бензольного ядра. Так, сам нитробензол не окисляется, а динитробензол окисляется легко. 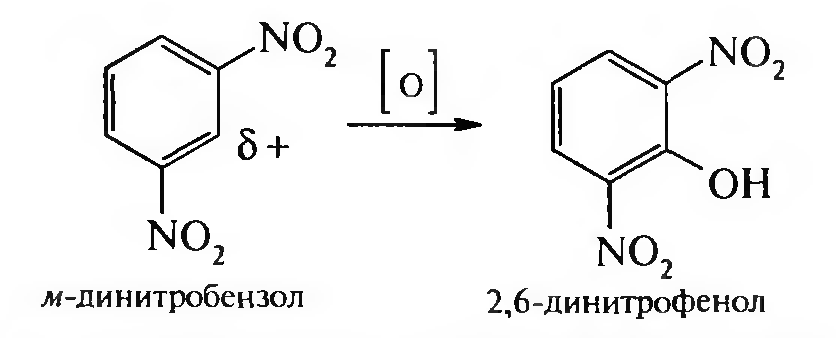 34.19. Реакция окисления динитробензола По этой же причине легко замещается атом хлора в молекуле о-нитрохлорбензола. Это позволяет получать различные нитропроизводные ароматического ряда: 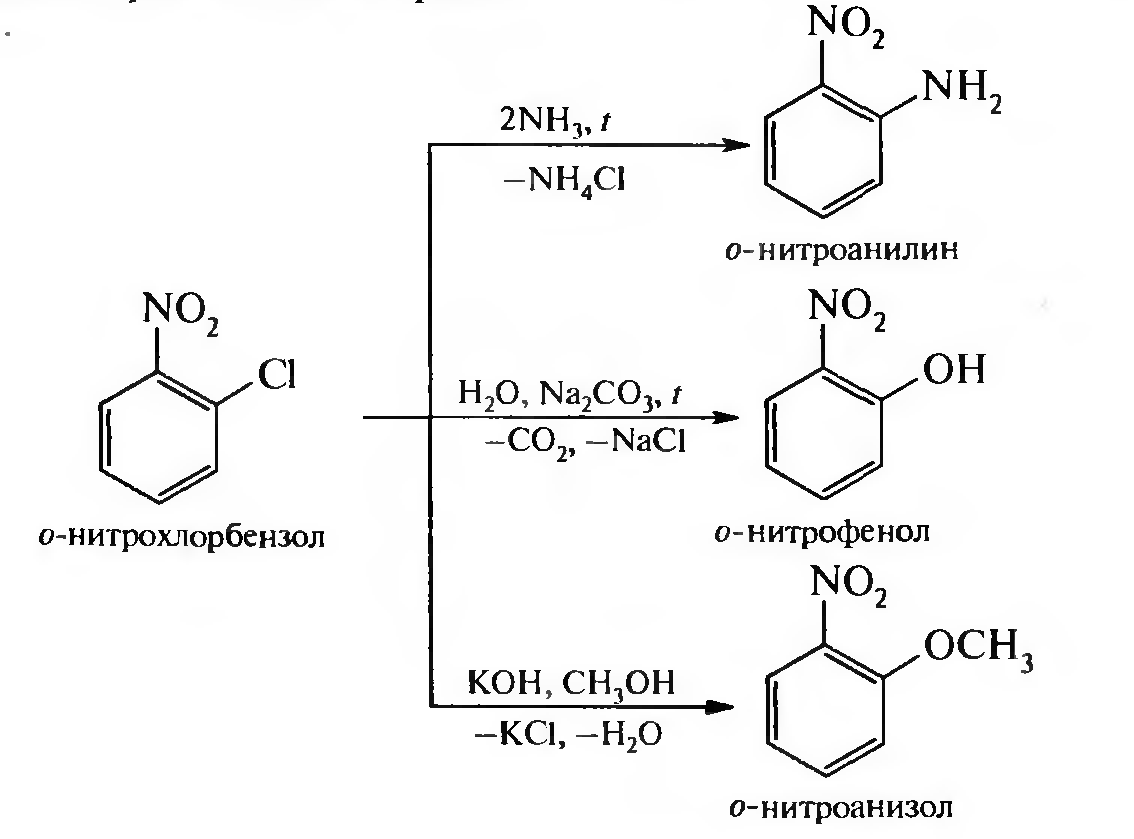 34.20. Реакции замещения нитрохлорбензола Нитросоединения ароматического ряда имеют большое значение. Это исходные вещества в производстве синтетических красителей, полимеров, моющих средств и ингибиторов коррозии. Ряд нитросоединений находят применение в качестве биологически активных веществ. Так, эфиры фосфорной кислоты, содержащие нитроарильные фрагменты, являются инсектицидами, производные 2,4-динитрофенола — гербициды; на основе нитропроизводных, обладающих антибактериальным действием, созданы лекарственные препараты (левомицетин, синтомицин, фуразолидон и др.). Некоторые ароматические нитросоединения применяются как душистые вещества. Ароматические нитросоединения угнетают нервную и особенно кровеносную системы, нарушая снабжение организма кислородом. |
