Аминокислоты белков, их классификация. Заменимые и незаменимые аминокислоты Аминокислоты
 Скачать 0.51 Mb. Скачать 0.51 Mb.
|
|
Аминокислоты белков, их классификация. Заменимые и незаменимые аминокислоты Аминокисло́ты (аминокарбо́новые кисло́ты; АМК) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы. Основные химические элементы аминокислот — это углерод (C), водород (H), кислород (O) и азот (N), хотя другие элементы также встречаются в радикале определенных аминокислот. Аминокислоты различаются структурой боковых радикалов , которые имеют разные размеры, форму, реакционную способность, определяют растворимость аминокислот в водной среде и их электрический заряд. Классификация аминокислот Аминокислоты можно классифицировать по различным признакам, например: по структуре углеводородного радикала, функциональным группам, содержанию или отсутствию серы, по способности синтезироваться в организме животных и человека и др. Заменимые аминокислоты – это аминокислоты, поступающие в организм человека с белковой пищей, либо образующиеся в организме из иных аминокислот. Незаменимые аминокислоты – это аминокислоты, которые не могут быть получены в организме человека с помощью биосинтеза, поэтому должны постоянно поступать в виде пищевых белков. Их отсутствие в организме приводит к явлениям, угрожающим жизни. Заменимыми аминокислотами являются: тирозин, глутаминовая кислота, глутамин, аспарагин, аспарагиновая кислота, цистеин, серин, пролин, аланин, глицин. Незаменимыми аминокислотами для взрослого здорового человека являются аминокислоты фенилаланин, триптофан, треонин, метионин, лизин, лейцин, изолейцин и валин; Для детей, дополнительно, гистидин и аргинин. Полипептидная теория строения белков. Уровни структуры белковой молекулы Общепризнанной теорией строения белков является полипептидная теория, у истоков которой стояли русский ученый Данилевский А.Я. и выдающийся немецкий химик Фишер. Данилевский еще в 1888 году предположил, что отдельные составные части белка соединяются между собой связью - CO-NH - , тем не менее часть разработки полипептидной теории строения белков принадлежит Эмилю Фишеру. Суть этой теории проста, белки состоят из аминокислот, а аминокислоты соединены между собой.  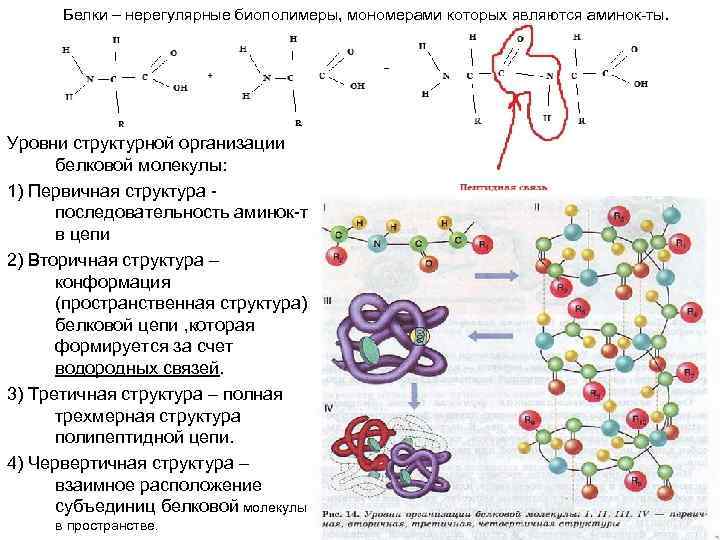 Физико-химические свойства пептидов и белков Физико-химические свойства белков: растворимость, ионизация, гидратация, денатурация и ренатурация. -Способность белков к денатурации. Под денатурацией белка понимают нарушение нативной конформации белковой молекулы, приводящее к уменьшению или полной потере ее растворимости, изменению других физико-химических свойств, утрате специфической биологической активности. Денатурация не сопровождается разрывом пептидных связей и нарушением первичной структуры белка. Происходит расщепление дисульфидных мостиков, гидрофобных, ионных, водородных связей. В результате нарушается третичная структура и в значительной мере вторичная. Денатурацию белка вызывают как физические, так и химические факторы. К физическим денатурирующим факторам относятся: нагревание, ультрафиолетовый свет, высокое давление, механические воздействия, ультразвук. К химическим факторам денатурации относятся: тяжелые металлы, органические растворители, минеральные и органические кислоты, экстремальные значения рН, ионные детергенты. Ионизация белка и зависимость заряда от рН среды. Благодаря наличию в своем составе свободных амино- и карбоксильных групп белки являются полиэлектролитами (амфотерными электролитами). Белки в растворах находятся преимущественно в виде биполярных ионов (цвиттерионов, амфионов). Растворимость белков в воде возрастает при добавлении небольших количеств нейтральных солей (сульфат аммония, сульфат натрия, сульфат магния). Небольшие концентрации солей увеличивают степень диссоциации ионизированных групп, экранируют заряженные группы белка и тем самым уменьшают белок-белковое взаимодействие. Под гидратацией понимается связывание диполей воды с ионными и полярными группами белка, такими как –СОО- , -NН3+, -СОNH2, -OH, -SH, в результате чего образуется гидратная оболочка белков. Благодаря этому каждая молекула белка покрывается несколькими молекулярными слоями воды, т.е. одна молекула белка отделена от другой слоем воды и находится в состоянии истинного раствора. Ренатурация белка - это обратный переход молекулы белка из денатурированного (неактивного) состояния в нативное (активное). Друими словами, это процесс, обратный процессу денатурации. Химические свойства пептидов. =Основным свойством пептидов является их способность к гидролизу. При гидролизе происходит полное или частичное разрушение цепи, после чего образуются пептиды более короткого строения. Полный гидролиз происходит при длительном нагревании пептида с концентрированной соляной кислотой. Классификация белков и их биологические функции 1. По форме молекулы -Глобулярные – соотношение продольной и поперечной осей составляет больше 10.Например: инсулин,альбумин,плазмы крови. -Фибриллярные-соотношение осей менше10. Они состоят из пучков полипептидных цепей, спиралью навитых друг на друга и связанные между собой поперечными ковалентными и водородными связями. Выполняют защитную и структурную функции. Например: кератин, миозин, коллаген. 2. По количеству белковых цепей в одной молекуле мономерные – имеют одну субъединицу (протомер), например альбумин, миоглобин. o полимерные – имеют несколько субъединиц. Например, гемоглобин (4 субъединицы), лактатдегидрогеназа (4 субъединицы), креатинкиназа (2 субъединицы), 3. По химическому составу Простые – содержат в составе только аминокислоты (альбумины, глобулины, гистоны, протамины). Подробно эти белки характеризуются ниже. Сложные – кроме аминокислот имеются небелковые компоненты (нуклеопротеины, фосфопротеины, металлопротеины, липопротеины, хромопротеины, гликопротеины). Подробно эти белки характеризуются ниже.  Химический состав нуклеиновых кислот. ДНК и РНК Существуют два типа нуклеиновых кислот: ДНК и РНК. Дезоксирибонуклеиновая кислота – ДНК ДНК – биологический полимер, состоящий из двух полинуклеотидных цепей, соединенных друг с другом. ДНК – полимер с очень большой молекулярной массой. Мономеры, составляющие каждую из цепей ДНК, представляют собой сложные органические соединения, включающие азотистые основания: аденин (А) или тимин (Т), цитозин (Ц) или гуанин (Г), пятиатомный сахар – пентозу – дезоксирибозу, по имени которой получила название и сама ДНК, а также остаток фосфорной кислоты. Эти соединения носят назв Нуклеиновые кислоты - это линейные нерегулярные полимеры. Мономерами РНК служат рибонуклеотиды, а мономерами ДНК - дезоксирибонуклеотиды. Каждый нуклеотид (рибонуклеотид или дезоксирибонуклеотид) состоит из трех частей: 1) остатка фосфорной кислоты, 2) пятиуглеродного моносахарида в циклической форме - D-рибозы (в случае РНК) или 2- дезокси-D-рибозы (в случае ДНК), 3) азотистого основания. В состав РНК входят только четыре типа рибонуклеотидов, азотистые основания которых представлены аденином (A), урацилом (U), гуанином (G) и цитозином (C), а в состав ДНК - дезоксирибонуклеотиды четырех видов, азотистыми основаниями которых являются аденин (A), тимин (T), гуанин (G) и цитозин (C). Последовательно расположенные нуклеотиды в молекулах ДНК и РНК ковалентно связаны между собой в цепь через остаток фосфорной кислоты: 5'- гидроксильная группа моносахарида одного нуклеотида присоединена к 3'-гидроксильной группе моносахарида соседнего нуклеотида с помощью ФОСФОДИЭФИРНОЙ СВЯЗИ. 6. Структура нуклеиновых кислот. Локализация в клетке и их биологические функции. СТРУКТУРА. Различают четыре уровня структурной организации нуклеиновых кислот: первичную, вторичную, третичную и четвертичную структуры. Первичная структура представляет собой цепочки из нуклеотидов, соединяющихся через остаток фосфорной кислоты (фосфодиэфирная связь). Вторичная структура — это две цепи нуклеиновых кислот, соединённые водородными связями. Стоит отметить, что цепи соединяются по типу «голова-хвост» (3' к 5'), по принципу комплементарности (азотистые основания находятся внутри этой структуры). Третичная структура, или же спираль, образуется за счет радикалов азотистых оснований (образуются водородные дополнительные связи, которые и сворачивают эту структуру, тем самым обуславливая её прочность). И, наконец, четвертичная структура — это комплексы гистонов и нитей хроматина. Поскольку в нуклеотидах существует только два типа гетероциклических молекул, рибоза и дезоксирибоза, то и имеется лишь два вида нуклеиновых кислот — дезоксирибонуклеиновая (ДНК) и рибонуклеиновая (РНК). ЛОКАЛИЗАЦИЯ: Локализация нуклеиновых кислот в клетке. Локализация ДНК и РНК в клетке различна. ДНК локализована в ядре клетки, РНК – в ядре и цитоплазме. Только тРНК находится преимущественно к цитоплазме в растворенном виде. Как правило, нуклеиновые кислоты (ДНК и РНК) в живой клетке находятся в форме нуклеопротеинов. Основные структуры, содержащие нуклеопротеины, - это хроматин, где локализована ДНК, и рибосомы, где локализована РНК. Функции:  Классификация и номенклатура витаминов. Биологическая роль витаминов Номенклатура и классификация витаминов Витамины называются по: - буквам латинского алфавита (А, С, Д, В1 – В15, Р и др.); 64 - обозначению основного биологического эффекта (лишь для отдельных витаминов), например, витамин роста, антиневритный витамин и т. д.; - способности витамина предотвращать или устранять соответствующее заболевание (с приставкой “анти”) – антипеллагрический, антицинготный и т. д.; - особенностям химической структуры (рибофлавин, никотинамид и др.) Витамины делятся на 3 группы: - водорастворимые (витамины группы В, С, Р, РР, Н и др.). В составе этих соединений значительную роль играют электрофильные элементы (N, O, S), поэтому их молекулы полярны и гидрофильны; - жирорастворимые (витамины А, Д, Е, К, F), являющиеся производными углеводородов и поэтому неполярны, гидрофобны; - витаминоподобные вещества, способные частично синтезироваться в организме и обладающие витаминными свойствами – холин, липоевая кислота, инозит, р-аминобензойная кислота и другие Биологическая роль витаминов. Витамины участвуют в обмене веществ в организме двумя путями: -входят в состав коферментных или простетических групп ферментов; -непосредственно участвуют в протекании отдельных химических реакций (например, витамины С, Р, жирорастворимые витамины) Жирорастворимые витамины А, Д, Е, К и водорастворимые витамины группы В и витамины С, Р, Q U. Жирорастворимые: Витамин А - ретинол обеспечивает: процессы роста и размножения; функционирование кожного эпителия и костной ткани; поддержание имуннологического статуса; восприятие света сетчаткой глаза. Витамин Д - кальциферол чрезвычайно важен для новорожденного ребенка, без этого витамина невозможно нормальное формирование скелета. Витамин Е - токоферол одиниз основных антиоксидантов нашего организма, инактивирующий свободные радикалы и предотвращающий разрушение клеток Витамин К - обеспечивает в синтез в печени некоторых факторов свертывания крови, участвует в формировании костной ткани Витамин С - аскорбиновая кислота участвует чуть ли не во всех биохимических процессах организма. Обеспечивает: нормальное развитие соединительной ткани; заживление ран. Водорастворимые Витамин В1 - тиамин обеспечивает проведение нервных импульсов. Витамин В2 - рибофлавин обеспечивает: окисление жиров; защиту глаз от ультрафиолета. Витамин В3 - ниацин (витамин РР) обеспечивает «энергетику» практически всех протекающих в организме биохимических процессов. Витамин В6 - пиридоксин обеспечивает: усвоение белка; производство гемоглобина и эритроцитов; равномерное снабжение клеток глюкозой. Витамин В12 - кобаламин обеспечивает: нормальный процесс кроветворения; работу желудочно-кишечного тракта Витамин U выполняет в организме ряд полезных функций. В первую очередь стоит отметить его противоязвенную активность. Другой очень важный эффект - антигистаминное действие Функции витамина Р в организме во многом повторяют функции, выполняемые витамином С. В ряде процессов они участвуют вместе, усиливая полезные эффекты друг друга. Витамин Q (КоQ, убихинон) - распространенное жирорастворимое витаминоподобное вещество, находящееся в клеточных структурах - митохондриях. Убихинон - это нерастворимые в воде легкоплавкие кристаллы или тягучая жидкость. Витамин Q близок по строению к витаминам K и E, он разрушается в щелочной среде и при термической обработке. Строение ферментов. Номенклатура и классификация. Классификация и номенклатура ферментов Классификация ферментов основана на типе катализируемой химической реакции; На основании 6 типов химических реакций ферменты, которые их катализируют, подразделяют на 6 классов, в каждом из которых несколько подклассов и поподклассов (4-13); Каждый фермент имеет свой шифр КФ 1.1.1.1. Первая цифра обозначает класс, вторая – подкласс, третья – подподкласс, четвертая – порядковый номер фермента в его подподклассе (в порядке открытия). Название фермента состоит из 2 частей: 1 часть – название субстрата (субстратов), 2 часть – тип катализируемой реакции. Окончание – АЗА; Дополнительная информация, если необходима, пишется в конце и заключается в скобки: L-малат + НАДФ+ ↔ ПВК + СО2 + НАДН2 L-малат: НАДФ+ – оксидоредуктаза (декарбоксилирующая); В правилах названия ферментов нет единого подхода. 1. Оксидоредуктазы 2. Трансферазы 3. Гидролазы. Расщепляют ковалентную связь с присоединением молекулы воды. 4. Лиазы 5. Изомеразы 6. Лигазы (синтетазы) Ферменты: строение и свойства. Ферменты – это специфические белки, которые действуют как катализаторы в биологических системах. Являясь веществами белкой природы, ферменты обладают всеми свойствами белков: гидролизуются до аминокислот дают положительные цветные реакции на белки (биуретовую, ксантопротеиновую). подобно всем белкам растворяются в воде с образованием коллоидных растворов. являются амфотерными соединениями. склонны к денатурации под влиянием тех же факторов: температуры, изменениях рН, действием солей тяжелых металлов, действием физических факторов (ультразвук, ионизирующее излучение и др.). наличие нескольких уровней организации макромолекул, подтвержденное данными ренгеноструктурного анализа. В отличии от других белков ферменты обладают каталитическими свойствами. При этом, обладая свойствами, присущими неорганическим катализаторам, белки существенно отличаются от них рядом свойств Понятие о центрах ферментов и механизм действия ферментов. В составе фермента выделяют области, выполняющие различную функцию: 1. Активный центр– комбинация аминокислотных остатков (обычно 12-16), обеспечивающая непосредственное связывание с молекулой субстрата и осуществляющая катализ. У ферментов, имеющих в своем составе несколько мономеров, может быть несколько активных центров по числу субъединиц. Также две и более субъединицы могут формировать один активный центр. У сложных ферментов в активном центре обязательно расположены функциональные группы кофактора. 2. Аллостерический центр (allos– чужой) – центр регуляции активности фермента, который пространственно отделен от активного центра и имеется не у всех ферментов. Аллостерические ферменты в большинстве случаев являются белками с четвертичной структурой, при этом активный и регуляторный центры могут находиться в разных субъединицах. Механизм действия ферментов Действие ферментов можно разделить на несколько этапов, в частности: первый этап подразумевает присоединение субстрата к энзиму, вследствие чего формируется фермент-субстратный комплекс; второй этап заключается в преобразовании полученного комплекса в один или сразу несколько переходных комплексов; третий этап – образование комплекса фермент-продукт; и, наконец, четвертый этап подразумевает разделение конечного продукта реакции и фермента, остающегося в неизменном виде. Строение, нахождение в природе и биологическое значение моносахаридов. Моносахариды – это простейшие углеводные соединения, имеющие в своем составе одно звено. Они являются мономерами, остатки которых образуют более сложные углеводные соединения: дисахариды, олигосахариды, полисахариды. Строение моносахаридов часто представляют в виде незамкнутой углеродной цепи с карбонильной группой. выполняют энергетическую функцию (образование АТФ из АДФ). •выполняют пластическую функцию (участвуют в образовании ди-, олиго-, полисахаридов, аминокислот, липидов, нуклеотидов). • выполняют детоксикационную функцию (производные глюкозы, глюкурониды, участвуют в обезвреживании токсичных метаболитов и ксенобиотиков) Олиго и полисахариды. Строение, свойства, биологическая роль. К олигосахаридам относят соединения, молекулы которых построены из остатков циклических форм моносахаридов. Полисахариды нерастворимы в воде и не имеют сладкого вкуса. Так как к одному остатку моносахарида может быть присоединено несколько других остатков, полисахариды могут иметь разветвленную структуру. В живых организмах наиболее широко распространены полимеры глюкозы — крахмал, гликоген и целлюлоза. Одними из важнейших полисахаридов являются полимеры из остатков глюкозы — крахмал, гликоген и целлюлоза. Свойства полисахаридов значительно отличаются от свойств их мономеров и зависят не только от состава, но и от строения (в частности, разветвлённости) молекул. Они могут быть аморфными или даже нерастворимыми в воде.Если полисахарид состоит из одинаковых моносахаридных остатков, он называется гомополисахаридом или гомогликаном, а если из разных — гетерополисахаридом или гетерогликаном. Превращение углеводов в процессе пищеварения; условия и ферменты реакций Углеводный обмен, или метаболизм углеводов в организмах животных и человека. Метаболизм углеводов в организме человека состоит из следующих процессов: Расщепление в пищеварительном тракте поступающих с пищей поли- и дисахаридов до моносахаридов, дальнейшее всасывание моносахаридов из кишечника в кровь. Синтез и распад гликогена в тканях Гликолиз — распад глюкозы. Анаэробный путь прямого окисления глюкозы или, как его называют, пентозофосфатный путь (пентозный цикл). Взаимопревращение гексоз. Анаэробный метаболизм пирувата. Этот процесс выходит за рамки углеводного обмена, однако может рассматриваться как завершающая его стадия: окисление продукта гликолиза — пирувата. Глюконеогенез — образование углеводов из неуглеводных продуктов Пути распада полисахаридов: гидролиз и фосфоролиз. Пути внутриклеточного распада моносахаридов. Реакция фосфоролиза заключается в присоединении фосфорной кислоты по месту разрыва гликозидной связи между остатками моносахаридов в молекулах олиго- или полисахаридов. Реакции фосфоролиза ускоряются специфическими ферментами — фосфорилазами (гликозилтрансферазами), причем фосфоролитическому расщеплению подвергаются лишь 1,4-гликозидные связи. Поэтому в случае фосфоролиза, например, амидопектина распад прекращается в точках разветвления молекулы, где имеются 1,6-связи. Дальнейший фосфоролиз будет происходить лишь после расщепления 1,6-связей в остаточном декстрине при посредстве амило-1,6-гликозидазы. Таким образом, при распаде олиго- и полисахаридов возникают свободные моносахариды или их фосфорные эфиры. В дальнейшем обмене моносахаридов участвуют только их фосфорные эфиры, свободные же монозы фосфорилируются, превращаясь в фосфорные эфиры, представляющие собой гораздо более реакционноспособные соединения по сравнению со свободными моносахаридами. Фосфорилирование моносахаридов осуществляется при их взаимодействии с АТФ и ускоряется ферментами — фосфотрансферазами, носящими название киназ. Фосфорилирование глюкозы идет по схеме: глюкокиназа Глюкоза + АТФ → Глюкозо-6-фосфат + АДФ. В природе обнаружено около двух десятков индивидуальных фосфотрансфераз, переносящих остатки фосфорной кислоты от АТФ. Процесс обмена углеводов протекает через некоторые их формы, занимающие ключевые позиции (например, глюкозо-6-фосфат и рибулозо-5-фосфат). Глюкозо-6-фосфат образуется в организме разными путями, в том числе при фосфорилировании глюкозы, и, за счет изомеризации (при участии фермента фосфоглюкомутазы) глюкозо-1-фосфата, который образуется в свою очередь в процессе фосфоролиза олиго- и полисахаридов. Глюкозо-6-фосфат подвергается разнообразным превращениям. В процессе его окислительного распада запасается энергия в макроэргических связях АТФ. Кроме того, многие из промежуточных продуктов, образующихся при обмене глюкозо-6-фосфата, используются для синтеза аминокислот, нуклеотидов, глицерина, высших жирных кислот и т. п. Катаболизм глюкозо-6-фосфата осуществляется преимущественно двумя путями: дихотомическим (гликолиз), когда на определенной стадии молекула распадается пополам, апотомическим (пентозофосфатный путь), когда молекула теряет первый углеродный атом. |
