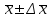курсовая работа фармхимия анализ сульфаниламидов. Курсовая фх. Анализ качества лекарственных средств из группы сульфаниламидов
 Скачать 163.85 Kb. Скачать 163.85 Kb.
|
|
Фармацевтический факультет КАФЕДРА ФАРМАЦЕВТИЧЕСКОЙ, ТОКСИКОЛОГИЧЕСКОЙ И АНАЛИТИЧЕСКОЙ ХИМИИ КУРСОВАЯ РАБОТА по дисциплине ФАРМАЦЕВТИЧЕСКАЯ ХИМИЯ ТЕМА: Анализ качества лекарственных средств из группы сульфаниламидов. Исполнитель: Жиляев А.Н. курс 5 группа 3 Руководитель: доцент, к.ф.н Нестерова А.В. Дата сдачи курсовой______________________ Оценка_________________________________ Подпись руководителя____________________ КУРСК – 2020 Содержание: Введение………………………………………………………….……3 Глава 1.Общая характеристика сульфаниламидов Классификация и структура сульфаниламидов………………………………………………………………8 Медицинское применение сульфаниламидов…..……………….11 Глава 2 Методы анализа качества сульфацила натрия Идентификация сульфацила натрия...….13 2.2 Испытание на чистоту …………………………….......……...…..13 2.3 Количественное определение……………………..………………17 Глава 3. Анализ качества сульфацила натрия 3.1 Органолептические свойства…………………………...…………18 3.2 Идентификация действующего компонента…………..…………18 3.3 Количественное определение……………………….…………….20 3.4 Статистическая обработка, заключение…………………………….25 Заключение……………………………………………………………..26 Список литературы……………………………………………………..27 Введение Испытание на идентификацию предназначено для подтверждения подлинности анализируемого вещества в образце. Количественное определение предназначено для определения количества анализируемого вещества в образце. Цель: Провести анализ качества лекарственных средств из группы сульфаниламидов. Для реализации поставленной цели необходимо решить следующие задачи: - изучить литературу по затронутой проблеме; - провести качественное и количественное определение раствора сульфацил натрия; - проанализировать и оценить результаты методики; Актуальность работы: Работа позволяет: - изучить основные методы анализа лекарственной формы -экспериментально произвести методики для анализа лекарственной формы Глава 1. Общая характеристика сульфаниламидов 1.1 Классификация и структура сульфаниламидов Химически сульфаниламиды являются производными амида сульфаниловой кислоты. В основе лежит парааминобензосульфоновая кислота.(Рис 1) 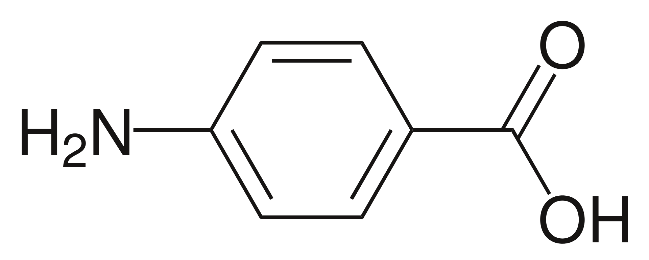 Рис 1 Все сульфаниламиды - белые или желтоватые порошки без запаха, некоторые горького вкуса. Большинство из них плохо растворимы в воде, лучше в разбавленных кислотах и водных растворах щелочей. Хорошей растворимостью обладает только сульфацил. Классификация сульфаниламидов учитывает особенности их всасывания и применения. I. Сульфаниламиды резорбтивного действия: а) непродолжительно действующие (назначаются через 4-6 ч, Т1/2 - 8-20 ч): сульфадимезин (сульфадимедин), уросульфан (сульфакарбамид), стрептоцид (сульфаниламид), этазол (сульфатидол), норсульфазол; б) средней длительности действия (Т1/2 - 10-24 ч): сульфадиазин (сульфазин), сульфаметоксазол, сульфазин; в) длительно действующие (назначаются через 12-24 ч, Т1/2 - 24-48 ч): сульфапиридазин (сульфаметоксипиридазин), сульфадиметоксин, сульфамонометоксин; г) сверхдлительно действующие (назначаются один раз в 2-7 дней, Т1/2 больше 48 ч): сульфален, сульфадоксин. Длительность действия хорошо всасывающихся сульфаниламидов зависит от реабсорбции их в почках и степени связывания с белками плазмы. II. Сульфаниламиды, действующие в просвете кишечника: фталазол (фтадилсульфатиазол), сульгин (сульфагуанидин), фтазин. Ш. Сульфаниламиды для местного применения (слабо выражено местное раздражающее действие): сульфацил-натрий (сульфацетамид), сульфадиазин серебра (сульфаргин), мафенид, альгимаф. Сульфаниламиды, хорошо всасывающиеся из желудочно-кишечного тракта, в печени и в крови ацетилируются, за исключением уросульфана и этазола, выделяющихся почками в неизмененном виде, а также сульфадиметоксина, образующего в печени растворимые глюкурониды. Выделяясь с мочой, ацетилированные сульфаниламиды в кислой среде могут выпадать в осадок (кристаллурия). У кормящих женщин сульфаниламиды в значительной степени экскретируются печенью и создают в желчи концентрации более высокие, чем в плазме крови. Для лечения инфекций мочевыводящих путей в основном применяется уросульфан. Следует специально отметить препараты, применяемые преимущественно для лечения неспецифического язвенного колита: салазопиридазин, салазодиметоксин, салазосульфапиридин. Месалазин не относится к сульфаниламидам, но по действию сходен с салазосульфанилпиридазином и аналогичными препаратами, применяемыми в лечении неспецифического язвенного колита и болезни Крона. В настоящее время широко применяют препараты сульфаниламидов в комбинации с триметопримом: сульфаметотоксазол + триметоприм (бисептол, бактрим, котримоксазол, селтрин, гросептол, дитрим), сульфамонометоксин + триметокрин (сульфатон), сульфаметрол + триметоприм (лидаприм). Триметоприм блокирует переход дигидрофолиевой кислоты в тетрагидрофолиевую и повышает анитмикробную активность сульфаниламидов. Применение в медицине. Препараты этой группы относятся к химиотерапевтическим средствам широкого антибактериального спектра действия, т.к. они подавляют жизнедеятельность многих видов Гр+ и Гр- бактерий: стрептококков, стафилококков, менингококков, гонококков, бактерий кишечно-тифозно-дизентерийной группы и многих других. Активны в отношении крупных вирусов (возбудителей трахомы), кокцидий, плазмодий малярии и токсоплазм, актиномицет и т. д. Сульфаниламидные препараты в небольших концентрациях задерживают рост и развитие бактерий, т. е. действуют бактериостатически. Бактерицидное влияние они оказывают лишь при воздействии таких высоких концентраций, которые небезопасны для макроорганизма. Механизм антимикробного действия сульфаниламидов связан с их конкурентным антагонизмом с парааминобензойной кислотой (ПАБК). ПАБК включается в структуру дигидрофолиевой кислоты, которую синтезируют многие микроорганизмы. Благодаря химическому сродству с ПАБК сульфаниламиды препятствуют ее включению в дигидрофолиевую кислоту. Кроме того, они конкурентно угнетают дигидроптероатсинтетазу. Нарушение синтеза дигидрофолиевой кислоты уменьшает образование из нее тетрагидрофолиевой кислоты, которая необходима для синтеза пуриновых и пиримидиновых оснований. В результате этого угнетается синтез нуклеиновых кислот, вследствие чего рост и размножение микроорганизмов подавляются. Некоторые сульфаниламиды проявляют конкурентный антагонизм и в отношении других ферментных систем, в частности они нарушают процесс декарбоксилирования пировиноградной кислоты, окисления глюкозы. Белковые вещества (гной, мертвые ткани), содержащие большое количество ПАБК, а также некоторые лекарственные препараты, в молекулу которых входит остаток ПАБК (новокаин, анестезин), являются ингибиторами активности сульфаниламидов. Для получения терапевтического эффекта их необходимо назначать в дозах, достаточных для предупреждения возможности использования микроорганизмами ПАБК, содержащейся в тканях. Прием сульфаниламидов в недостаточных дозах или слишком раннее прекращение лечения может привести к появлению устойчивых штаммов возбудителей. Воздействие сульфаниламидов на макроорганизм (жаропонижающий эффект, действуют противовоспалительно, стимулируют процесс фагоцитоза, повышают устойчивость организма к токсинам) и микроорганизм дополняют друг друга, обеспечивая хорошо выраженный терапевтический эффект. Большинство сульфаниламидов легко всасывается из желудочно-кишечного тракта и быстро накапливается в крови, органах и тканях в бактериостатических концентрациях. Очень хорошо всасываются натриевые соли препаратов. Некоторые, трудно всасываются, относительно долго находятся в кишечнике в высоких концентрациях и выделяются преимущественно с фекалиями. В крови, органах и тканях сульфаниламиды находятся в виде свободных соединений и в связанном с белками плазмы состоянии. В различных органах и тканях они распределяются неравномерно. Наибольшее количество их обнаруживают в почках, легких, стенках желудка и кишечника, сердце, печени. Сульфаниламиды хорошо проникают через плаценту. Большинство сульфаниламидов сравнительно быстро выводятся из организма животных. Они элиминируются в основном почками, молочными, потовыми, слюнными, бронхиальными и кишечными железами, а также печенью. Сульфаниламиды применяют для лечения инфекционных заболеваний дыхательных путей (трахеита, бронхита, пневмоний, гнойных плевритов и т. д.), желудочно-кишечных заболеваний различной этиологии (диспепсии, эймериоза, дизентерии, гастроэнтероколитов и т. д.); рожистого воспаления, мыта, послеродового сепсиса, пиелита, цистита, сальмонеллеза, колибактериоза, пастереллеза, раневых и других инфекций. Сульфаниламидные препараты малотоксичные. Однако длительное применение их в завышенных дозах может привести к развитию нежелательных, т. е. токсических эффектов: угнетению полезной микрофлоры желудочно-кишечного тракта, цианозу, лейкопении, анемии, В-авитаминозу, агранулоцитозу, общему угнетению. При недостаточной функции почек или при назначении больших доз препаратов могут возникать явления кристаллурии. Глава 2 Методы анализа качества сульфацила натрия 2.2 Общая характеристика сульфацила-натрия Сульфацил-натрий (Sulfacylum-natrium) Сульфацил растворимый (Sulfacylum solubile) Альбуцид-натрий (Albucid-natrium) 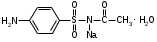 п-Аминобензолсульфонилацетамид-натрий C8H9N2NaO3S М. в. 254,24 Описание Белый кристаллический порошок без запаха. Растворимость Легко растворим в воде, практически нерастворим в спирте, эфире, хлороформе и ацетоне. Хорошая растворимость в воде позволяет использовать сульфацил-натрий для инъекций, растворы также закапывают в конъюнктивальный мешок. В глазной практике используют 10-20-30% растворы.[16] 2.2 Испытания на подлинность: Для испытаний подлинности сульфацила - натрия используют общие и частные реакции, обусловленные наличием тех или иных функциональных групп в молекуле.[2] 1) Реакция образования азокрасителя Реакция основана на образовании хлорида диазония в результате действия раствором нитрита натрия и разведенной хлороводородной кислотой. Последующее сочетание хлорида диазония в щелочной среде с β- нафтолом приводит к образованию азокрасителя. В результате реакции появляется вишнево-красное окрашивание или образуется осадок оранжево-красного цвета. (Рис.6)[15] 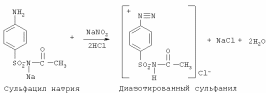  азокраситель 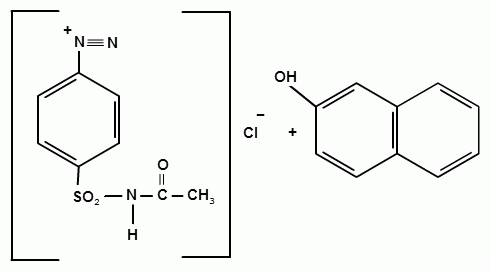 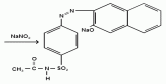 Рис.6 Реакция образования азокрасителя 2 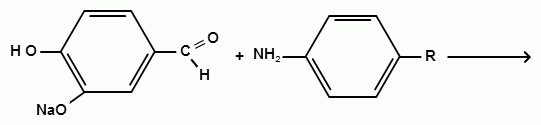 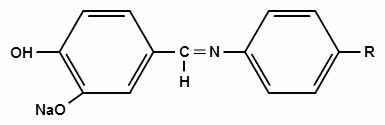 ) Лигниновая проба - основана на взаимодействии альдегидов с первичной ароматической группой, в результате образуются Шиффовы основания оранжево - желтого цвета. Выполняется на древесине или газетной бумаге. (рис.7)[15] Рис.7 Образование Шиффовых оснований 3) Реакция галогенирования (на ароматический цикл) Эта реакция основана на наличии донорной группы в ароматическом ядре молекулы сульфаниламида (заместитель первого рода). В результате образуется осадок. (Рис.8)[15] Р 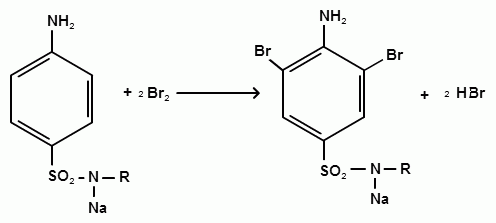 ис.8 Реакция галогенирования 4) Реакция образования комплексных солей О 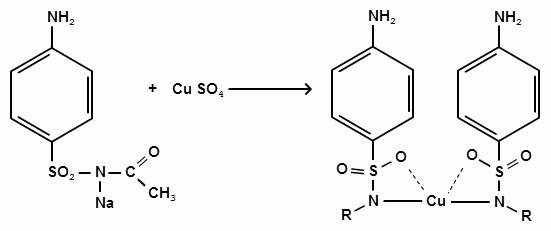 снована на образовании комплексных солей с меди сульфатом. Сульфацил-натрия образует комплекс голубовато - зеленого цвета. Эта реакция дает возможность отличать один препарат от другого. (Рис.9)[3] Рис.9 Реакция образования комплексных солей 5) Реакция окисления О 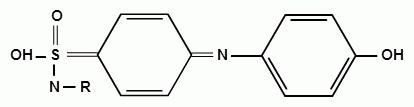 кисление происходит под действием кислорода воздуха. Так быстрое пожелтение раствора сульфацила-натрия свидетельствует о появлении окрашенных продуктов окисления хиноидной структуры типа индофенолов.(Рис.10)[3] Р 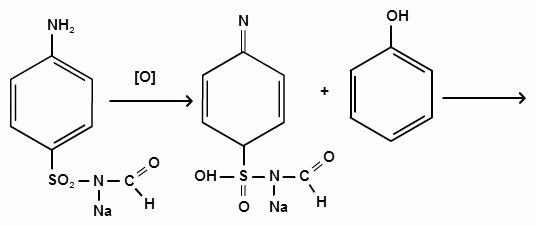 ис.10 Реакция окисления 6) Реакция обнаружения серы (в сульфамидной группе) Для открытия серы, необходимо окислить органическую часть молекулы концентрированной азотной кислотой, при этом сера переходит в сульфогруппу, которую легко можно обнаружить с раствором хлорида бария, образуется белый осадок(Рис.11)[3] : 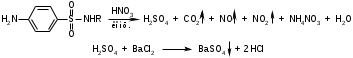 Рис.11 Реакция обнаружения серы Рис.11 Реакция обнаружения серы7) Реакция с нитропруссидом натрия. Раствор сульфацила-натрия в присутствии едких щелочей при добавлении 1% раствора нитропруссида натрия и последующем подкислении минеральной кислотой образует окрашенный в красный или красно-коричневый цвет раствор или осадок. (Рис.12)[3] 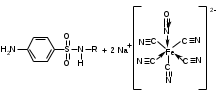 Рис.12 Реакция с нитропруссидом натрия 8) УФ- спектрофотометрия УФ-спектр 0,001%-ного раствора сульфацетамида натрия имеет максимум поглощения при 256 нм и минимум - при 227 нм.[16] Частные реакция определения сульфацил - натрия: 1) При действии на сульфацил-натрий уксусной кислотой выделяется бурый осадок сульфацетамида, который после высушивания должен иметь температуру плавления около 183° С (Рис.13)[17]:  Рис.13 Реакция с уксусной кислотой 2) При растворении осадка в этаноле и добавлении концентрированной серной кислоты образуется этилацетат, имеющий характерный запах(Рис.14)[17]: 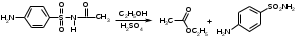 Рис.14 Реакция образования этилацетата 3)Для отличия натриевых солей от соответствующих сульфаниламидов выполняют реакцию на ион натрия - окраска пламени горелки в желтый цвет.[16] 2.3 Испытания на чистоту. Прозрачность и цветность. 5мл раствора должен быть прозрачным; окраска раствора не должна быть интенсивнее эталона № 6а рН = 7,5 – 8,7 (при помощи индикаторной бумаги или потенциометра) Испытания на посторонние примеси А) Хлориды. 1мл раствора в 10мл воды должны выдерживать испытания на хлориды (не более 0,01% в препарате). Б) Сульфаты. 2,5 мл раствора препарата в 10 мл воды должен выдерживать испытание на сульфаты (не более 0,02% в препарате). В) Тяжелые металлы. 5мл раствора препарата разводят в 17,5 мл воды, добавляют 2,5 мл разведенной уксусной кислоты, взбалтывают в течение 5 минут и выпавший осадок отфильтровывают. 10 мл фильтрата должны выдерживать испытание на тяжелые металлы (не более 0,001% в препарате).[16] 2.4 Количественное определение. Методы количественного определения: 1. Метод нитритометрии – определение основано на способности первичных аминов образовывать в кислой среде диазосоединения. [2] В качестве титранта используют нитрит натрия (0,1 М раствор). Титруют в присутствии бромида калия при 18-20°С или при 0-10°С. Бромид калия катализирует процесс диазотирования, а охлаждение реакционной смеси позволяет избежать потерь азотистой кислоты и предотвратить разложение соли диазония. Точку эквивалентности можно установить одним из трех способов: с помощью внутренних индикаторов (тропеолин 00, нейтральный красный, смесь тропеолина 00 с метиленовым синим); внешних индикаторов (йодкрахмальная бумага) или потенциометрически.(Рис.15) [2]  Рис.15 Образование диазосоединений 2. Броматометрия - метод основан на реакции галогенирования. Титруют раствором бромата калия в кислой среде в присутствии бромида калия. Конечную точку устанавливают при прямом титровании по обесцвечиванию (бромом) индикатора метилового оранжевого, а при обратном титровании – йодометрически.(Рис.16) [2] 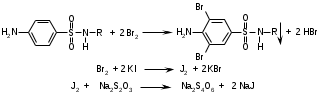 Рис.16 Броматометрическое титрование 3. Ацидометрия – основан на способности сульфацила-натрия образовывать с кислотами соли. Титруют 0,1М хлористоводородной кислотой в спирто-ацетоновой среде, индикатор – метиловый оранжевый. (Рис.17) [2] 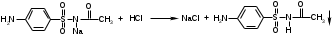 Рис.17 Реакция образования солей 4. Йодхлорметрия - метод основан на реакции галогегнирования. Иодирование осуществляется с помощью титрованного раствора иодмонохлорида. Избыток последнего устанавливают иодометрически(Рис.18)[2]: 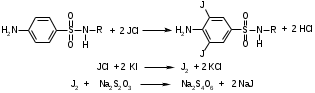 Рис.18 Йодхлорметрическое титрование 5. Гравиметрическое определение - для количественного определения используют реакцию минерализации сульфамидов при осторожном нагревании с не содержащим примеси сульфатов 30%-ным раствором перекиси водорода в присутствии следов хлорида железа (III). В результате получается светлая прозрачная жидкость, содержащая эквивалентное сульфаниламиду количество сульфат-ионов. Последние осаждаются раствором хлорида бария, осадок фильтруется, промывается, сушится до постоянного веса, взвешивается и пересчитывается на препарат.[2] Количественное определение физико-химическими методами: 1. Потенциометрическое титрование - является объемно-аналитическим методом, в котором конец титрования определяют по резкому изменению потенциала индикаторного электрода вблизи точки эквивалентности. Метод обладает высокой точностью, большой чувствительностью и позволяет проводить титрование в мутных, окрашенных, неводных средах, раздельно определять компоненты смеси в одном анализируемом растворе. Используется метод, когда для определения точки эквивалентности применение обычных индикаторов затруднено.[19] 2. Рефрактометрия – основана на измерении относительных показателей преломления жидкостей. Показатель преломления можно измерить с очень высокой точностью и небольшой затратой времени, располагая лишь малым количеством вещества. [19] 3. УФ-спектрофотометрия - основана на пропорциональной зависимости между светопоглощением и концентрацией поглощающего вещества. Метод осуществляется на приборах спектрофотометрах, которые снабжены монохроматором и кварцевой оптикой. Применяется для определения веществ, поглощающих видимый и УФ свет. В спектрофотометрическом анализе регистрируют спектр поглощения вещества, т.е. зависимость оптической плотности раствора от длины волны света. Является точным методом. [19] 4. ВЭЖХ - позволяют получить и качественную, и количественную информацию о веществе. В ВЭЖХ пробу вещества пропускают через специальный прибор - хроматограф, который регистрирует выходную кривую или хроматограмму. Каждый пик принадлежит одному компоненту смеси. По времени удерживания tR проводят идентификацию (качественный анализ) компонентов пробы. По высоте или площади пика можно определить количественное содержание данного компонента. [19] 5. Фотоколориметрия - метод основан на способности сульфаниламидов давать окрашенные продукты реакции с альдегидами, солями тяжелых металлов; для данного метода могут быть использованы и реакции образования азокрасителей. Сравнивая интенсивность окраски со стандартным раствором с применением ФЭК, можно судить о количественном содержании вещества в препарате. [19] Глава 3 Анализ качества 3.1 Органолептический анализ Sulfacylum-natrium Сульфацил-натрий Sulfacylum solubile Сульфацил растворимый Albucid-natrium Sulfacetamidum Natricum * п-Аминобензолсульфонилацетамид-натрий  C8H9N2Na2O3S • H2O Описание. Белый или желтовато-белый кристаллический порошок. Растворимость. Легко растворим в воде, практически нерастворим в спирте, эфире, хлороформе и ацетоне. 3.2 Испытания на подлинность 1) К 2-3 каплям сульфацила-натрия добавить 5-6 капель раствора хлористоводородной кислоты разведенной, 2-3 капли раствора натрия нитрита. Полученную смесь приливаем к 1-2мл β-нафтола. Раствор дает реакцию на первичные ароматические амины – образование азокрасителя -осадка красно-оранжевого цвета, переходящего в бурый (Рис.19):[6] 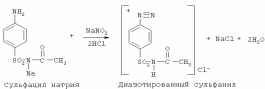   А Рис.19 Реакция с β-нафтолом Б 2  )К 5-6 каплям раствора сульфацила-натрия добавляем 0,5мл воды и 5 капель сульфата меди. Выпадает осадок голубовато-зеленого цвета, который не изменяется при стоянии (Рис.20)[6] Рис.20 Реакция с сульфатом меди Качественные реакции на ион Na+ : 1. Реакция проводится с помощью нихромовой проволоки, которую смачивают кислотой хлороводородной и обмакивают в исследуемом растворе, затем вносят в бесцветное пламя газовой горелки. Соли натрия окрашивают бесцветное пламя горелки в желтый цвет. Реакция чрезвычайно характерна. [6] Идентификация тиосульфата натрия: 1. В пробирку вносят 3—4 капли разбавленного раствора иода, имеющего желтую окраску, и прибавляют по каплям раствор натрия тиосульфата до обесцвечивания раствора иода.[6] 2Na2S2O3 + I2 = Na2S4O6 + 2NaI 3.3 Количественное определение 1. Метод нитритометрии – основан на реакции диазотирования Пипеткой отмериваем 2,5 мл раствора сульфацила натрия и помещаем в колбу объемом 100 мл. Добавляем 20 мл хлористоводородной кислоты и 50 мл воды очищенной. Отвешиваем 1г калия бромида и добавляем к полученной смеси, перемешиваем до полного растворения. Титруем 0,1М раствором нитрита натрия на холоду при температуре не выше 15°С, добавляя его в начале по 0,1-0,2 мл через 1 минуту, а в конце титрования (за 0,1 мл до точки эквивалентности) по 1-2 капли через 1 минуту до перехода окраски от фиолетовой до голубовато-зеленой.(Рис.21) [17] Точку эквивалентности определяем с помощью внутренних индикаторов – смеси 4 капель тропеолина00 и 2 капель метиленового синего.[17] 1 мл 0.1 моль/л раствора натрия нитрита эквивалентен 25.42 мг C8H9N2NaO3S.[16]  Рис.21 Нитритометрическое титрование Рассчитываем объем теоретический: 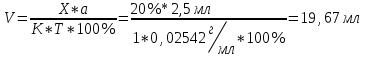 Результаты определения: Таблица 1
Рассчитываем содержание сульфацила-натрия по формуле(6): 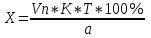 (6) (6)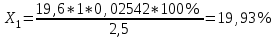 Х1 = 0,1993 г Х1 = 0,1993 г 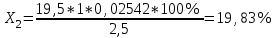 Х2 = 0,1983 г Х2 = 0,1983 г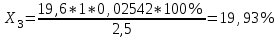 Х3 = 0,1993 г Х3 = 0,1993 г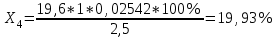 Х4 = 0,1993 г Х4 = 0,1993 г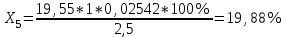 Х5 = 0,1988 г Х5 = 0,1988 г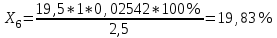 Х6 = 0,1983 г Х6 = 0,1983 г3.4 Статистическая обработка и представление результатов количественного определения нитритометрии 1) Рассчитаем среднее значение 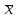 , отклонения di и сумму квадратов отклонений ∑i di2 , отклонения di и сумму квадратов отклонений ∑i di2 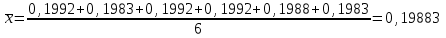 Таблица 3
∑i di2 = 0,000000136*3 + 0,00000028*2 + 0,0000000009 = 0,0000009689 2) Определяем стандартное отклонение: 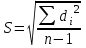 = =  0,0004402045 0,00044020453) Для оценки сходимости результатов параллельных определений рассчитываем величину относительного стандартного отклонения Sr: 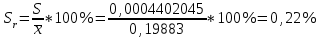 Значение Sr не превышает 2% - метод дает сходимые результаты 4) Определяем полуширину доверительного интервала среднего ∆ 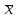 при n=6 и Р=0,95. при n=6 и Р=0,95. а)Коэффициент Стьюдента 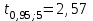 ( ГФ XI, Вып.1, с.249) ( ГФ XI, Вып.1, с.249)∆ 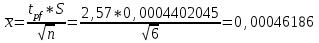 Доверительный интервал среднего 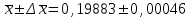 б) Относительная ошибка среднего 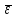 : :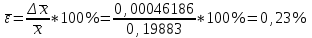 6)Составляем итоговую таблицу, представляющую результаты анализа Итоговая таблица Таблица 4
Заключение Цель курсовой работы была достигнута. Составили литературный обзор Сульфаниламидов. Провели органолептический, качественный и количественный анализ Сульфацил натрия. Список литературы 1. Автина Н.В. Разработка детской лекарственной формы на основе сульфаниламидов/ Н.В. Автина, Д.И. Писарев, И.В. Спичак// Научные ведомости БелГУ. –№4. – 2011 г. – С. 170-176. 2. Арзамасцев А.П., Печенников В.М., Родионова Г. М. и др. Анализ лекарственных смесей. М.: Компания Спутник. – 2000 г. – 275 с. 3. Беликов В. Г. Анализ лекарственных веществ фотометрическими методами. Опыт работы отечественных специалистов/ Российский химический журнал. – 2002 г. – Т. XLVI. – № 4. – С. 52 - 56. 4. Беликов, В. Г. Фармацевтическая химия: учебное пособие: в 2 ч. / В. Г. Беликов. – М.: МЕДпресс-информ. – 2009 г. – 616 с. 5. Бёккер, Ю. Спектроскопия / пер. с нем. Л. Н. Казанцевой. – М.: Техносфера, 2009 г. – 427 с. 6. Вергейчик Т.Х. Количественное обнаружение сульфаниламидов, современный подход к анализу// Т.Х. Вергейчик, В.А. Линникова, Г.Б. Гуськова/ Здоровье и образование в XXI веке. – №8. – 2017 г. – С. 210-215. 7. Витер, В.И. Вопросы экспертизы фальсифицированных лекарственных средств в судебной медицине и фармации// В. И. Витер, А.Р. Поздеев, А.П. Коровяков/ Проблемы экспертизы в медицине. – №3. – 2003 г. – С. 7-10. 8. Власова, И. В. Физико-химические методы в анализе лекарственных препаратов/ И. В. Власова, А. В. Шилова, Ю. С. Фокина// Заводская лаборатория. Диагностика материалов. – Том 77. – №1. – 2011 г. – С. 21-28 9. Глазырина, Ю.А. Количественное определение примесей в лекарственных средствах: лаборатор. практикум: учеб.-метод. пособие/ Ю. А. Глазырина, С. Ю. Сараева, А. Н. Козицина, Е. Л. Герасимова, А. И. Матерн ; под общ. ред. С. Ю. Сараевой: М-во образования и науки Рос. Федерации, Урал. федер. ун-т. — Екатеринбург: Изд‑во Урал. ун‑та. – 2015 г. — 96 с. 10. Гризодуб А.И. Валидация спектрофотометрических методик количественного анализа лекарственных средств в соответствии с требованиями ГФУ / Фармаком. – 2002 г. – № 3. – С. 42-50. 11.Гризодуб, А.И. Воспроизводимость фармакопейных спектрофотометричсских методик количественного определения лекарственных средств в разных лабораториях / А.И. Гризодуб, Н.Н. Волинская, Н.Н. Архипова// Фармаком. – 2004 г. – №2. – С. 1-16. 12. Колесникова Н.В. Влияние производных сульфаниламидов и уреидов на электроосаждение сплава Ni-Mn, его коррозию в присутствии сульфатредуцирующих бактерий и мицелиальных грибов и абсорбцию водорода: автореф. дис. … канд. хим. наук. Калининград, 2004. 17 с 13. Гуськов В. Ф., Шамина Я. А., Талдыкина А. А. Использование спектрофотометрии в количественном анализе химиотерапевтических препаратов / Разработка, исследование и маркетинг новой фармацевтической продукции: сб. науч. тр. — Пятигорск: Пятигорская государственная фармацевтическая академия. – 2004 г. – Вып. 59. – С. 159. 14. Дорофеев В.Л. Использование метода ацидиметрии для количественного определения лекарственных средств группы сульфаниламидов// В.Л. Дорофеев, И.В. Титов, А.П. Арзамасцев/ Вестник ВГУ. – №2. – 2004 г. – С. 205-209. 15. Отто М. Современные методы аналитической химии / М. Отто. – М.: Техносфера. – 2006 г. – 416 с. 16. Пентин, Ю.А. Химические методы исследования в химии/ Ю.А. Пентин, Л.В. Вилков. – М.: Мир. – 2006 г. – 683 с. 20. Раменская, Г. В. Фармацевтическая химия: учебник / под ред. Г. В Раменской. – М.: БИНОМ. Лаборатория знаний. – 2015 г. – 467 с. 21. Рудакова, Л. В. Развитие и востребованность аналитических методов в контроле фармацевтической продукции/ Л.В. Рудакова//Всероссийская конференция «Современные методы химикоаналитического контроля фармацевтической продукции»: Тезисы докл. – 2009 г. – С. 123. 22. Харитонов Ю. А. Аналитическая химия. Том 2 / Ю. А. Харитонов. – М.: ГЭОТАР-Медиа, 2014. – 559 с. 23. Машковский м.д. Лекарственные средства. В 2-х частях. 14-е изд., перераб. и доп. М.: Медицина, 2000. Т. 1, 736 с. Т. 2, 688 с. [Mashkovsky M.D. Medicinal products. In 2 parts. 14 th ed., rev. M .: Medicine, 2000. Vol. 1, 736 p. Vol. 2, 688 p. (In Russ.)] 24. Солдунов Г.Н. Сульфаниламидные препараты. Учебное пособие по фармацевтической химии ЦМС ВолгГМУ, 2012. 57 с. [Soldunov G.N. Sulfanilamide preparations. A manual on pharmaceutical chemistry CMS VolgGMU, 2012. 57 p. (In Russ.)] Ilya G. Povarov, Viktor V. Efimov… Synthesis of Sulphanylamides from New Derivatives of Aminopyrazoles 25. Беликов В.Г. Фармацевтическая химия. Учебное пособие по фармацевтической химии. М.: МЕДпресс-информ, 2007. 216 с. [Belikov V.G. Pharmaceutical Chemistry, Manual on Pharmaceutical Chemistry. M.: MEDpress-Inform, 2007. 216 p. (In Russ.)] 26.Ефимов В.В., Любяшкин А.В., Субоч Г.А., Товбис М.С. Синтез новых алкоксиметилзамещенных 4-амино-1Н-пиразолов и их ацилирование. Журнал органической химии 2016. Т. 56, С. 52-54 [Efimov V.V., Lyubiashkin A.V., Suboch G.A., Tovbis M.S. Synthesis of new alkoxymethylsubstituted 4-amino-1H-pyrazoles and their acylation. Journal of Organic Chemistry 2016. Vol. 56, P. 52-54. (In Russ.)] 27. Любяшкин А.В., Поваров И.Г., Субоч Г.А., Товбис М.С. Ацилирование и сульфонилирование некоторых азотосодержащих соединений: Монография: СибГУ им. Решетнева 2018. 184 с. [Lyubiashkin A.V., Povarov I.G., Suboch G.A. Tovbis M.S. Acylation and sulfonylation of some nitrogen-containing compounds: Monograph of Reshetnev SibSU 2018. 184 p. (In Russ.) |