фарма. Лекция (3). Лекция Предмет и содержание фармацевтической химии. Современные проблемы и перспективы развития фармацевтической химии
 Скачать 447.05 Kb. Скачать 447.05 Kb.
|
|
Лекция: «Предмет и содержание фармацевтической химии. Современные проблемы и перспективы развития фармацевтической химии» Цели: ознакомить учащихся с предметом и содержанием фармацевтической химии, выяснить её связь с другими науками. Задачи: Дать понятие фармацевтической химии. Выяснить её содержание и связь с другими науками. Ознакомиться с современными проблемами и перспективами развития фармацевтической химии. Учитывая особенности строения и физико-химические свойства лекарственных препаратов научиться проводить методы их контроля качества. Усвоить представления о современных методах качественного и количественного анализа лекарственных препаратов. Контрольные вопросы: 1. Дайте определение фармацевтической химии, как науки. Покажите ее связь со степенями науки. 2. Охарактеризуйте кратко основные этапы развития фармацевтической химии. 3. Рассмотрите основные и специфические понятия фармацевтической химии. 4. Приведите классификацию лекарственных средств. Фармацевтическая химия – наука, которая изучает строение, способы получения, физические и химические свойства лекарственных веществ, связь между их химической структурой и действием на организм, методы контроля качества, условия хранения и изменения, происходящие в процессе хранения лекарств. Объектами фармацевтической химии являются лекарственные вещества синтетического и природного происхождения (животного, растительного, микробного), лекарственные средства заводского (патентованные и генерические) и аптечного производства, лекарственные формы, лекарственные препараты, лекарственное сырье растительного и животного происхождения, исходные продукты, используемые для получения ЛВ, промежуточные и побочные продукты синтеза, остаточные растворители, вспомогательные вещества, гомеопатические лекарственные средства и биологически активные добавки к пище. К лекарственным веществам (субстанциям) относятся вещества растительного, животного или синтетического происхождения, обладающие биологической активностью и предназначенные для производства и изготовления лекарственных средств. Фармацевтическая химия занимает центральное место среди других специальных фармацевтических дисциплин – фармакогнозии, фармацевтической технологии, фармакологии, управления и экономики фармации, токсикологической химии и является связующим звеном между ними. Так, фармакогнозия – наука, исследующая лекарственное сырье и возможности создания из него новых лекарственных веществ. Тесно взаимосвязана фармацевтическая химия с фармацевтической технологией, изучающей методы приготовления лекарственных средств, которые являются объектами для разработки способов фармацевтического анализа. Токсикологическая химия базируется на применении тех же методов исследования, что и фармацевтическая химия. В изучении проблем хранения лекарственных средств, а также организации контрольно-аналитической службы тесно связаны с фармацевтической химией организация и экономика фармации. В области исследования взаимосвязи между структурой молекул лекарственных веществ и их действием на организм фармацевтическая химия близко примыкает к фармакологии. Вместе с тем фармацевтическая химия занимает промежуточное положение между комплексом медико-биологических и химических наук. Являясь прикладной наукой, фармацевтическая химия базируется на теории и законах таких наук, как неорганическая, органическая, аналитическая, физическая, коллоидная химия. Поскольку действие лекарственных веществ на организм зависит как от химической структуры, так и от физико-химических свойств, фармацевтическая химия использует законы физической химии. При разработке способов контроля качества лекарственных веществ и лекарственных форм в фармацевтической химии применяются методы аналитической химии. Однако фармацевтический анализ имеет свои специфические особенности и включает три обязательных этапа: установление подлинности, контроль чистоты (определение допустимых пределов примесей) и количественное определение лекарственных веществ. Фармацевтическая химия связана с другими естественнонаучными и медико-биологическими дисциплинами. Так, знание математики позволяет применять метрологическую оценку результатов анализа лекарственных средств, а знание физики – использовать фундаментальные законы природы и применять современные приборы при анализе и исследованиях ЛС. Ряд дисциплин медико-биологического профиля – биология, микробиология, физиология, патология – являются основой для понимания метаболизма лекарств. Очевидна взаимосвязь между фармацевтической химией специальными дисциплинами. Постоянный контроль (мониторинг) качества реагентов, вспомогательных веществ, промежуточных продуктов, фармацевтических субстанций и готовых лекарственных форм –важная составляющая технологических процессов фармацевтических предприятий. Фармакогностические исследования не возможны без анализа растительного и других видов природного сырья. Организация фармации использует информацию фармацевтической химии для совершенствования системы стандартизации и контроля качества ЛС. Определение биологически активных соединений и их метаболитов в жидких средах организма (кровь, моча, слюна) во времени (фармакокинетика) позволяет решать задачи фармакологии, к примеру проводить оценку биоэквивалентности дженериковых ЛС их оригинальным аналогам. Фармацевтическая химия лежит в основе развития нового направления исследования ЛС – фармакогенетики, позволяющей рационализировать применение ЛС с учетом индивидуальной генетической чувствительности. Тесная взаимосвязь со всеми перечисленными дисциплинами обеспечивает решение современных проблем фармацевтической химии. В конечном счете эти проблемы сводятся к созданию новых, более эффективных и безопасных ЛС и разработке экспрессных и достоверных методов фармацевтического анализа. В фармацевтической химии применяют общие (используемые и в других химических дисциплинах) и специальные (сугубо фармацевтические) термины. Рассмотрим некоторые из них, наиболее важные для курса фармацевтической химии, термины в соответствии с ОСТ 91500.05.0002-2001 «Государственный информационный стандарт лекарственного средства. Основные положения». Биодоступность – полнота и скорость всасывания лекарственных веществ (ЛВ), которые характеризуются его количеством, поступившим в организм, после применения лекарственного препарата. Биоэквивалентность – равенство биодоступности в допустимых пределах одних и тех же лекарственных препаратов, приготовленных разными производителями. Валидация – оценка и документальное подтверждение соответствия производственного процесса и качества продукции утвержденным требованиям. Воспроизведенные ЛС (дженерики) – ЛС, поступившее в обращение после истечения срока действия исключительных патентных прав на оригинальные ЛС. Вспомогательное вещество – относительно индифферентное в химическим и биологическом отношении вещество, разрешенное к медицинскому применению в целях получения лекарственной формы, придания или сохранения определенных свойств лекарственного препарата. Качество лекарственного препарата – совокупность свойств, которые придают лекарственному препарату способность соответствовать своему назначению и отвечают требованиям, установленным стандартом. Лекарственная форма – состояние, придаваемое ЛС или лекарственному растительному сырью, удобное для применения, обеспечивающее необходимый лечебный эффект. Лекарственное (фармацевтическое) сырье – ЛС, лекарственное растительное сырье, вспомогательные вещества, разрешенные к медицинскому применению для производства лекарственных препаратов или другой фармацевтической продукции или полуфабрикатов. Фактически понятие «сырье» включает все исходные материалы, поступающие в производство для переработки с целью получения готового продукта или полуфабриката. Лекарственные средства – вещества, применяемые для профилактики, диагностики и лечения болезни, предотвращения беременности, полученные из крови, плазмы крови, а также органов, тканей человека или животного, растений, микроорганизмов, минералов методами синтеза или с применением биологических технологий. Лекарственные препараты – дозированные ЛС в определенной лекарственной форме, готовые к применению. Наркотическое средство – ядовитое или сильнодействующее ЛС, требующее ограниченного применения и отнесенное к наркотическим в соответствии с законодательством. Наркотические средства реализуют по особым правилам, установленным Министерством здравоохранения и социального развития РФ. Психотропные вещества – вещества, включенные в перечень, составленный и обновляемый в соответствии Конвенцией о психотропных веществах 1971 г. и законодательством РФ. Патентованные лекарственные средства – ЛС, право на производство и продажу которых охраняется патентным законодательством РФ. Незаконные копии лекарственных средств – ЛС, поступившие в обращение с нарушением патентного законодательства РФ. Оригинальные лекарственные средства – ЛС, поступившие в обращение с зарегистрированными собственными названиями. Радиоактивное средство – ЛС, применяемое в медицинской практике в связи с его способностью к ионизирующему излучению. Сертификат – письменное свидетельство (гарантия) того, что качество ЛС (эффективность, безопасность) отвечает установленным требованиям спецификаций, а производственный процесс – правилам GMP. Сертификация лекарственных средств – процесс компетентного подтверждения специально аккредитованными органами безопасности и соответствия качества ЛС требованиям нормативных документов (НД). Сильнодействующее вещество – ЛС с высокой биологической активностью, прописывание, отпуск, хранение и учет которого производятся по особым правилам, установленным Минздравом России. Срок годности – утвержденное законодательным органом на основании результатов специальных исследований время хранения ЛС (препарата), в течение которого оно сохраняет свои физико-химические, микробиологические и терапевтические свойства без изменений или в установленных для них пределах при условии соблюдения хранения. Стабильность – способность ЛС (препарата) сохранять свои физико-химические и микробиологические свойства в течение определенного времени с момента его выпуска. Фармакопейная статья – нормативный документ, который определяет состав, упаковку, срок годности и требования к качеству лекарственного препарата (лекарственной субстанции или вспомогательного вещества) и имеет статус государственного стандарта. Ядовитое вещество – ЛС с очень высокой биологической активностью, прописывание, отпуск, хранение и учет которого производятся по особым правилам, установленным Минздравом России. Известно несколько типов классификации ЛС. Среди них для фармацевтической химии важна химическая классификация, согласно которой вещества объединены в группы в соответствии с их химической природой. При химической классификации рассматривают два больших класса: ЛС неорганической и органической природы. Фармакологическая классификация ЛС отражает преимущественное действие препарата на ту или иную систему организма. Внутри групп фармакологической классификации препаратов может рассматриваться фармакотерапевтическая классификация – лекарственные препараты группируют в зависимости от применения для лечения определенного заболевания (противомикробные, противовирусные препараты, снотворные, гипотензивные, кардиотонические, местноанестезирующие, анальгезирующие средства и т.д.). Взаимосвязь фармацевтической химии с естественно-научными и специальными дисциплинами 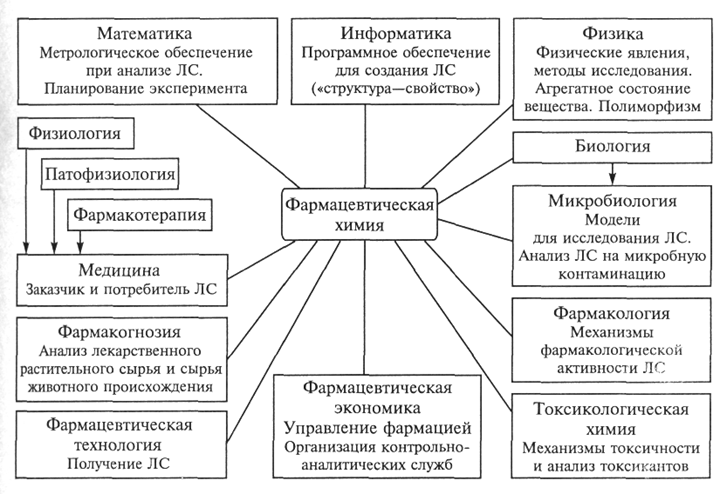 Периоды «жизни» лекарственного средства 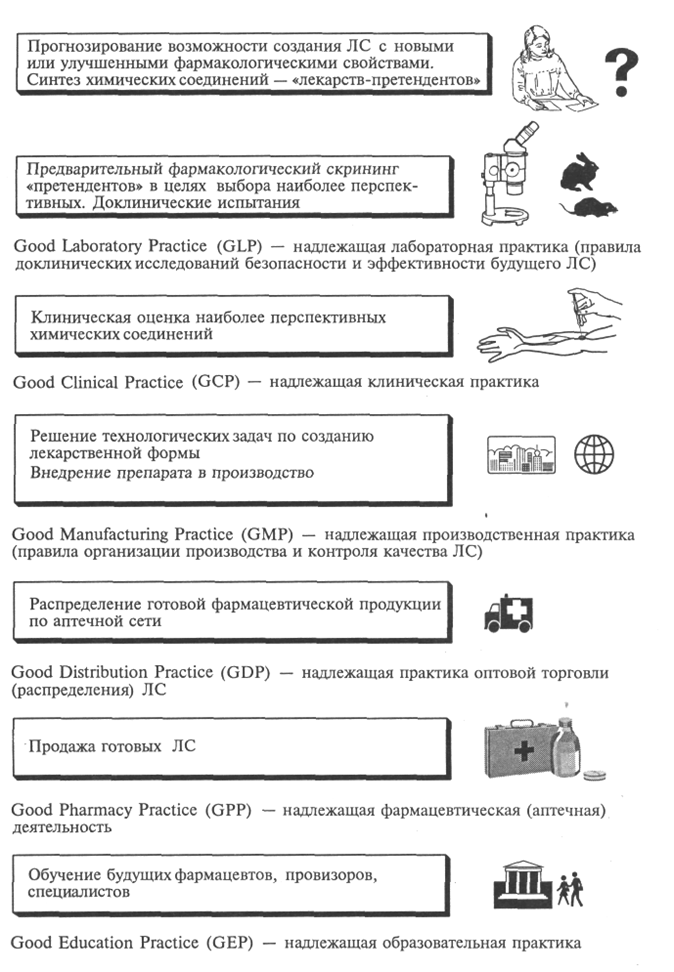 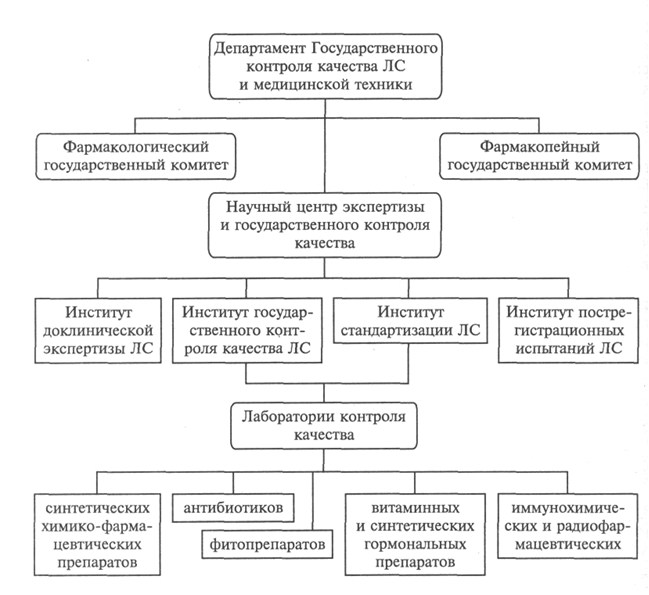 Государственная система контроля качества лекарственных средств Задание. Изучить основные понятия и термины, используемые в фармацевтической химии (заполнить таблицу).
Лекция «Основные положения и документы, регламентирующие фармацевтический анализ» Цель: ознакомиться с основными положениями и документами, регламентирующими фармацевтический анализ. Задачи: 1. Дифференцировать основные вопросы, изучаемые 2. фармацевтической химией. 3. Усвоить принципы номенклатуры лекарственных средств. 4. Обеспечить усвоения знаний по изучению связи физико-химических 5. свойств лекарственного препарата с фармакологическим действием. 6. Сформировать понятие об основных лекарственных препаратах и их условии хранения и применения в медицине. 7. Учитывая особенности строения и физико-химические свойства. 8. лекарственных препаратов научиться проводить методы их контроля 9. качества. 10. Усвоить представления о современных методах качественного и количественного анализа лекарственных препаратов. Фармацевтический анализ ЛС в аптеке, контроль технологии их приготовления, соблюдение правил хранения и отпуска - составляющие контроля качества ЛС в аптеке, или внутриаптечного контроля. Для его осуществления в аптеках имеются аналитические кабинеты или аналитические столы, оснащенные необходимыми приборами, реактивами, а также справочная и специальная литература, например следующие НД. • Приказ МЗ РФ № 214 от 16.07.1997 г. «О контроле качества ЛС, изготовляемых в аптеках». В приказе перечислены мероприятия, обеспечивающие изготовление в аптеках ЛС, качество которых должно соответствовать требованиям, регламентированным ГФ и другими действующими НД Минздравсоцразвития России. Действие приказа распространяется на все аптеки (в том числе гомеопатические), находящиеся на территории России, независимо от организационно-правовых форм и ведомственной принадлежности. • Приказ МЗ РФ № 751н от 26.10.2015 г. «Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензии на фармацевтическую деятельность». • Приказ МЗ РФ № 309 от 21.10.1997 г. «Об утверждении инструкций по санитарному режиму аптечных учреждений». • Методические указания по приготовлению, контролю качества, хранению и использованию растворов внутреннего употребления для новорожденных в аптеках и ЛПУ № 133-2/18-9 от 30.12.1986 г. • Фармакопейная статья «Вода очищенная» (ФС 42-0324-09, извлечения - приложение 1). • Приказ № 377 от 13.11.1996 г. «Об утверждении требований к организации хранения в аптечных учреждениях различных групп ЛС и изделий медицинского назначения». • Приказ Минздравсоцразвития РФ от 23.08.2010 г. № 706н «Об утверждении Правил хранения ЛС» (отменяет некоторые пункты приказа № 377). Главными требованиями, предъявляемыми к ЛС, являются эффективность и безопасность – критерии, определяющие их качество. Качество лекарственных средств – соответствие лекарственных средств государственному стандарту качества лекарственных средств. Оно в первую очередь зависит от наличия и соблюдений стандартов, используемых в процессе производства и контроля качества ЛС. Под стандартизацией лекарственных средств понимают разработку и применение унифицированных требований и методов исследования лекарственных средств (стандартов), отражающих требования государства к безопасности и качеству. Стандарт качества лекарственных средств – нормативный документ, содержащий перечень нормативных показателей и методов контроля качества лекарственных средств. Стандартами на лекарственные средства являются фармакопейные статьи (ФС), технические условия (ТУ), регламентирующие их качество, а также производственные регламенты, нормирующие их технологию. ФС – это государственный стандарт, содержащий перечень норма качества ЛС и методы их определения. Основным документом, включающим сборник государственных стандартов и положений, нормирующих качество ЛС, является Государственная фармакопея (ГФ). Нормативными документами, содержащими дополнительные технические требования к производству, контролю, хранению, маркировке, упаковке, транспортировке ЛС, являются отраслевые стандарты (ОСТы). Требования фармакопеи, предъявляемые к ЛС, обязательны для всех предприятий и учреждений, которые изготавливают, хранят, контролируют качество и применяют ЛС, вне зависимости от форм собственности. ГФ состоит из двух категорий стандартов качества: 1. Государственные стандарты качества ЛС, к которым относятся общая фармакопейная статья (ОФС) и фармакопейная статья (ФС). 2. Стандарт качества конкретного предприятия-производителя (ФСП). ОФС содержит общие требования к лекарственной форме или описание стандартных методов анализа ЛС. ОФС включает перечень нормируемых показателей и методов испытания конкретной лекарственной формы или описание методов анализа ЛС, требования к реактивам, титрованным растворам, индикаторам. ФС содержит обязательный перечень показателей и методов контроля качества лекарственного средства (с учетом его лекарственной формы), соответствующий требованиям ведущих зарубежных фармакопей. ОФС и ФС разрабатываются и пересматриваются через 5 лет научным центром экспертизы и государственного контроля лекарственных средств. ФС и ОФС формируют Государственную фармакопею, которая переиздается каждые 5 лет. ФСП на лекарственные средства конкретного предприятия-производителя, содержащий перечень показателей и методов контроля качества ЛС, производимого на этом предприятии, учитывает особенности технологии данного предприятия. Разрабатывается ФСП с учетом требований ГФ и ОСТа. Срок действия ФСП не более 5 лет. В настоящее время вышло XIII издание Государственной фармакопеи Российской Федерации. Государственная фармакопея Российской Федерации XIII издания (ГФ РФ XIII издания) состоит из вводной части, основной части и приложений. Основная часть содержит 229 общих фармакопейных статей (ОФС) и 179 фармакопейных статей (ФС), представленных в соответствующих разделах. Раздел «Общие фармакопейные статьи» содержит следующие подразделы: общие статьи, методы анализа, реактивы, лекарственные формы и методы их анализа; лекарственное растительное сырье и методы оценки его качества; группы иммунобиологических лекарственных препаратов и методы их анализа; лекарственные препараты из крови и плазмы крови человека и животных и методы анализа, используемые в оценке их качества; радиофармацевтические лекарственные средства. В них изложены общие методы анализа, методы физического, физико-химического, химического и биологического анализа, реактивы и индикаторы, титрованные и буферные растворы, морфологические группы лекарственного растительного сырья, лекарственные средства растительного происхождения, группы иммунобиологических лекарственных препаратов и группы лекарственных препаратов из крови и плазмы крови человека и животных. Также приведено описание лекарственных форм и методов их анализа, включая определение фармацевтико-технологических показателей. Фармакопейные статьи представлены в разделах «Фармацевтические субстанции» и «Лекарственные препараты». Раздел «Фармацевтические субстанции» включает фармакопейные статьи на фармацевтические субстанции синтетического или минерального происхождения, используемые в качестве действующих и/или вспомогательных веществ. Кроме того, в виде отдельного подраздела представлены фармакопейные статьи на лекарственное растительное сырье, используемое в фармацевтическом производстве, в том числе лекарственных, растительных препаратов. Раздел «Лекарственные препараты» состоит из двух подразделов: иммунобиологические лекарственные препараты и лекарственные препараты, полученные из крови и плазмы крови человека. В приложениях к ГФ РФ XIII издания приведены справочные таблицы: таблица атомных масс, алкоголеметрические таблицы, таблица изотонических эквивалентов лекарственных веществ по натрию хлориду, таблица количества капель в 1 г и в 1 мл и масса 1 капли жидких лекарственных препаратов при температуре 20о С по стандартному каплемеру; рисунки ИК-спектров стандартных образцов фармацевтических субстанций, фармакопейные статьи, которые включены в текущее издание ГФ РФ XIII издания. Впервые в ГФ РФ XIII издания вводится 99 общих фармакопейных статей: 30 ОФС – на методы анализа, 5 ОФС – на лекарственные формы и 12 ОФС на методы определения фармацевтико-технологических показателей лекарственных форм, 2 ОФС – на лекарственное растительное сырье и 3 ОФС – на методы его анализа, 7 ОФС – на иммунобиологические лекарственные препараты и 28 ОФС – на методы их испытания, 3 ОФС – на группы лекарственных препаратов из крови и плазмы крови человека и животных, 9 ОФС – на методы анализа лекарственных препаратов, полученных из крови и плазмы крови человека и животных (см. «Перечень общих фармакопейных статей, впервые вводимых в действие»). В ГФ РФ XIII издания впервые вводится 20 фармакопейных статей, среди которых 4 ФС – на фармацевтические субстанции, 4 ФС – на лекарственное растительное сырье, 8 ФС – на иммунобиологические лекарственные препараты и ФС – на лекарственные препараты из крови и плазмы крови человека (см. «Перечень общих фармакопейных статей, впервые вводимых в действие»). Ряд ОФС, ранее представленных в Государственной фармакопее СССР Х иХI изданий, исключен из практики современного фармакопейного анализа как невостребованные (см. «Перечень общих фармакопейных статей, действие которых прекращено»). Впервые в ГФ РФ XIII издания включен раздел «Биологические лекарственные препараты», содержащий ОФС и ФС, регламентирующие требования, предъявляемые к иммунобиологическим лекарственным препаратам, лекарственным препаратам, полученным из крови и плазмы крови человека и животных, и методам их испытаний. Другие действующие ОФС и ФС ГФ СССР Х издания, ГФ СССР XI издания и ГФ СССР XII издания пересмотрены и дополнены материалами с учетом современных требований, научных и практических достижений в области фармакопейного анализа. В заголовках фармакопейных статей на фармацевтические субстанции принята следующая последовательность названий: МНН на русском языке, тривиальное название, название на латинском языке, а на лекарственное растительное сырье – название на русском или латинском языках. Все разделы ФС и ФСП на субстанции делятся на несколько групп: название и характеристика ЛВ, испытание подлинности, оценка чистоты, биологический контроль, количественное определение, упаковка и хранение, фармакологическая группа и меры предосторожности при работе с ЛВ. Во вводимой части фармакопейной статьи на субстанцию приводят химическое название по номенклатуре IUPAC, структурную формулу, брутто-формулу и относительно молекулярную массу. Вводимые показатели контроля качества и пределы нормирования должны соответствовать назначению субстанции (например, для производства/ изготовления стерильных лекарственных препаратов или стерильных неинъекционных лекарственных препаратов, или нестерильных лекарственных препаратов, или нестерильных лекарственных препаратов для местного и наружного применения и т.д.). Испытания по показателям контроля качества фармацевтической субстанции проводят согласно соответствующим общим фармакопейным статьям (ОФС). Описание. Указывают характеристики физического состояния и цвет субстанции. Не следует включать описание вкуса. В необходимых случаях приводят информацию о запахе, гигроскопичности и полиморфизме. Для твердых субстанций необходимо указание формы вещества: «кристаллический», «мелкокристаллический» или «аморфный порошок». Характеристика кристалличности субстанции является одним из важных параметров, от которого зависит качество твердых дозированных лекарственных препаратов. В некоторых случаях может быть указан численный диапазон размера частиц, а также введено исследование формы кристаллов. Такие испытания выносят в отдельные разделы. Оценка полиморфизма субстанции обязательна в тех случаях, когда полиморфная модификация определяет фармакологическую активность лекарственного препарата и его фармако-технологические свойства. Растворимость. Для определения растворимости следует использовать растворители, охватывающие широкую шкалу полярности, например: вода, спирт 96%, гексап и др. Не рекомендуется использование легкокипящих и легковоспламеняющихся (например, диэтиловый эфир) или очень токсичных (например, бензол) растворителей. Подлинность. Для установления подлинности субстанции рекомендуются физико-химические и химические методы – инфракрасная спектометрия, абсорбционная спектрофотометрия, ЯМР-спектроскопия, тонкослойная, газовая и высокоэффективная жидкостная хроматография (ТСХ, ГХ и ВЭЖХ) и качественные (в первую очередь специфические) химические реакции. Метод ИК-спектрометрии является приоритетным или идентификации субстанций. Температура плавления. Испытание обычно применяют для характеристики твердых веществ. Температура затвердевания, температура кипения (температурные пределы перегонки), плотность, вязкость, показатель преломления. Данные испытания вводят для характеристики жидких субстанций. Удельное вращение. Вводят для характеристики оптически активных веществ. Удельный показатель поглощения. Данный показатель может являться дополнительной характеристикой подлинности и чистоты субстанции. Прозрачность раствора, цветность раствора. Данные испытания обязательно вводят для субстанций, используемых для приготовления парентеральных, глазных, назальных и ушных лекарственных средств. Испытание обычно проводят в водных растворах субстанции, но возможно использование органических и смешанных растворителей. Концентрация испытуемых растворов должна быть приближена к концентрации производимого/изготавливаемого их этой субстанции лекарственного препарата. Определение цветности раствора особенно важно для оценки качества белых, почти белых или белых с оттенком субстанций. Ели субстанция окрашена, показатель «Цветность раствора» в нормативную документацию включать не следует. Это испытание, если необходимо, можно заменить регламентацией оптической плотности при определенных длинах волн. рН и кислотность или щелочность. Для провдения данного испытания могут использоваться два подхода: измерение рН или кислотно-основное индикаторное титрование (кислотность или щелочность). Испытание обычно проводят в водных растворах субстанции, но в отдельных случаях возможно использование и смешанных растворителей. Допустимый интервал рН обычно должен быть не более двух. Концентрация испытуемого раствора при определении рН должна быть приближена к концентрации изготавливаемого из субстанции лекарственного препарата. Родственные примеси. Данное испытание контролирует продукты деструкции фармацевтической субстанции и технологические примеси, обусловленные технологией производства. Примеси могут быть идентифицированные (соединения с установленным химическим строением) и неидентифицированные (соединения, строение которых не установлено). Пределы содержания родственных примесей в фармацевтических субстанциях приводят с учетом параметров их безопасности. Для контроля родственных соединений обычно используют хроматографические и реже спектроскопические методы. Обязательно вводятся идентификация и количественное определение токсичных примесей с использованием стандартных образцов. Неорганические анионы (хлориды, сульфаты и др.). Выбор контролируемых анионов определяется технологией получения субстанции. При этом контролируемые анионы могут быть нетоксичными (например, хлориды, сульфаты и др.). Контроль анионов не вводят, если они входят в состав субстанции (например, субстанция является гидрохлоридом или сульфатом). Неорганические катионы (железо, медь и др.). Это испытание вводят, если контроль содержания отдельных катионов является существенным для качества субстанции; их содержание должно быть обосновано. Контроль катионов не вводят, если они входят в состав субстанции (например, вещество является натриевой солью). Потеря по массе при высушивании или влажность. Испытание вводят для контроля содержания летучих веществ и/или влаги в субстанции. Введение одного из этих испытаний, как правило, обязательно. Отсутствие их должно быть обосновано. Если в фармакопейной статье нет других указаний и субстанция не является кристаллогидратом (кристаллосольватом), потеря по массе при высушивании или содержание воды, как правило, не должно превышать 0,5%. Результаты определения по этим показателям учитывают при оценке результатов количественного определения. Если субстанция является кристаллогидратом (кристаллосольватом), регламентируют верхний и нижний пределы. Сульфатная зола. Как правило, сульфатная зола не должна превышать 0,1%. Отсутствие этого испытания в фармакопейной статье требует соответствующего обоснования. Тяжелые металлы. Устанавливаемые пределы содержания тяжелых металлов в фармацевтических субстанциях определяются максимальной суточной дозой препарата, произведенного из данной субстанции, и длительностью его возможного применения (согласно инструкции по медицинскому применению). Мышьяк. Данное испытание вводят в том случае, когда исходное сырье может содержать мышьяк, например, для сырья природного происхождения, или возможно загрязнение им в процессе получения субстанции. Содержание мышьяка, как правило, не должно превышать 0,0001%. Остаточные органические растворители. В фармацевтических субстанциях определяют остаточные количества органических растворителей 1-го класса токсичности, если их применение обосновано, независимо от стадии, на которой они используются. Для растворителей 2-го класса токсичности, используемых не на последней стадии производства фармацевтических субстанций, в нормативной документации должен быть предусмотрен контроль их остаточного содержания либо должно быть приведено обоснование отсутствия контроля их остаточного содержания; если растворители 2-го класса токсичности используются на последней стадии, каждый из них должен быть определен количественно. В фармацевтических субстанциях контроль растворителей 3-го класса токсичности необходим, если они используются на последней стадии производства. Для определения остаточных количеств растворителей 3-го класса токсичности, если их содержание не превышает 0,5%, допускается применение неспецифического метода «Потеря в массе при высушивании»; при наличии растворителей 3-класса, если их содержание превышает 0,5%, каждый из них должен быть определен количественно. Испытание на бактериальные эндотоксины, пирогенность, аномальную токсичность, гистамин и/или депрессорные вещества не распространяются на вспомогательные вещества. Бактериальные эндотоксины или пирогенность. Данные испытания проводят для субстанций, предназначенных для приготовления лекарственных форм для парентерального применения. Субстанции должны выдерживать тест на бактериальные эндотоксины или пирогенность без проведения предварительной стерилизации. Если доказано, что субстанция не обладает пирогенными свойствами в процессе производства не может быть загрязнена пирогенными примесями небактериальной природы, то следует проводить испытание на бактериальные эндотоксины. Включение показателей «Пирогенность» и «Бактериальные эндотоксины» на альтернативной основе нецелесообразно ввиду различной чувствительности методов. Аномальная токсичность. Испытанию на аномальную токсичность подлежат субстанции, получаемые из крови, органов, тканей человека или животного, растительного сырья, микроорганизмов и продуктов их жизнедеятельности, предназначенные для производства лекарственных препаратов для парентерального применения. Гистамин и/или депрессорные вещества. Испытанию на гистамин и депрессорные вещества подлежат субстанции, которые используются для приготовления лекарственных препаратов, предназначенных только для внутрисосудистого введения, и если в их составе могу быть изначально или приобретаются в процессе производства примеси, обладающие депрессорным действием (субстанции микробиологического или животного происхождения). Микробиологическая чистота. Уровень микробиологической чистоты субстанции должен обеспечивать уровень чистоты лекарственного препарата при его производстве/изготовлении из этой субстанции. Стерильность. Данное испытание вводят для субстанций, используемых в производстве готовых стерильных лекарственных средств, которые не подвергаются процедуре стерилизации. Количественное определение. Для количественного определения действующего вещества субстанции используют физико-химические и химические методы анализа. Физико-химические и химические методы анализа для определения содержания действующего вещества в субстанции следует применять в сочетании с современными физико-химическими методами анализа, используемыми для идентификации субстанции и контроля примесей (ИК-спектрофотометрия, ВЭЖХ, ГХ и др.). В случае солей обычно достаточно анализа только одного из ионов, предпочтительно фармакологически активного. Содержание действующего вещества дается в пересчете на сухое вещество, если определяется потеря в массе при высушивании, в пересчете на безводное вещество, если определяется вода, в пересчете на безводное и свободное от остаточных органических растворителей вещество, если определяются вода и остаточные органические растворители. Упаковка и хранение. Упаковка и условия хранения должны обеспечивать качество субстанции в течение установленного срока годности. Маркировка. Должна включать торговое и международное непатентованное наименование, информацию о назначении субстанции, наименование производителя, количество, условия хранения, меры предосторожности (при необходимости), дату изготовления, номер серии, срок годности и условия хранения. Срок годности. Срок годности субстанции определяется временем, в течение которого она соответствует требованиям нормативной документации. Он может быть установлен хранением при обычных условиях или методом «ускоренного старения» при повышенной температуре. Стандартные образцы. Современные методы анализа предусматривают использование стандартных образцов. В качестве стандартных образцов при анализе фармацевтических субстанций следует использовать фармакопейные стандартные образцы, аттестованные уполномоченным фармакопейным органом. При их отсутствии для идентификации и оценки содержания действующего вещества должны использоваться первичные стандартные образцы. С целью унификации номенклатуры и требований к качеству лекарственных средств во всех странах мира была создана международная фармакопея. Отличие международной фармакопеи от национальных фармакопей заключается в том, что ее требования имеют рекомендательный, а не законодательный характер. Требованиями международной фармакопеи пользуются страны, не имеющие своих фармакопей или приобретающие лекарственные средства их других стран. Структура ФС на лекарственные средства в международной фармакопее практически не отличается от отечественной ГФ. Задание. Изучить нормативную документацию, регламентирующую качество лекарственных средств. Наименование Содержание ГФ (дать определение) ФС (дать определение) ОФС (дать определение) ФСП (дать определение) Критерии качества лекарственных средств (назвать, дать определение) Роль НД в повышении качества ЛС |
