курсовая. Ассановой Софьи Сергеевны Тема курсовой работы Паровая конверсия метана в производстве аммиака Содержание пояснительной записки Введение. Сжатое изложение
 Скачать 0.99 Mb. Скачать 0.99 Mb.
|
|
Таблица 3.4
График зависимости всех реакций от температуры представлен на рисунке 3.1 Рис.3.1. график зависимости энергии Гиббса от температуры Из рисунка 3.1 следует, что все реакции обратимые (идут в интервале от -40 до 40 кДж/моль). Вычислим Тинв.для всех реакций по формуле  Значения температур инверсий представлены в таблице 3.5 Таблица 3.5
Также вычислим значения Кр по формуле: 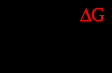 Зависимости констант равновесия от температуры представлены в таблице3.6 Таблица 3.6
С помощью константы равновесия можем определить полноту протекания процесса, чем выше константа равновесия, тем больше выход продуктов. В реакции (1) с увеличением температуры Кр растет, значит, чтобы увеличить выход продуктов целесообразно проводить реакцию при высоких температурах. А в реакции (2), наоборот, при увеличении температуры Кр уменьшается, выход продукта становится меньше. Проанализируем все реакции по правилу Ле-Шателье. 1.Так как реакции (1) и (3) эндотермические, то при увеличении температуры равновесие смещается в сторону образования продуктов реакции, так же при увеличении температуры энергия Гиббса в этих реакциях уменьшается, термодинамическая вероятность реакций увеличивается. В реакции (2), напротив при увеличении температуры энергия Гиббса увеличивается и реакция экзотермическая, равновесие смещается в сторону исходных веществ. 2. В реакциях (1) и (2) целесообразно брать избыток водяного пара, чтобы равновесие сместилось в сторону образования продуктов реакции. Для побочной же реакции увеличение концентрации водяного пара, способствует уменьшению концентрации метана, следовательно, уменьшается и выход продуктов. 3. Для реакции (1) снижение фактора давления смещает равновесие в сторону образования продуктов (т.к. реакция идет с увеличением числа молей газов), для реакции (2) давление не играет особой роли (равное число молей газов продуктов и исходных веществ). Выводы из термодинамического анализа Температура: Для реакции (1) и (3) увеличение температуры является благоприятным фактором, а для реакции (2), напротив. Концентрация (соотношение реагентов пар Н2О/СН4): Для основных реакций увеличение концентрации водяного пара является благоприятным фактором. Давление: Уменьшение давления для реакции (1) является благоприятным фактором, а для реакции (2) роли не влияет. 3.2. Кинетический анализ Реакции (1), (2), (3) являются итоговыми уравнениями реакций, которые фактически отображают баланс химических элементов до и после превращений. Детальный механизм процесса может быть очень сложным. По данным литературы[8] механизмы: механизм(I) СН4 + Z = Z СН2 + Н2 (3.1) ZСН2 + H2O = Z СНOH + Н2 (3.2) ZCHOH = ZCO + H2 (3.3) ZCO = Z + CO (3.4) Z + H2O = ZO + H2 (3.5) ZO+CO=Z+CO2(3.6) _____________________________ CH4 + H2O = CO + 3H2 (1) CO + H2O = CO2 +H2 (2) Здесь Z – активный центр на поверхности катализатора ZСН2, ZCHOH, ZCO и ZO - адсорбированные радикалы Первое уравнение (3.1) показывает адсорбцию метана на активном центре катализатора с последующем образованием адсорбированного двухвалентного углеводородного радикала и водорода. В реакции (3.2) происходит взаимодействие этого радикала с водяным паром с образованием адсорбированного кислородсодержащего радикала и водорода. В реакции(3.3) происходит разложение кислородсодержащего радикала на углекислородный радикал, а в реакции (3.4) происходит разложение этого углекислородного радикала на активный центр катализатора и монооксид углерода. Активный центр катализатора став свободным связывается с водяным паром с образованием кислородного радикала (3.5), в дальнейшем кислородный радикал связывается с монооксидом углерода и образуется свободный активный центр катализатора и углекислый газ. Итоговые уравнения (1) и (2) получаются сложением уравнений стадий, предварительно умноженных на соответствующие стехиометрические коэффициенты. Существует также карбидная теория этого процесса. Исходя из этой теории, механизм (I) может быть заменен механизмом, который включает в себя, промежуточное вещество поверхностный углерод: СН4 + Z = ZСН2 + Н2 (3.8) ZСН2 = ZС + Н2 (3.9) ZC + H2O = ZCO + H2 (3.10) ZCO = Z + CO (3.11) (II) Z + H2O = ZO + H2(3.12) ZO + CO = Z + CO2 (3.13) ________________________ CH4+H2O=CO+3H2(1) CO+H2O=CO2+H2(2) Согласно этой теории, стадии (3.2), (3.3) из механизма (1), заменяются стадиями(3.9),(3.10)механизма(ll). Первая стадия в обоих механизмах признана лимитирующей. Так же существует окислительно-восстановительный механизм процесса, протекающий с образованием неустойчивых промежуточных соединений.[9] Ni+H2O=NiO+H2(3.14) NiO+CH4=HNiOCH3(3.15) HNiOCH3=CO+2H2+Ni(3.16) _______________________ CH4+H2O=CO+3H2 Лимитирующей стадией является образование промежуточного комплекса, реакция (3.15) Было предложено следующее кинетическое уравнение [4] 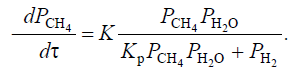 (3.7) (3.7)Кр – константа равновесия После преобразования этого уравнения при Р(Н2О)=const, получено упрощенное уравнение: 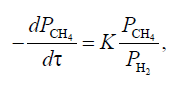 (3.8) (3.8)Pi – парциальные давления газов K – константа скорости t – время Где 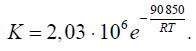 (3.9) [9] (3.9) [9]Мы видим из уравнения (3.8), что скорость процесса прямо пропорциональна парциальному давлению метана и обратно пропорциональна парциальному давлению водорода. Судя по кинетическому уравнению давление не оказывает особого влияния на скорость процесса. по уравнению Pi=Pобщ*Xi, можно судить, что при увеличении концентрации метана, парциальное давление метана растет(прямо пропорциональная зависимость), это увеличивает скорость процесса. В уравнении (3.9) дается зависимость константы скорости от температуры. Используем эту зависимость. Зависимость константы скорости от температуры представлена в таблице 3.7 и на рисунке 3.2 Таблица 3.7
рис.3.2. Зависимость константы скорости от температуры Судя по графику можно сказать, что при увеличении температуры константа скорости растет, значит и увеличивается скорость реакции. Катализаторы конверсии метана Катализатор – это вещество участвует в химической реакции и ускоряет скорость химической реакции , но по окончанию реакции не изменяется ни качественно ни количественно. Установлено, что лучшим для процесса конверсии метана является никелевый катализатор. Никель в самом катализаторе находится в виде окислов. Катализатор, ускоряющий скорость процесса, является металлический никель. Для этого, перед началом конверсии метана, катализатор необходимо восстановить газом, который содержит водород, например: NiO+H2=Ni+H2O. Катализатор восстановляется при температуре 300-400С в течение 2-4 часов. Также никель может находится в виде соединений с окисью алюминия(шпинели), для его восстановления требуется более высокая температура (800-900С) и более длительное время. Шпинель образуется при нагревании катализатора до температуры выше 600С, при отсутствии восстановителей(Н2 и СО) Эффективность работы катализатора определяется остаточным содержанием метана в конверсионном газе при определенном количестве подаваемого газа. Нагрузка на катализатор характеризуется объемной скоростью. Объемная скорость – количество кубометров исходного газа (сухого), проходящего через 1 м^3 катализатора в час. Объемная скорость выражается в ч^(-1). В промышленных условиях катализатор конверсии метана работает в интервале объемных скоростей 250-240 ч^(-1) при 600-1000С. Активность никелевого катализатора может снижаться вследствие присутствия в газе соединений серы: H2S, CS2, CO2. Эти вещества называются каталитическими ядами. Отравление катализатора происходит по реакции Ni+H2S=NiS+H2. образовавшийся сернистый никель уже не способен ускорять реакцию, от сюда активность катализатора уменьшается. Конверсия метана сопровождается выделением свободного углерода(сажи) реакция (3). углерод разлагается не только на поверхности, но и внутри гранул катализатора, что приводит к уменьшению активности и механическому разрушению катализатора. Согласно данным из литературы [7], используют следующие катализаторы: катализаторы нанесенного типа ГИАП-3, ГИАП-8, КСН-2 и катализаторы смешанного типа ГИАП-16. Кроме того в качестве верхнего защитного слоя используют хромоалюминиевый катализатор типа марки ГИАП-14. Катализаторы по их назначению можно подразделить на две основные группы: катализаторы эндотермической конверсии в трубчатых печах и катализаторы автотермической конверсии в шахтных реакторах. Катализаторы эндотермической конверсии метана: наиболее широко применяют катализатор типа ГИАП-16, который используют для паровой и пароуглекислородной конверсии метана. Способ приготовления катализатора – многостадийный (17 операций). Смесь оксидов алюминия, бария и кальций алюминатного цемента( талюма) в заданных соотношениях смешиваются раствором солей никеля. уплотненную шихту подвергают полусухому таблетированию, далее таблетки прокаливают при 380С. В виду высокого содержания никеля смешанные катализаторы в большей степени теряют прочность при восстановлении, а при нагреве в окислительной среде образуют твердые растворы, что снижает их активность. Связывание никеля в малоактивную форму может происходить как при приготовлении, так при эксплуатации, особенно верхней части реакционных труб. В виду указанных недостатков средняя продолжительность работы смешанных катализаторов редко превышает 3 года. Их повсеместно заменяют катализаторами нанесенного типа. Обычно в верхнюю часть труб загружают катализатор нанесенного типа, а в верхнюю смешанного типа. Катализаторы нанесенного типа содержат 7,5-12% NiO на керамическом корундовом носителе из Al2O3, применяемым в чистом виде или с добавками основного характера (0,2-2%). Например таким катализатором является ГИАП-17. Катализаторы нанесенного типа не чувствительны к обработке влажным паром, термостабильны. Кроме носителей из корунда используют также алюмомагниевую шпинель MgAl2O4. катализаторы на этом носители в виду повышенной адсорбции водяного пара на шпинели обладают высокой селективностью, однако довольно чувствительны к воздействию влажного пара при температурах ниже. 400С. [7] Выводы кинетического анализа: Температура: По уравнению Аррениуса увеличение температуры является благоприятным фактором для увеличения скорости реакции. Давление: Судя из кинетического уравнения, давление не влияет на скорость процесса. Концентрация (соотношение реагентов пар Н2О/СН4): Судя из кинетического уравнения, увеличение концентрации метана, способствует увеличению скорости реакции. Выводы теоретического анализа: Температура : Высокое значение температуры увеличивает скорость реакции и смещает равновесие в благоприятную сторону (реакция(1)) Концентрация: Избыточное содержание водяных паров является благоприятным фактором для увеличения скорости реакций, уменьшения выхода продуктов побочных реакций и смещения равновесий в благоприятную сторону (для реакций (1), (2) Давление: Из термодинамического анализа следует, что процесс проводят при уменьшении давления. Из кинетического анализа следует, что весомой роли давление не оказывает. На практике же проводят реакцию при увеличении давления, что способствует увеличению нагрузки на активный катализатор и позволяет увеличить время пребывания, что приводит к увеличению производительности. Катализатор: Наиболее активным и стабильным для конверсии метана является никелевый катализатор. 4. Синтез и анализ ХТС (химическая, структурная, операторная и технологическая схемы) 4.1. Химическая схема Процесс паровой конверсии метана в производстве аммиака описывается следующими химическими реакциями. СН4(г) +Н2О(г) =СО(г) + 3Н2 (4.1) СО(г) + Н2О(г)=СО2 + Н2 (4.2) 2СО(г)= 2С(тв) + Н2(г) (4.3) СН4(г)=С(тв) +2Н2 (4.4) СО(г) + Н2(г) = С(тв) + Н2О(г) (4.5) Реакции (4.1) и (4.2)-являются основными Природный газ смешивается в водным паром и с поступает в трубчатую печь, заполненную никелевым катализатором, там протекают реакции (4.1), (4.2). Реакции (4.3), (4.4), (4.5) являются побочными.[7] 4.2. Структурная схема Все элементы структурной схемы отражены в виде блоков, указывающих соединения между соответствующими элементами. Блоки могут иметь несколько выходов и входов. Технологические связи указывают на направление движения материальных или энергетических потоков.[1] Структурная схема конверсии метана представлена на рис 4.1. 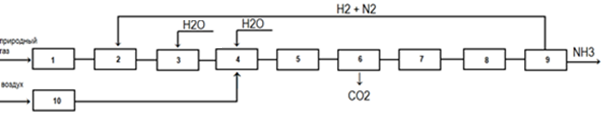 Рис 4.1. Структурная схема производства аммиака:
Получение аммиака из природного газа начинается с сжатия природного газа, после его очистка от сернистых соединений, паровую затем, паровоздушную конверсию метана, отмывку конвертированного газа от диоксида углерода, метанирование оксида и диоксида углерода, сжатие азотоводородной смеси, синтез аммиака.[7] 4.3. Технологическая схема  Рис4.2. Схема получения технологического газа двухступенчатой конверсией природного газа под давлением 2,0-3,0МПа: 1 – подогреватель парогазовой смеси; 2 – подогреватель паровоздушной смеси; 3,4 – пароперегреватели; 5 – подогреватель питательной воды; 6 – подогреватель топливного газа; 7 – паросборник; 8 – реакционные трубы; 9 – подъемная труба; 10 – футерованный водоохлаждаемый коллектор Промышленное осуществление конверсии углеводородных газов водяным паром в трубчатых печах с подводом тепла извне стало возможным в результате успешного освоения производства катализаторных труб из жаропрочной стали, способных работать при высоких температурах под давлением в несколько мегапаскалей, а также в результате создания более активных катализаторов и совершенствования конструкции печи. На рис4.2 изображена технологическая схема получения газа двухступенчатой конверсией природного газа под давлением 2-3МПа. Очищенная от серы газовая смесь при температуре 350-370С под давлением 4,15-4,2 Мпа смешивается с водяным паром в соотношении пар : газ = 3,7-4,0. Давление газа перед трубчатой печью поддерживают автоматически-изменением частоты вращения турбины компрессора природного газа. Образующаяся парогазовая смесь при 350-370С поступает в подогреватель, расположенный в конвекционной зоне трубчатой печи, где за счёт тепла дымовых газов нагревается до 510-525С. Затем парогазовую смесь направляют в I ступень конверсии метана – трубчатую печь (в радиационную зону), в которой она равномерно распределяется по вертикально расположенным реакционным трубам 8. Температура конвертированного газа на выходе из реакционных труб в зависимости от активности катализатора находится в пределах 790-823С. Остаточное содержание метана в сухом конвертированном газе после трубчатой печи составляет 9-11%. После реакционных труб конвертированная парогазовая смесь проходит подъёмные трубы 9, размещенные также в радиационной зоне печи, где перегревается на 25-30С. Подъёмные трубы сколлектированы футерованным водоохлаждаемым коллектором 10, по которому конвертированный газ попадает в шахтный конвертор метана II ступени. Конвертированная парогазовая смесь после трубчатой печи поступает в кольцевое пространство смесителя, расположенного в верхней части конвертора метана II ступени. Воздух, необходимый для процесса паровоздушной конверсии, забирается из атмосферы и после очистки от пыли поступает на всас центробежного компрессора. Тонкое регулирование расхода воздуха на технологию поддерживается автоматически при помощи регулятора – сбросом воздуха в атмосферу. Температура воздуха после конверсии 175-210С, давление 3,7 МПа. После компрессора воздух поступает в подогреватель технологического воздуха 2, установленный в камере конвекции трубчатой печи. Перед подачей воздуха в подогреватель в трубопровод постоянно дозируют пар давлением 3,8-4,3 МПа и температурой 370-380С в количестве 4,5-7 т/ч. Непрерывная подача пара в трубопровод воздуха необходима для защиты подогревателя паровоздушной смеси и компрессора во время аварийных остановок агрегата; для предотвращения обратного хода горячего газа при остановке компрессора воздуха. Перегретую паровоздушную смесь при 465-480С через центральную трубу направляют в смеситель конвертора метана 11. В свободном объёме шахтного конвертора, расположенного над слоем катализатора, происходит горение части газа в кислороде воздуха. Процесс конверсии осуществляется на никелевом катализаторе при температуре на выходе 990-1002С. Остаточное содержание метана в конвертированном газе составляет 0,35-0,55% (об.). Тепло дымовых газов, вышедших из радиационной секции трубчатой печи, используют: для нагрева парогазовой смеси в аппарате 1 с 350-370 до 510-525С; для нагрева паровоздушной смеси в аппарате 2 до 465-480С; для перегрева в 2-ступенчатом подогревателе пара (аппараты 3,4) давлением 10,3 МПа, идущего на турбину привода компрессора азотоводородной смеси, с 314 до 485-490С; для нагрева деаэрированной питательной воды, используемой для получения пара давлением 10,5 МПа при температуре от 102-104 до 285-314С; для подогрева топливного газа (в аппарате 6), используемого для сжигания в радиационной камере трубчатой печи. Дымовые газы после использования их тепла при 200С дымососами выбрасывают в атмосферу [7] 4.4. Операторная схема Отражает физико-химическую сущность процесса, каждый элемент изображен в виде теплового технологического оператора, который качественно или количественно преобразует входные параметры процесса. На рис 2 изображена операторная схема получения технологического газа двухступенчатой конверсии природного газа 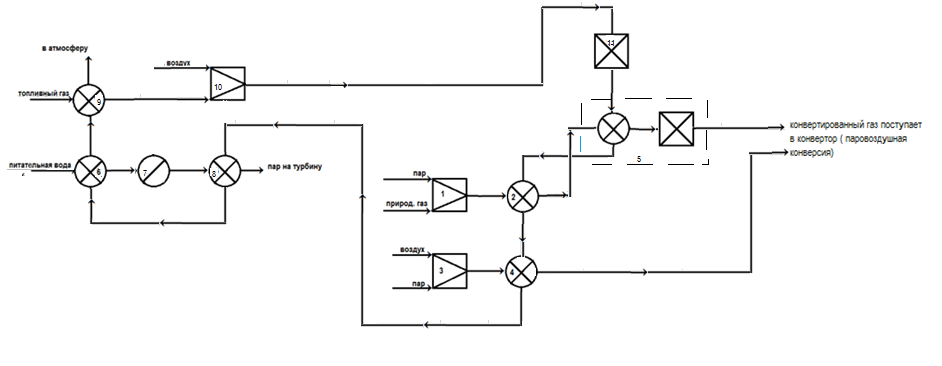 Рис4.3 Операторная схема конверсии природного газа: 1 – смешение пара и природного газа; 2 – подогреватель парогазовой смеси; 3 – смешение воздуха и пара; 4 – подогреватель паровоздушной смеси; 5 – паровая конверсия метана; 6 – подогреватель питательной воды; 7 – паросборник; 8 –пароперегреватель; 9 –подогреватель топливного газа; 10 –смешение топливного газа с воздухом; 11 - горение топливного газа; [7] 5.Выбор и обоснование конструкции основного аппарата 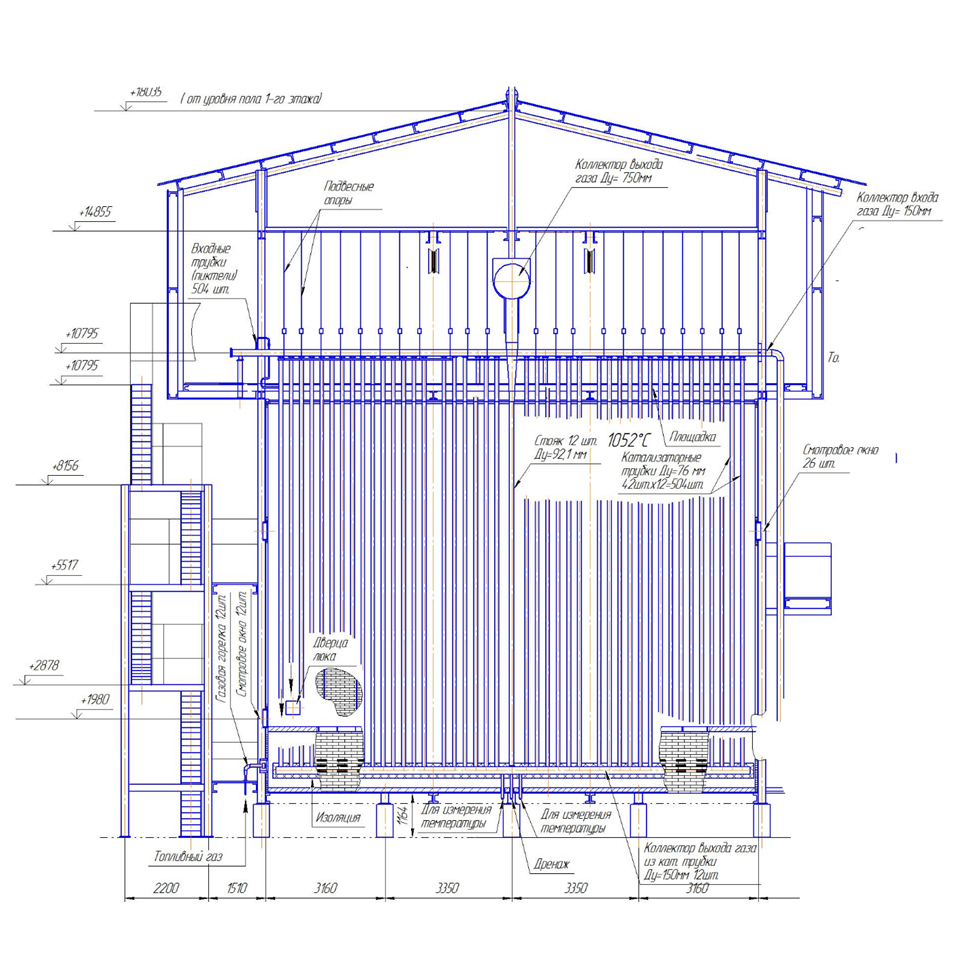 Рис.5.1 трубчатая печь типа ППР-1360 В промышленности применяются трубные печи различны конструкций, отличающиеся формой шахты печи, размерами заполненных катализатором труб, направлением потоков (парогазовой смеси и дымовых газов), типом и расположением горелок, конструкцией устройств для компенсации температурных удлинений и компоновкой аппаратуры конвективной части. Многорядная трубчатая печь. В современных производствах аммиака, метанола и водорода большой мощности наибольшее распространение получили прямоточные многоядерные трубчатые печи с верхним пламенным обогревом. Печь состоит из двух блоков: топочной (радиационной) камеры и блока использования дымовых газов( камеры конвекции) со встроенным вспомогательным котлом. Основные преимущества таких печей это компактность и относительно небольшие размеры. На рисунке 5.1 изображен разрез трубчатой печи типа (ППР-1360), блока топочной (радиационной) камеры. В топочной камере установлены 12 параллельных секций, каждая из которых имеет 42 реакционные трубы, центробежнолитые из стали. Диаметр трубы 114х21мм, высота 11 м, длина обогреваемой части 9,6м. Трубы вварены в нижний секционный сектор с шагом 230мм. Коллектор, диаметр которого 142х19мм снаружи теплоизолирован. Реакционные трубы подвешены несущим балкам на пружинах. В центре секции установлена подъемная труба со сборным газоходом. Трубный экран каждой секции по условиям монтажа состоит из 3 частей, шаг между крайними трубами, которых больше, чем 230 мм. Этим обусловлена неравномерность освещения труб экрана, что приводит к перегреву части экранных труб. Секции труб свободно висят в топочном пространстве камеры. Кольцевые зазоры между реакционными трубами и сводом топочной камеры уплотняют огнеупорными сальниковыми устройствами. Парогазовая смесь из коллекторов равномерно распределяется по газопроводящим трубам между реакционными трубами. В реакционных трубах на никелевом катализаторе протекает паровая конверсия углеводородов. Температура реакционной смеси на выходе из труб 800-825С. Конвертированных газ собирается в секционные коллекторы и поднимается по газоотводящим трубам в общий газообразный коллектор, футерованный теплоизоляционным бетоном и помещенный в водную рубашку. Температура реакционной смеси на выходе из подъемных труб 840-860С. Далее конвертированный газ по газосборному коллектору направляют в шахтный реактор. Обогрев реакционных труб осуществляется факельными инженерными горелками. Горелки расположены в своде топочной камеры между секциями реакционных труб. В каждом ряду установлена 21 горелка. Дымовые газы отводят через газоходы, расположенные между секциями реакционных труб в нижней части печи, и при температуре 900-1100С направляют в конвективную камеру. С целью обеспечения равномерности обогрева реакционных труб секции окна в газоходах выполнены с переменной перфорацией по длине печи. В торцевой стене газохода имеются дополнительные горелки. Основной недостаток печи данной конструкции-невозможность отключения одной или нескольких реакционных труб ( при аварийном состоянии) без остановки всего агрегата. Производительность печи по природному газу ( на технологию) 38-40тыс м3/ч. Объем загруженного катализатора 20,6 м3.[7]
Все расчеты производились с помощью программы «Excel». 6.1. Расчет материального баланса Исходные данные (состав на входе) представлены в таблице 6.1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
