Атеросклероз. Атеросклероз и артериосклероз
 Скачать 273 Kb. Скачать 273 Kb.
|
|
АТЕРОСКЛЕРОЗ И АРТЕРИОСКЛЕРОЗ Атеросклероз — хроническое медленно прогрессирующее заболевание, проявляющееся очаговым утолщением интимы артерий эластического и мышечно-эластического типов за счет отложения липидов (липопротеидов) и реактивного разрастания соединительной ткани. Атеросклероз (от греч. athero — кашица и sclerosis — уплотнение), названный так по предложению Маршана (F.Marschand, 1904), является одной из разновидностей артериосклероза, к которому относятся также первичный склероз с обызвествлением средней оболочки артерий (медиакальциноз Менкеберга), артериосклероз при гиалинозе мелких артерий и артериол, старческий артериосклероз, а также вторичные склеротические (воспалительные, токсические, аллергические) поражения сосудов. В настоящее время атеросклероз является самым распространенным сосудистым заболеванием, которое особенно часто встречается в промышленно развитых странах, и (прямо или косвенно) обуславливает до 50% всех причин смерти. В основе заболевания лежат различные воздействия (факторы риска), приводящие к нарушению жиробелкового обмена и к повреждению интимы крупных артерий. К факторам риска атеросклероза относятся возраст, пол, наследственная предрасположенность, гиперлипидемия, артериальная гипертензия, сахарный диабет, курение, психо-эмоциональное перенапряжение и др. Атеросклероз встречается практически в любом возрасте, но подавляющее большинство случаев клинической манифестации заболевания отмечается у пожилых и старых людей, увеличиваясь с каждым новым десятилетием жизни. Следует отметить, что в возрасте до 40 лет мужчины болеют значительно чаще женщин. После 45—50 лет (период развития менопаузы у женщин) этот показатель начинает выравниваться, а после 70 лет заболевание одинаково выражено в обеих половых группах. Это объясняют, прежде всего, значительной нивелировкой с возрастом гормональных различий у мужчин и женщин по содержанию андрогенов и эстрогенов. О значении гормонов свидетельствует и то, что у женщин, длительное время употреблявших пероральные контрацептивные препараты, значительно возрастает риск развития более ранних и выраженных атеросклеротических изменений. Существуют семейная предрасположенность к заболеванию, вызванная генетически закрепленной гиперлипидемией, гипертензией, сахарным диабетом, а также характером питания (ожирение), образа жизни (гиподинамия) и пр. Длительно существующая гиперлипидемия любого первичного или вторичного генеза приводит к тяжелым атеросклеротическим поражениям, что впервые было показано еще в 1913 г. русским патологом Н.И.Аничковым. Артериальная гипертензия обусловливает повышение сосудистой проницаемости, вызывая тем самым повреждение сосудистой стенки и способствуя действию других факторов риска. Значительно повышает заболеваемость атеросклерозом (особенно у женщин) курение, приводящее к более выраженным и распространенным проявлениям заболевания. Сахарный диабет, протекающий с существенными нарушениями всех видов обмена веществ (в том числе с гиперлипидемией и гиперхолестеринемией), а также часто сопровождающийся повышением артериального давления, вызывает более генерализованный и тяжелый атеросклероз, чем у лиц с нормогликемическими показателями. Кроме того, при сахарном диабете 2-го типа наблюдается, как правило, повышение массы тела, что само по себе, как и гиподинамия, приводит к повышению содержания липидов в крови. В настоящее время доминирует точка зрения, что атеросклероз развивается в ответ на повреждение эндотелия различными факторами: гиперлипидемией (гиперхолестеринемией) дислипидемией (имеет значение не только повышение содержания ЛПНП, но и увеличение их соотношения с ЛПВП), частыми стрессами, гемодинамическим воздействием (артериальная гипертензия, турбулентное движение крови, частые спазмы, парезы сосудов и др.), иммунными механизмами, токсинами, инфекционными агентами и т.д. Развивается повышение сосудистой проницаемости, приводящее к проникновению в интиму липопротеидов плазмы, адгезии к поврежденному эндотелию тромбоцитов и моноцитов. Часть последних во внутренней оболочке артерий трансформируется в макрофаги и (затем) в пенистые (ксантомные) клетки за счет накопления липидов. Этому способствует и то, что поврежденные эндотелиоциты экспрессируют адгезивные молекулы (IСАМ-1, VСАМ-1, LFA-1). Выделяющиеся цитокины (интерлейкин-1, фактор некроза опухолей, макрофагальный колониестимулирующий фактор, тромбоцитарный фактор роста и др.) обусловливают хемотаксис и клеточную пролиферацию, а затем новообразование капилляров в атеросклеротической бляшке. Кроме того, они влияют также на пролиферацию и активацию гладкомышечных клеток артериальной стенки, которые начинают синтезировать протеогликаны, коллаген, эластин (компоненты внеклеточного матрикса), поглощать и накапливать в цитоплазме липопротеиды, превращаясь наряду с макрофагами в пенистые клетки. Нарушение целостности эндотелиальных клеток способствует образованию пристеночных тромбов, играющих определенную роль в атерогенезе. Активируются скэвенджер-рецепторы макрофагальной системы, что приводит к нерегулируемому поступлению липопротеидов в сосудистую стенку и их накоплению вследствие несостоятельности поврежденных систем выведения холестерина. Следует отметить, что увеличению содержания ЛПНП в интиме способствует и появление модифицированных ЛПНП (например, гликозилированных, как при сахарном диабете), усиленно захватывающихся эндотелиальными клетками и макрофагами. ЛПНП могут подвергаться модификации не только в сыворотке крови, но и в самой интиме под воздействием процессов перекисного окисления липидов, гликозилирования, соединения с протеогликанами и т.д. Существуют различные теории атеросклероза. Так, инфильтрационная теория Н.Н.Аничкова указывает на значение гиперхолестеринемии и гиперлипидемии, как на ключевой момент в развитии этого заболевания. Нервно-метаболическая теория А.Л.Мясникова основную роль в развитии заболевания отводит повторяющимся стрессовым ситуациям, вызывающим психо-эмоциональное перенапряжение, которое приводит к расстройству нейроэндокринной регуляции жиро-белкового обмена и вазомоторным нарушениям. Возникающая гиперлипидемия в сочетании с гиперкатехоламинемией и вазомоторными реакциями обусловливают повреждение эндотелия интимы сосудов. Иммунологическая теория А.Н.Климова и В.А.Нагорнева рассматривает атеросклероз как иммунное воспаление. Доказательством этого являются характерные изменения иммунной системы, фиксация в сосудистой стенке иммуноглобулинов, аутоиммунных комплексов, иммунокомпетентных клеток, а также прогрессирование заболевания при использовании иммунодепрессантов, например, в случаях трансплантации органов. Согласно рецепторной теории Гольдштейна и Брауна в основе заболевания лежит качественный и количественный дефект специфических липопротеидных рецепторов, что приводит к замедлению выведения ЛПНП из сыворотки крови, гиперлипидемии, дислипопротеидемии. Кроме того, активизируется скэвенджер-захват ЛПНП, что ведет к нерегулируемому их накоплению в интиме. Эта теория также хорошо объясняет причины развития наследственно обусловленных форм атеросклероза, что важно для понимания определенных особенностей вторичных и алиментарной гиперлипидемии. Тромбогенная теория Дж.Б.Дьюгеда, прототипом которой является инкрустационная теория К.Рокитанского, в какой-то степени раскрывает причины образования атеросклеротических бляшек из плоских пристеночных тромбов с последующей их организацией в аорте и других артериях. В 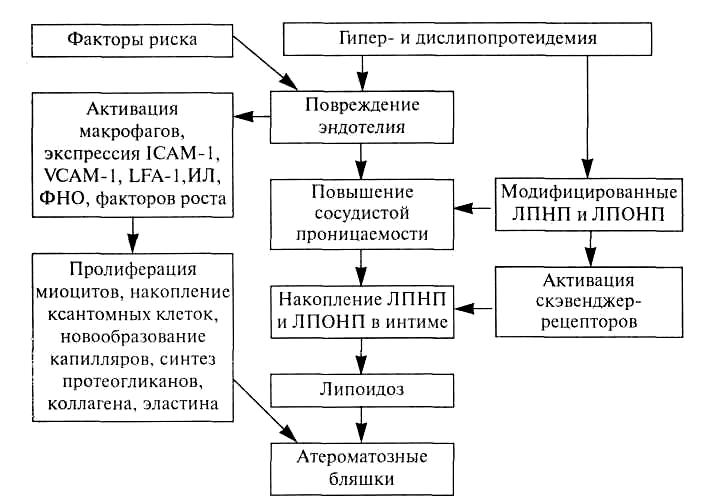 ирусная теория заболевания объясняет деструкцию эндотелиоци-тов воздействием герпетической, цитомегаловирусной инфекции и находит свое подтверждение, главным образом, в эксперименте. ирусная теория заболевания объясняет деструкцию эндотелиоци-тов воздействием герпетической, цитомегаловирусной инфекции и находит свое подтверждение, главным образом, в эксперименте. Очевидно, что все эти механизмы, приводящие к повреждению эндотелия, его слущиванию и повышению проницаемости интимы артерий, а также к нарушениям жиро-белкового обмена в том или ином сочетании имеют место в многофакторном патогенезе атеросклероза (схема 1). Схема 1. Патогенез атеросклероза Сокращения: IСАМ-1 - межклеточные адгезивные молекулы -1; VСАМ-1 - клеточные адгезивные молекулы - 1; LFA-1 - функционально-ассоциированный антиген лимфоцитов 1 1; ИЛ-1 - интерлейкины; ФНО 1 - фактор некроза опухоли; ЛННП, ЛПОНП - липопротеиды низкой и очень низкой плотности При заболевании, главным образом, поражаются артерии эластического и мышечно-эластического типов, тогда как артерии мышечного типа страдают значительно реже и, как правило, в тяжелых, генерализованных случаях атеросклероза. Атерогенез включает в себя три стадии: жировые полоски, атероматозные бляшки и осложненные поражения. Жировые пятна и полоски (липоидоз) макроскопически проявляются участками желтоватого или серо-желтого цвета, образующими небольшие (обычно до 1 см в продольном размере) очаги, хорошо контрастируемые на фоне интимы, но не возвышающиеся над ее поверхностью. При микроскопическом исследовании эти образования состоят из пенистых (ксантомных) клеток, содержащих большое количество липидов и окрашиваемых Суданом III в желтый цвет. Эта стадия является обратимой, однако может перейти в следующую. Атероматозные (фиброзные) бляшкипредставляют собой белые или белесовато-желтые хаотично расположенные плотные образования до 1,5 см диаметром, выступающие над поверхностью интимы. Особенно часто бляшки располагаются в области разветвления и изгибов артерий, где отмечаются наибольшие гемодинамические нагрузки. На разрезе бляшка состоит из фиброзной покрышки, под которой находится небольшое количество желтоватого содержимого (липосклеротическая бляшка). Однако в ряде случаев центральный отдел крупных бляшек представлен кашицеобразными или атерома-тозными (от греч. аthеге — кашица) массами (собственно атерома-тозные бляшки). При микроскопическом исследовании бляшка состоит из трех компонентов: клеточного, волокнистого и липидного. Клетки, локализованные по периферии бляшки, представлены миоцитами, макрофагами, Т-лимфоцитами и отдельными лейкоцитами в области покрышки. Волокнистый компонент состоит из внеклеточного матрикса соединительной ткани — коллагеновых, эластических волокон и протеогликанов. Третий компонент состоит из внутри-(пенистые клетки) и, прежде всего, внеклеточных скоплений липидов. Последние занимают весь центральный отдел бляшки, представляющий собой в случаях атероматоза некротизированный детрит, состоящий из липидов, кристаллов холестерина, плазменных белков, разрушенных клеток и, в ряде случаев, базофильных масс извести (возникающих вследствие дистрофического обызвествления). Кроме того, по периферии бляшки отмечается образование сосудов, способствующих благодаря поступлению липопротеидов и плазменных белков росту бляшки. Располагаясь в артериях мышечно-эластического типа (например, в венечных артериях сердца), атеросклеротическая бляшка приводит не только к атрофии и склерозу мышечной оболочки сосуда, но и к сужению сосудистого просвета, ишемическим изменениям тканей соответствующего органа (как острым, так и хроническим). Осложненные пораженияотражают дальнейшие структурные изменения атеросклеротических бляшек, проявляющиеся их изъязвлением и разрывом сосудистой стенки. Атероматозные язвывозникают вследствие распада содержимого бляшек и их фиброзных покрышек. При этом возможно образование пристеночных или обтурирующих тромбов с последующим развитием тромбоэмболии и тканевой эмболии атероматозными массами (атероэмболия). При разрыве стенки артерии или разрушении новообразованных в бляшке сосудов происходит кровоизлияние по типу интрамуральной, расслаивающей гематомы, высока вероятность формирования атеросклеротической аневризмы сосуда. Как видно, при макроскопическом осмотре не всегда можно точно сказать, о какой стадии атеросклероза идет речь. Поэтому на основании более тонких морфологических методов выделяют следующие морфогенетические стадии заболевания: липоидоз (соответствующий стадии жировых пятен и полос), липосклероз, атероматоз (отражающие стадию фиброзных бляшек), изъязвление атерокальциноз Исследователи, занимающиеся механизмами развития атеросклероза, выделяют еще одну, самую раннюю его стадию — долипидную, названную так вследствие невыявления жиров рутинными тинкториальными методиками (например, при окраске Суданом III). Однако электронномикроскопически и иммуногистохимически уже в эту стадию определяют наличие пиноцитозных пузырьков в цитоплазме эндотелиоцитов, скопления в интиме липидов, плазменных белков, небольшого количества фибриногена, что говорит о повышенной сосудистой проницаемости и нарушении целостности эндотелия. Кроме того, в стенке артерий наблюдается пролиферация макрофагальных и гладкомышечных клеток. В зависимости от преимущественной локализации сосудистых изменений выделяют 6 клинико-морфологических форм заболевания. Атеросклероз аорты. Встречается наиболее часто, особенно в брюшном отделе аорты, где, как правило, возникают наиболее выраженные изменения (изъязвление фиброзных бляшек, пристеночные тромбы, кальциноз). В связи с этим у больных может развиться гангрена кишечника, нижних конечностей, инфаркты почек, цилиндрическая, мешковидная или грыжевидная аневризма аорты с ее возможным разрывом. Атеросклероз венечных артерий сердца является по существу ишемической болезнью сердца. Атеросклероз артерий головного мозга приводит к атрофии коры (старческая деменция) или к ишемическим инфарктам. В последнем случае определяются суживающие просвет фиброзные бляшки артерий основания мозга, на разрезе которого виден очаг серого размягчения, проявляющийся неправильной формы с четкими границами фокусом из кашицеобразных сероватых масс. Атеросклероз артерий нижних конечностей. Как правило, изменения наиболее выражены в бедренных артериях, часто односторонние. В пораженной конечности (конечностях) отмечают атрофию, склероз тканей, перемежающуюся хромоту, воз можно развитие гангрены. Атеросклероз мезентериальных артерий может привести в гангрене кишки, ишемическому колиту. Атеросклероз почечных артерий наиболее часто поражает одну из почек, что приводит в результате развивающейся ишемии к вазоренальной гипертензии. В ткани почки возможны инфаркты (с последующей их организацией) или клиновидные участки атрофии. Формируется крупнобугристая, немного уменьшенная в размерах почка с множественными треугольными на разрезе Рубцовыми втяжениями, что получило название атероск-леротического нефросклероза (атеросклеротически сморщенная почка). Атеросклеротическое поражение брюшного отдела, бифуркации аорты, подвздошных и бедренных артерий может вызвать синдром Лериша, проявляющийся нарастающей ишемией нижних конечностей вплоть до развития гангрены. В результате выраженного атеросклеротического поражения дуги и грудного отдела в отдельных случаях может развиться синдром дуги аорты. Из-за стенозирования устьев ветвей аорты множественными фиброзными бляшками с изъязвлением, кальцинозом, частыми пристеночными тромбами у больных наблюдается ослабление и даже отсутствие пульса на лучевой артерии, ишемия головного мозга с соответствующей симптоматикой, нарушения зрения вплоть до слепоты. Вследствие сдавления пищевода затрудняется глотание, а возвратного нерва — развивается охриплость голоса. В любом случае длительное стенозирование просвета сосуда приводит к хроническому недостатку кровоснабжения соответствующего органа, что вызывает дистрофические, атрофические изменения паренхимы, диффузное разрастание фиброзной стромы (например, диффузный мелкоочаговый кардиосклероз). При острой обтурации просвета артерии, что возможно при тромбозе, тромбоэмболии, кровоизлиянии в бляшку, развивается ишемия и некроз тканей (инфаркт, гангрена). При атеросклерозе смерть наступает в результате ишемической болезни сердца, ишемического (реже геморрагического) инфаркта головного мозга, гангрены кишечника или нижних конечностей, разрыва аневризмы аорты. ИШЕМИЧЕСКАЯ БОЛЕЗНЬ СЕРДЦА Ишемическая болезнь сердца (ИБС) — это группа заболеваний, возникающих вследствие ишемии миокарда, вызванной относительной или абсолютной недостаточностью коронарного кровообращения. Так как в основе этого заболевания лежит атеросклеротическое сужение просвета венечных артерий, отмечаемое у большинства больных, то в качестве синонима часто используется термин "коронарная болезнь сердца". Заболевание чрезвычайно широко распространено, особенно в промышленно развитых странах, где на долю ИБС приходится основная масса летальных исходов и случаев инвалидности, вызванных сердечной патологией. Каждый год в России от этого заболевания ежегодно погибает свыше 500 тыс. больных. Кроме того, скрытая (доклиническая) ИБС обнаруживается у 4 - 6 % лиц в возрасте немногим старше 35 лет. По решению ВОЗ с 1965 г. ИБС рассматривается в качестве самостоятельной нозологической группы в Международной классификации болезней. Следует отметить, что аналогичные ИБС изменения в миокарде могут возникать и без атеросклеротического поражения венечных артерий сердца. Например, в исходе различных васкулитов (коронариитов), тромбоэндокардитов, миокардитов, тяжелых анемий, пороков сердца, интоксикаций любого генеза могут возникать не только хронические (кардиосклероз), но и острые (дистрофия, некроз) изменения сердечной мышцы. Однако они рассматриваются не как самостоятельные заболевания, а как осложнения соответствующего патологического процесса.ИБС является по существу сердечной формой атеросклероза и гипертонической болезни (выступающих в качестве фоновых заболеваний), в связи с чем в основе ее лежат те же причины, что и этих патологических состояний (схема 2). Однако для ИБС выделяют факторы риска 1-го порядка, при сочетании которых вероятность заболевания достигает 60%. К ним относят гиперлипидемию (дислипидемию), артериальную гипертензию, курение, гиподинамию, мужской пол больного. Так, приобретенные или (реже) врожденные нарушения липидного состава крови, сопровождающиеся увеличением уровня ЛПНП, ЛПОНП и уменьшением ЛПВП, прямо коррелируют с развитием атеросклероза, в том числе и венечных артерий сердца. Артериальная гипертензия любого генеза является не только ате-рогенным фактором (обусловливающим формирование более тяжелого и распространенного атеросклероза), но и вызывает дополнительную нагрузку на миокард, обусловливая его гипертрофию, усугубляя, особенно при декомпенсации, выраженность метаболических сдвигов и гипоксии сердца. Всему этому способствует и гиалиноз интрамуральных артериол, развивающийся при повышении артериального давления. С 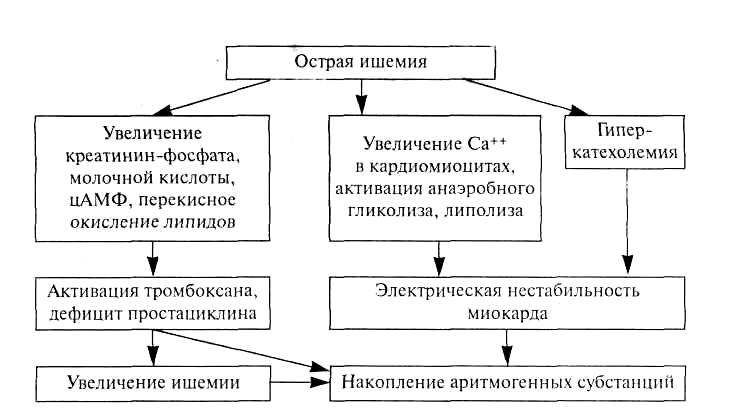 хема 2. Патогенез изменений при острой ишемии миокарда хема 2. Патогенез изменений при острой ишемии миокардаКурение, кроме прямого воздействия на артерии (ангиоспазм), стимулирует тромбообразование, повышение содержания атеро-генных липопротеидов и уменьшение уровня ЛПВП. Это связано с образованием под влиянием СО табачного дыма карбоксигемоглобина, замедляющего распад ЛПНП и ЛПОНП и увеличивающего тканевую гипоксию. Риск развития ИБС прямо пропорционален числу ежедневно выкуриваемых табачных изделий. Гиподинамия не только приводит к формированию гиперлипи-демии (и тем самым является существенным атерогенным фактором), но также способствует повышению системного артериального давления. Мужчины (из-за более низкого содержания в крови про-стациклина, обладающего антиатерогенным действием, способностью предотвращать сосудистый спазм и препятствовать агрегации тромбоцитов) заболевают чаще женщин, хотя после достижения 70-летнего возраста показатели заболеваемости у них становятся сходными, что связывают прежде всего с выравниванием у пожилых людей половых гормональных различий. При наличии факторов риска 2-го порядка (пожилой возраст, тучность, стрессы, нарушение обмена веществ типа сахарного диабета, подагры и т.д., дефицит магния, селена, цинка, гиперкальцие-мия и др.), влияющих на состояние венечных артерий сердца, кровоснабжение и обменные процессы в миокарде, возможность развития болезни существенно ниже, однако их также необходимо учитывать и корригировать при лечении больных и профилактике ИБС. Например, в старческом возрасте, даже без какого-либо заболевания, в миокарде иногда отмечают атрофию кардиомиоцитов с их липофусцинозом и базофильной дегенерацией, разрастание соединительнотканной стромы, накопление субэпикардиального жира, а изредка и отложения амилоида. Течение ИБС хроническое с эпизодами острой коронарной недостаточности, в связи с чем выделяют часто патогенетически тесно связанные между собой острую и хроническую формы заболевания. Острая ишемическая болезнь сердца. К ней относят стенокардию, внезапную коронарную смерть и инфаркт миокарда. Причинами этих заболеваний могут быть: 1) длительный спазм; 2) тромбоз; 3) эмболия; 4) функциональное перенапряжение миокарда при стенозирующем атеросклерозе венечных артерий и недостаточном коллатеральном кровообращении (отмечается у 90 % больных). Так, например, при сужении просвета артерии на 1/3 кровоток снижается в 5 раз, а при уменьшении просвета сосуда вдвое — в 16 раз. Особенно высока вероятность развития ИБС при стенозировании на 75 % хотя бы одного магистрального ствола венечной артерии сердца. При такой обструкции коронарное кровообращение уже не может компенсировать за счет вазодилатации развивающуюся при любой дополнительной нагрузке ишемизацию соответствующего участка миокарда. Следует отметить, что спазм атеросклеротически измененной артерии сам по себе может привести к кровоизлиянию и повреждению фиброзной покрышки бляшки, что активирует тканевой тромбопластин, стимулирующий агрегацию тромбоцитов. В результате формируется пристеночный или обтурирующий тромб, вызывающий остановку кровотока даже в умеренно атеросклеротически суженной артерии. Развитие коллатерального кровообращения в ряде случаев может компенсировать нарушенное кровоснабжение пораженного участка. Стенокардия (angina pectoralis, грудная жаба) характеризуется приступами давящих, сжимающих, реже колющих болей в области сердца, обусловленных кратковременной ишемией миокарда левого желудочка. Заболевание встречается как клиническое проявление различных форм ИБС. Выделяют следующие виды стенокардии. Стабильная форма (стенокардия напряжения)встречается наиболее часто. В основе заболевания лежит стенозирующий атеросклероз венечной артерии (или артерий), приводящий к длительной ишемии субэндокардиальных отделов миокарда. При этом сердечная мышца становится очень чувствительной к любой функциональной нагрузке, повышающей потребность миокарда в кровоснабжении (физическая нагрузка, эмоциональное возбуждение, охлаждение, перегревание и др.). Приступы обычно проходят через несколько минут (как правило, до 15 мин) покоя или после приема сосудорасширяющих медикаментозных препаратов. Стенокардия покоя (стенокардия Принцметала)развивается, как говорит само название, в спокойном состоянии больного — при отдыхе, во время сна. Для нее характерен спазм венечных артерий сердца (в отдельных случаях даже без наличия атеросклеротичес-ких бляшек), приводящий к трансмуральной ишемии миокарда. Продолжительность приступа может достигать 15—30 мин. Нестабильная формапроявляется частыми нарастающими приступами (как при физической нагрузке, так и в состоянии покоя) большой продолжительности. В ее основе лежит разрушение атеро-склеротической бляшки с пристеночным тромбозом венечных артерий, хотя возможны и ангиоспазм, и эмболия. Деструктивные изменения фиброзной бляшки могут быть вызваны спазмом венечной артерии, разрушающим бляшку (особенно обызвествленную), продолжительной тахикардией, гиперхолестеринемией и кровоизлиянием в бляшку. Обращает на себя внимание, что повышение уровня тромбоксана А2, серотонина, гистамина, тромбоцитарных факторов III, IV в области разрушенной атеросклеротической бляшки само по себе стимулирует не только агрегацию тромбоцитов, тромбообразование, но и обусловливает выраженную вазоконстрикцию. Так как такое состояние часто предшествует инфаркту миокарда, оно получило название предынфарктной стенокардии, или острой коронарной недостаточности, тем более что в миокарде возможно развитие микроинфарктов, поскольку уже через 30 мин ишемии в кардиомиоцитах развиваются необратимые изменения. Этому способствует наличие у таких больных в микроциркуляторном русле миокарда мелких тромбов и тромбоэмболов. Однако проходимость артерии может восстановиться вследствие произвольного или обусловленного медикаментозными препаратами лизиса тромботических масс, разрешения ангиоспазма. При стенокардии морфологически отмечаются отек миокарда, дистрофия кардиомиоцитов с уменьшением содержания гликогена в цитоплазме. Эти изменения, как правило, обратимы, однако часто повторяющиеся приступы приводят к развитию диффузного мелкоочагового кардиосклероза. Внезапная коронарная смерть.К этому патологическому состоянию относят смерть, наступившую в первые 6 часов после возникновения острой ишемии миокарда в результате фибрилляции желудочков. Наибольшая частота зарегистрирована в Финляндии, Швеции, США, тогда как в странах Восточной Европы она встречается несколько реже. Внезапная коронарная смерть является причиной гибели почти 10 % лиц, перенесших операцию трансплантации сердца. Как правило, умирают мужчины в возрасте от 40 до 60 лет. У женщин частота внезапной коронарной смерти прогрессивно нарастает с возрастом, достигая максимума к 70 годам. Обязательным условием является отсутствие каких-либо других болезней, вызывающих быструю смерть. В основе заболевания лежит длительный спазм атеросклеротически стенозированных венечных артерий сердца или (реже) их тромбоз. В ряде случаев у молодых людей без атеросклеротических изменений смерть может развиться в результате спазма венечных артерий сердца, особенно часто отмечаемого при употреблении наркотика кокаина. Наличие у больного экстрасистолий различного генеза вдвое повышает риск внезапной коронарной смерти. Внезапная сердечная смерть включает, помимо коронарной смерти, внезапную смерть при миокардитах, кардиомиопатиях, пороках развития венечных артерий, врожденных пороках сердца, коарктации аорты и др. При острой ишемии миокарда нарушается окислительное фосфо-рилирование, возникает дефицит АТФ в кардиомиоцитах. Страдает работа ионных помп, что приводит к дефициту ионов калия в цитоплазме и накоплению ионов натрия и кальция, избыточному поступлению воды. Формируется прогрессирующий отек и деструкция крист митохондрий. В результате разрушения мембран кардиомиоцитов образуются аритмогенные вещества, например лизофосфоглицериды и жирные кислоты. Они появляются уже через 5—10 мин после начала ишемии. Накопление лизофосфоглицеридов способствует избыточному образованию креатинфосфата, молочной кислоты, цАМФ, концентрация которых существенно возрастает. При этом значительно увеличивается поступление ионов кальция в кардиомиоциты, усиливаются процессы анаэробного гликолиза, гликогенолиза и липолиза, что ведет к электрической нестабильности миокарда, падению силы его сокращений и острой сердечной недостаточности. При спазме венечных артерий активируется симпатико-адреналовая система и возникает гиперкатехоламинемия. Растет концентрация адреналина, способствующего возникновению фибрилляции желудочков сердца. В зоне ишемии накапливаются свободные радикалы перекисного окисления липидов, которые, помимо аритмогенного эффекта, активируют простагландины с увеличением уровня тромбоксана и дефицитом простациклина. Аритмогенные субстанции увеличивают электрическую нестабильность сердца и создают предпосылки для развития фибрилляции его желудочков. О 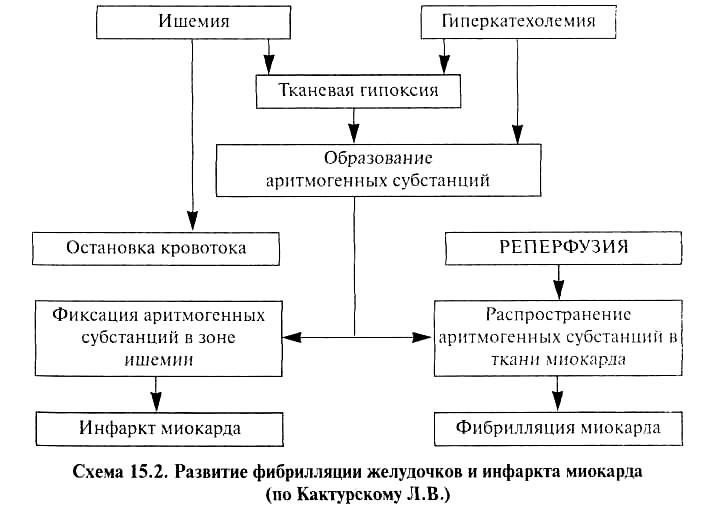 днако основным пусковым механизмом является реперфузия (рециркуляция), т.е. возобновление циркуляции крови в ишемизированном участке миокарда, особенно, если она появляется через 40—60 мин после ишемии. Эффект реперфузии связан с вымыванием кровью аритмогенных субстанций из зоны ишемии. Последние повреждают мембраны кардиомиоцитов функционирующего миокарда, вызывая в нем электрическую нестабильность и фибрилляцию желудочков сердца. Тем же эффектом обладает и остаточный кровоток в зоне ишемии (схема 3). днако основным пусковым механизмом является реперфузия (рециркуляция), т.е. возобновление циркуляции крови в ишемизированном участке миокарда, особенно, если она появляется через 40—60 мин после ишемии. Эффект реперфузии связан с вымыванием кровью аритмогенных субстанций из зоны ишемии. Последние повреждают мембраны кардиомиоцитов функционирующего миокарда, вызывая в нем электрическую нестабильность и фибрилляцию желудочков сердца. Тем же эффектом обладает и остаточный кровоток в зоне ишемии (схема 3).Схема 3. Развитие фибрилляции желудочков и инфаркта миокарда (по Кактурскому Л.В.) Если кровообращение в пораженном участке не восстанавливается, то аритмогенные вещества остаются локализованными в пораженном участке сердечной мышцы и не поступают в кровь. Это и наблюдается в случаях инфаркта миокарда, при котором фибрилляция желудочков развивается сравнительно редко и обусловлена изменениями, прежде всего в периинфарктной зоне. В связи с этим для больного наиболее благоприятной ситуацией является раннее восстановление перфузии в течение 15—20 мин от начала приступа, что в большинстве случаев предотвращает развитие некроза кардиомиоцитов. Реперфузия, осуществленная в течение первого часа, способствует минимализации размеров повреждения миокарда, улучшению локальной и общей сократимости левого желудочка. Более поздняя реперфузия сопровождается увеличением выживаемости больных, что связывают с улучшением процессов репарации в миокарде, уменьшением частоты аритмий, но не ограничением размеров некроза сердечной мышцы. Сердце больного обычно дряблое, с расширенной полостью левого желудочка и в ряде случаев с точечными кровоизлияниями в миокарде. Наиболее характерным микроскопическим признаком является фрагментация мышечных волокон. Причиной ее служит пересокращение дистрофически измененных мышечных волокон, что также обычно выявляется под световым микроскопом, а на ультраструктурном уровне видны повреждения сарколеммы кардиомиоцитов, деструкция митохондрий, набухание саркоплазматического ретикулума, отек цитоплазмы и расхождение вставочных дисков. В венечных артериях сердца обнаруживают плазматическое пропитывание, липидную инфильтрацию и кровоизлияния в фиброзных бляшках, надрывы интимы и деструкцию эластических мембран, что свидетельствует о коронароспазме. Характерно неравномерное кровенаполнение капилляров и других микрососудов миокарда — от их полного запустевания в участках ишемии до полнокровия и мелких кровоизлияний в окружающих областях. Инфаркт миокарда — сосудистый некроз сердечной мышцы, являющийся наиболее тяжелым вариантом острой ИБС и почти в каждом третьем случае заканчивающийся летально. Как правило, заболевание развивается у пожилых людей, однако в настоящее время до 5 % больных составляют лица моложе 40 лет. По локализации выделяют инфаркт передней, задней и боковой стенок левого желудочка, межжелудочковой перегородки, верхушки сердца обширный инфаркт. Сравнительно редко (около 1%) встречается изолированный инфаркт стенки правого желудочка. В ряде случаев обширный инфаркт может распространяться и на предсердия. При локализации поражения в бассейне передней межжелудочковой артерии, что наблюдается в 40—50% случаев, инфаркт развивается в передней стенке левого желудочка около верхушки, в передних двух третях межжелудочковой перегородки. Поражение бассейна правой венечной артерии встречается у 30—40% больных и обусловливает локализацию инфаркта в задней стенке левого желудочка, задней трети межжелудочковой перегородки или (редко) в задней стенке правого желудочка. Поражение огибающей ветви левой венечной артерии, встречающееся в 10—20% наблюдений, вызывает инфаркт миокарда боковой стенки левого желудочка. По отношению к слою сердечной мышцы различают трансмуральный (наиболее частый), субэндокардиальный, интрамуральный редко встречающийся субэпикардиальный инфаркт миокарда. В зависимости от временных особенностей возникновения можно говорить о первичном (остром) инфаркте миокарда, протекающем в течение 4 нед (28 дней) до формирования рубца, повторном, развивающемся через 4 нед после острого (т.е. тогда, когда на месте первичного инфаркта возникает постинфарктный кардиосклероз) рецидивирующем (рецидивном), наблюдающемся на протяжении 4 нед первичного или повторного инфаркта. В своем развитии инфаркт миокарда проходит 3 стадии. Ишемическая стадияпродолжительностью до 18 ч отличается практически полным отсутствием макроскопических изменений в сердце. Только к концу этого срока можно увидеть некоторую неравномерность кровенаполнения миокарда. Однако уже через 20—30 мин при электронной микроскопии отмечают набухание митохондрий кардиомиоцитов, деструкцию их крист, уменьшение числа гранул гликогена. В последующем развивается разрыв сарколеммы, отек, мелкие кровоизлияния и выход в миокард отдельных нейтрофилов. В зоне ишемии начинают исчезать гликоген, дыхательные ферменты, что можно выявить гистохимически, например, с помощью ШИК-реакции, путем определения сукцинатдегидрогеназы, при макроскопической окраске нитросиним тетразолием (нитро-СТ) или пробой с теллуритом калия. Последние реакции позволяют диагностировать эту стадию заболевания практически у секционного стола. Так, зона ишемии вследствие распада окислительно-восстановительных ферментов не окрашивается, тогда как сохранный миокард приобретает черный или темно-серый цвет. Для диагностики ишемии миокарда применяют также люминесцентную микроскопию срезов ткани сердца, выявляющую зеленоватое свечение пораженных участков. Поляризационная микроскопия выявляет в очаге ишемии пересокращенные кардиомиоциты, которые ярко светятся на темном фоне. Большое значение для течения и прогноза заболевания имеет состояние окружающей участок ишемии миокарда ткани, на которую падает повышенная физическая нагрузка, требующая дополнительного образования энергии. В результате начинает формироваться внутриклеточная гиперплазия (касающаяся прежде всего митохондрий и миофиламентов) в сохранных кардиомиоцитах с последующей их гипертрофией. В случаях возникновения обширного участка ишемии или недостаточности кровоснабжения сохранного миокарда, что наблюдается при распространенном стенозирующем атеросклерозе венечных артерий сердца, наличии предшествующих дистрофических изменений миокарда, нарушениях его метаболизма, гемодинамики, иннервации (например, при сахарном диабете), этот компенсаторный механизм не срабатывает, в результате чего быстро нарастает острая сердечная недостаточность. Ряд морфологов и клиницистов эту стадию называет острой очаговой ишемической дистрофией миокарда и рассматривает как самостоятельную форму острой ИБС. В этом случае в развитии инфаркта миокарда выделяют только две последующие стадии. Некротическая стадияхарактеризуется уже видимым некрозом, что отмечается через 18—24 ч от момента начала ишемии. В миокарде имеется очаг неправильной формы, желтовато-белого цвета, дряблой консистенции, окруженный темно-красным венчиком (ишемический инфаркт с геморрагическим венчиком). При микроскопическом исследовании сердечной мышцы выделяют три зоны: некротическую, демаркационную и сохранного миокарда. Зона некроза представлена кардиомиоцитами с явлениями кариолизиса, плазмолизиса и плазморексиса, окруженных демаркационным воспалением, в зоне которого помимо большого количества гипе-ремированных сосудов имеется множество полиморфноядерных нейтрофилов (лейкоцитарный вал). Лейкоцитарная инфильтрация особенно выражена на 2—3-й день от начала заболевания. В сохранном миокарде наблюдаются явления отека. При трансмуральном характере инфаркта миокарда заболевание часто осложняется развитием фибринозного перикардита. Стадия организации.Уже с 3-го дня начинается дезинтеграция погибших мышечных клеток макрофагами, появляются отдельные фибробласты. Однако лишь к 7-му дню по краям некроза формируется грануляционная ткань (свидетельствующая об организации инфаркта) с большим количеством фибробластов, макрофагов, постепенно в течение месяца замещающая пораженный участок. В итоге на 28-й день образуется рубец (постинфарктный кардиосклероз). Общая летальность при инфаркте миокарда достигает 30-35%, причем основная масса больных умирает в течение первых трех суток, а около 15-20% пациентов погибает на догоспитальном этапе. Так, ежегодная смертность от инфаркта миокарда в 1996-2000 гг. в Москве превысила 65 на 100 тыс. населения, тогда как в США от этого заболевания ежедневно умирало до 140 человек. Определенное значение имеет возраст больных. Так, у молодых лиц атеросклероз поражает преимущественно крупные магистральные венечные артерии, а коллатеральное кровоснабжение (развивающееся, как правило, у пожилых больных) отсутствует. Вот почему у мужчин 25—35 лет с инфарктом миокарда отмечается высокая летальность, достигающая 80%. Причинами смерти чаще всего служат острая сердечно-сосудистая недостаточность, кардиогенный шок, фибрилляция желудочков, асистолия. Нарушения ритма особенно часто возникают при поражении межжелудочковой перегородки, в которой локализуется проводящая система сердца. В результате размягчения сердечной мышцы в области трансмурального инфаркта (миомаляция) возможно развитие острой аневризмы сердца с ее последующим разрывом на протяжении до 1-3 см, наиболее часто отмечаемым на 3-7-й день. В этом случае смерть наступает от тампонады полости перикарда. При этом в танатогенезе принимает участие не только механическое сдавление сердца излившейся кровью, количество которой в полости сердечной сорочки может достигать 500 мл и более, но и рефлекторная остановка сердца вследствие раздражения нервных окончаний блуждающего нерва. Сравнительно редко возможен разрыв межжелудочковой перегородки, вызывающий значительные нарушения гемодинамики, прогрессирующую острую сердечно-сосудистую недостаточность, нарушения ритма и гибель большинства больных в течение недели. При локализации инфаркта миокарда в области сосочковой мышцы высока вероятность ее полного отрыва, что, как правило, вызывает смерть в ближайшие часы. При неполном отрыве сосочковой мышцы в последующем формируется недостаточность митрального клапана. В случаях острой аневризмы и при субэндокардиальной локализации некроза может произойти повреждение эндокарда и образование пристеночных тромбов. Последние могут стать источником тромбоэмболии, в том числе и смертельных. Следует отметить, что вероятность образования тромбов значительно повышается при наличии у больного нарушений ритма сердца. При трансмуральном инфаркте миокарда возможно также развитие фибринозного перикардита, аритмий (полной или неполной блокады сердца, желудочковых экстрасистол, пароксизмальной аритмии и др.), отека легких, так называемой "сердечной астмы". Боли могут иррадиировать в брюшную полость, давая картину "острого живота" (абдоминальная форма инфаркта миокарда). У больных возможна ложная симптоматика острого нарушения мозгового кровообращения (церебральная форма). В ряде случаев (у стариков, физически сильных людей, как правило, злоупотребляющих алкоголем, больных сахарным диабетом) отмечается безболевая форма инфаркта миокарда. Такие атипичные формы заболевания часто диагностируются с опозданием (в 13-20% случаев лишь на секционном столе), что приводит к позднему, а иногда и неправильному лечению больного, увеличению частоты осложнений и летальных исходов. Следует отметить, что в редких случаях (особенно при интенсивном раннем лечении инфаркта миокарда антикоагулянтными препаратами) в результате реперфузии и затруднения оттока крови по мик-роциркуляторному руслу и интрамуральным венам (вследствие повышения сосудистого тонуса, тромбоза или сдавления) возможна имбибиция кровью (геморрагическое пропитывание) некротизированных участков. При этом формируется не характерный для сердца геморрагический инфаркт, протекающий особенно тяжело и с частыми тяжелыми расстройствами сердечного ритма. Как правило, такая форма инфаркта миокарда развивается у лиц среднего возраста, страдающих артериальной гипертензией и злоупотребляющих алкоголем. Хроническая ишемическая болезнь сердца В это понятие входят постинфарктный (крупноочаговый) кардиосклероз, диффузный мелкоочаговый (атеросклеротический) кардиосклероз хроническая аневризма сердца. Рубец, возникающий в результате организации инфаркта, имеет вид белесоватого очага плотной консистенции, неправильной формы, окруженного гипертрофированным миокардом (компенсаторная постинфарктная гипертрофия). Он еще лучше виден при микроскопическом исследовании. Окраска пикрофуксином по ван Гизону придает рубцовой ткани красный, а сохранной мышечной — желтый цвет. Особенно значительное увеличение кардиомиоцитов наблюдается в периинфарктной зоне, что получило название регенерационной гипертрофии, первоначально частично или реже полностью компенсирующей нарушенное функционирование сердца. При диффузном мелкоочаговом кардиосклерозе в миокарде на разрезе наблюдаются множественные мелкие, диаметром до 1—2 мм, очаги белесоватой соединительной ткани. В венечных артериях сердца при этом отмечаются суживающие просвет фиброзные бляшки, вызывающие постоянную ишемию сердечной мышцы. В ряде случаев отмечаются атрофия и липофусциноз кардиомиоцитов. Хроническая аневризма сердца образуется из неразорвавшейся острой или в результате выпячивания постинфарктной рубцовой ткани под давлением крови. В 75 % случаев аневризма локализуется в передне-боковой стенке левого желудочка и верхушке сердца. Сердце увеличено в размерах, с выбухающей истонченной в области аневризмы стенкой левого желудочка, представленной фиброзной тканью. Как правило, в области аневризмы наблюдают пристеночные тромбы. Сравнительно редко у пожилых лиц в фиброзной ткани происходит отложение солей кальция, из-за чего стенка аневризмы принимает вид известковой скорлупы. Чрезвычайно большой редкостью является образование в стенке аневризмы путем метаплазии костной ткани (оссификация). В настоящее время хроническая аневризма сердца многими исследователями рассматривается как осложнение ИБС, а не как самостоятельное заболевание. Больные хронической ИБС наиболее часто умирают от хронической сердечно-сосудистой недостаточности, возникающей при декомпенсации сердца. Возможно, особенно при наличии хронической аневризмы сердца, развитие тромбоэмболического синдрома. |
