Химия. Экзамен. Атомномолекулярное учение. Предмет химии. Химия
 Скачать 1.58 Mb. Скачать 1.58 Mb.
|
|
Атомно-молекулярное учение. 1. Предмет химии. Химия - наука о веществах, их свойствах и взаимных превращениях. Предмет химии - химические элементы и их соединения, а также закономерности, которым подчиняются химические реакции. Разделы химии: аналитическая, биохимия, геохимия, коллоидная, неорганическая, нефтехимия, органическая, общая, физическая, высокомолекулярная, экологическая. Задачи: 1. Синтезировать новые вещ-ва с заданными св-ми. 2. Разработка и создание новых источников энергии. 3. Охрана окружающей среды. 4. Выяснение механизмов биохимических вещ-в. 2. Атом, молекула, химический элемент. Атом - это наименьшая химически неделимая частица вещества. Атом состоит из положительно заряженного ядра и отрицательно заряженной электронной оболочки. Молекула – это наименьшая частица вещества, которая сохраняет его химические свойства. Молекулы состоят из атомов. Химический элемент – вид атомов с одинаковым зарядом ядра. Каждый химический элемент имеет свое название и свой химический символ 3. Простое вещество, сложное вещество. 1. Простые – молекулы таких веществ состоят из атомов одного вида. В химических реакциях не могут разлагаться с образованием нескольких более простых веществ. 2. Сложные – молекулы таких веществ состоят из атомов разного вида. В химических реакциях могут разлагаться с образованием более простых веществ. Сложные вещества принято делить на две группы: неорганические вещества и их производные и органические вещества и их производные. Например, каменная соль – это неорганическое вещество, а крахмал, содержащийся в картофеле – органическое вещество. 4. Моль. Моль – это количество вещества, в котором содержится столько же частиц, сколько атомов содержится в 12 граммах углерода с атомной единицей массы 12. 5. Относительная атомная и молекулярная масса. Относительной атомной массой является величина, равная отношению реальной массы атома конкретного химического элемента к 1/12 реальной массы атома углерода. Это безразмерная величина, так как делятся две массы. Ar = mат. / (1/12)mугл. Относительная молекулярная масса показывает, во сколько раз масса молекулы или формульной единицы больше атомной единицы массы. Это тоже безразмерная величина. Она равна сумме относительных атомных масс всех химических элементов с учётом индексов в формуле вещества. 6. Молярная масса. Моля́рная ма́сса - характеристика вещества, отношение массы вещества к количеству молей этого вещества, то есть масса одного моля вещества. 7. Закон сохранения массы вещества. Масса веществ, вступивших в реакцию, равна массе продуктов реакции. Теоретически был описан в 1748 году, а экспериментально подтверждён в 1756 году русским ученым М.В. Ломоносовым. Ломоносов определил, что если сосуд с металлом взвесить до и после нагревания, не вскрывая его, то масса останется неизменной. В 1789 году французский учёный Антуан Лавуазье подтвердил выводы Ломоносова. 8. Закон постоянства состава. Вещество, независимо от способа его получения, всегда имеет постоянный качественный и количественный состав. Вещества с постоянным составом названы дальтонидами. Бертоллиды- вещ-ва с переменным составом. Сформулировал в 1808г. французский учёный-химик Жозеф Луи Пруст. 9. Закон кратных отношений. Если два элемента образуют друг с другом несколько химических соединений, то массы одного из элементов, приходящиеся на одну и ту же массу другого, относятся между собой как небольшие целые числа. Сформулирован в 1803 г. английским химиком Джоном Дальтоном. 10. Закона Авогадро и следствия из него. В равных объемах газа при одинаковых условиях содержится равное количество молекул. Сформулирован итальянским ученым Амедео Авогадро в 1811 г. Этот закон также можно вывести из основного уравнения молекулярно-кинетической теории: p=nkT, n=N\V. Следствие 1: Один моль любого газа при одинаковых условиях занимает одинаковый объем. В частности при нормальных условиях объем одного моля идеального газа равен 22,4 л. Этот объем называют молярным объемом VМ=М\n. Следствие 2. Отношение масс одинаковых объемов двух газов есть величина постоянная для данных газов. Эта величина называется относительной плотностью D=m1\m2=M1\M2/ 11. Эквивалент. Закон эквивалентов. Эквивалент (Э) – реальная или условная частица вещества, которая может присоединить, заместить в кислотно-основных реакциях один ион водорода (или другого одновалентного элемента), а в ОВР – присоединить или высвободить один электрон. Под условной частицей вещества подразумевается реально существующие частицы (молекулы, ионы, электроны и т.д.), доли этих частиц (например, 1/2 иона) или их группы. Закон эквивалентов: массы (или объемы) реагирующих веществ пропорциональны молярным массам эквивалентов (или эквивалентным объемам) этих веществ. 12. Основные классы неорганических соединений. Номенклатура. Химические свойства оксидов, гидроксидов (основания, кислоты, амфотерные гидроксиды) и солей.  Основные оксиды это те, которым соответствуют гидроксиды – основания. Основными называют оксиды, взаимодействующие с кислотами с образованием соли и воды. Основные оксиды образуются только металлами в степени окисления +1,+2 (иногда +3), например: BaO, SrO, FeO, MnO, CrO, Li2O, Bi2O3, Ag2O. Кислотные оксиды - оксиды, которые при взаимодействии с основаниями образуют соль и воду. Кислотным оксидам соответствуют гидроксиды – кислоты. Кислотные оксиды – это оксиды неметаллов в различных степенях окисления, либо оксиды металлов в высокой степени окисления (+4 и выше). Примеры: SO2, SO3, Cl2O7, Mn2O7, CrO3. Амфотерные оксиды взаимодействуют и с кислотами и со щелочами, проявляя свойства кислотных и основных оксидов. Им соответствуют амфотерные гидроксиды. Все они твердые вещества, нерастворимые в воде. Примеры амфотерных оксидов: ZnO, BeO, SnO, PbO, Al2O3, Cr2O3, Sb2O3, MnO2. Несолеобразующие оксиды – это оксиды неметаллов, которым не соответствуют гидроксиды и соли. Примеры: CO, N2O, NO, SiO. ОСНОВАНИЯ – сложные вещества, в которых на атом металла приходится одна или несколько гидроксогрупп ОН- КИСЛОТЫ – сложные вещества, молекулы которых состоят из одного или нескольких атомов водорода и кислотного остатка. СОЛИ – ионные соединения, состоящие из катионов металлов (или аммония) и анионов кислотных остатков. Любую соль можно рассматривать как продукт реакции нейтрализации основания кислотой. В зависимости от того, в каком соотношении взяты кислота и основание, получаются соли: средние (ZnSO4, MgCl2) – продукт полной нейтрализации основания кислотой, кислые (NaHCO3, KH2PO4) – при избытке кислоты, основные (CuOHCl, AlOHSO4) – при избытке основания. Хим. св-ва. 1. Основные оксиды, образованные щелочными и щелочноземельными металлами, взаимодействуют с водой, образуя растворимое в воде основание — щёлочи. CaO+H2O→Ca(OH)2 2. Основные оксиды взаимодействуют с кислотами, образуя соль и воду. CuO+H2SO4→CuSO4+H2O. 3. Основные оксиды могут взаимодействовать с оксидами, принадлежащими к другим классам, образуя соли. MgO+CO2→MgCO3 1. Кислотные оксиды могут взаимодействовать с водой, образуя кислоты. SO3+H2O→H2SO4 2. Кислотные оксиды взаимодействуют со щелочами, образуя соль и воду. SO2+2NaOH→Na2SO3+H2O . 3. Кислотные оксиды могут реагировать с основными оксидами, образуя соли. CO2+CaO→CaCO3 1. Амфотерные оксиды при взаимодействии с кислотой или кислотным оксидом проявляют свойства, характерные для основных оксидов. ZnO+2HCl→ZnCl2+H2O . Так же, как основные оксиды, они взаимодействуют с кислотами, образуя соль и воду. 2. Амфотерные оксиды при взаимодействии со щёлочью или с оксидом щелочного или щелочноземельного металла проявляют кислотные свойства. При сплавлении их со щелочами протекает химическая реакция, в результате которой образуются соль и вода. ZnO+2KOH→K2ZnO2+H2O . Химические свойства солей определяются свойствами катионов и анионов, которые входят в их состав. 1. Некоторые соли разлагаются при прокаливании. CaCO3 = CaO + CO2↑ 2. Взаимодействуют с кислотами с образованием новой соли и новой кислоты. Для осуществление этой реакции необходимо, чтобы кислота была более сильная чем соль, на которую воздействует кислота. 2NaCl + H2 SO4 → Na2SO4 + 2HCl↑.3. Взаимодействуют с основаниями, образуя новую соль и новое основание. Ba(OH)2 + Mg SO4 → BaSO4↓ + Mg(OH)2.4. Взаимодействуют друг с другом с образованием новых солей. NaCl + AgNO3 → AgCl + NaNO3 . 5. Взаимодействуют с металлами, которые стоят в раду активности до металла, который входит в состав соли. Fe + CuSO4 → FeSO4 + Cu↓.   Строение атома. 1. Ранние модели строения атома. 1. Первая модель строения атома была предложена Дж. Томсоном в 1904 г., согласно которой атом – положительно заряженная сфера с вкрапленными в нее электронами. Томсоновская модель позволяла объяснить явления испускания, поглощения и рассеяния света атомами, а также установить число электронов в атомах легких элементов. Электроны удерживаются внутри положительно заряженной сферы упругими силами. Те из них, которые находятся на поверхности, могут легко «выбиваться», оставляя ионизированный атом. 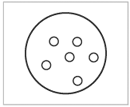 2. Э. Резерфордом (1911 г.), который доказал, что положительный заряд и практически вся масса атома сконцентрированы в малой части его объема – ядре, вокруг которого двигаются электроны. Эта модель строения атома известна как планетарная, т. к. электроны вращаются вокруг ядра подобно планетам солнечной системы. Согласно законам классической электродинамики, движение электрона по окружности вокруг ядра будет устойчивым, если сила кулоновского притяжения будет равна центробежной силе. Однако, в соответствии с теорией электромагнитного поля, электроны в этом случае должны двигаться по спирали, непрерывно излучая энергию, и падать на ядро. Однако атом устойчив. К тому же при непрерывном излучении энергии у атома должен наблюдаться непрерывный, сплошной спектр. На самом деле спектр атома состоит из отдельных линий и серий. Таким образом, данная модель противоречит законам электродинамики и не объясняет линейчатого характера атомного спектра. 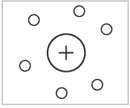 3. В 1913 г. Н. Бор предложил свою теорию строения атома, не отрицая при этом полностью предыдущие представления. В основу своей теории Бор положил два постулата. Первый постулат говорит о том, что электрон может вращаться вокруг ядра только по определенным стационарным орбитам. Находясь на них, он не излучает и не поглощает энергию. Второй постулат говорит о том, что при переходе с одной орбиты на другую электрон поглощает или выделяет квант (порцию) энергии. 3. В 1913 г. Н. Бор предложил свою теорию строения атома, не отрицая при этом полностью предыдущие представления. В основу своей теории Бор положил два постулата. Первый постулат говорит о том, что электрон может вращаться вокруг ядра только по определенным стационарным орбитам. Находясь на них, он не излучает и не поглощает энергию. Второй постулат говорит о том, что при переходе с одной орбиты на другую электрон поглощает или выделяет квант (порцию) энергии.2. Элементарные частицы атома. Состав атомного ядра. Изотопы. Электроны - стабильные отрицательно заряженные элементарные частицы массой около 9*10-31 кг каждая. Электроны - один из основных структурных элементов вещества: электронные оболочки атомов определяют оптические, электрические, магнитные, химические свойства атомов и молекул, а также большинство свойств твердых тел. Протоны – положительно заряженные частицы, масса каждого из них превышает массу электрона в 1836 раз. Нейтроны являются нейтральными элементарными частицами. Масса нейтрона немного превышает массу протона. Протоны и нейтроны составляют атомное ядро. Изотопы - разновидности атомов (и ядер) какого-либо химического элемента, которые имеют одинаковый атомный (порядковый) номер, но при этом разные массовые числа, имеют разное количество нейтронов. Изотпы водорода: протий Н11. дейтерий Н12 . тритий13. 3. Современные представления о состоянии электрона в атоме. Квантово-механическая теория содержит два основных положения. 1. Электрон имеет двойственную природу. Он обладает свойствами и частицы, и волны одновременно. Как частица электрон имеет массу и заряд, однако движение электронов - это волновой процесс. Электронам свойственно явление дифракции (поток электронов огибает препятствие). 2. Положение электрона в атоме неопределенно. Это означает, что невозможно одновременно точно определить и скорость электрона, и его координаты в пространстве. — энергию электрона в атоме (точнее, энергию системы, со-стоящей из этого электрона, других электронов и ядра; — форму образуемого данным электроном электронного облака. Электрон в атоме не имеет траектории движения. Квантовая механика рассматривает вероятность пребывания электрона в пространстве вокруг ядра. Электрон, который быстро движется, может находиться в любой части пространства, окружающего ядро, и разные положения его рассматриваются как электронное облако с определенной плотностью отрицательного заряда. 4. Квантовые числа. Квантовые числа — энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится. Главное квантовое число (п) характеризует энергетический уровень и определяет размер электронного облака, т. е. среднее расстояние электрона от ядра; принимает целочисленные значения 1, 2, 3, ..., п, которые соответствуют номеру энергетического уровня. Чем больше п, тем выше энергия электрона, следовательно, минимальная энергия соответствует первому уровню (п = 1). Орбитальное или побочное квантовое число (l) характеризует энергетический подуровень и определяет форму электронного облака; принимает целочисленные значения от 0 до (п - 1). Его значения обычно обозначаются буквами: s p d f Магнитное квантовое число (ml) характеризует ориентацию электронного облака в магнитном поле; принимает целочисленные значения от – l до +l: |
