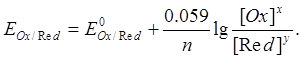динамика және кинематика реферат. азастан Республикасыны Білім жне ылым министрлігі Семей аласыны Шкрім атындаы университеті КеА
 Скачать 168.33 Kb. Скачать 168.33 Kb.
|
Қазақстан Республикасының Білім және ғылым министрлігі «Семей қаласының Шәкәрім атындағы университеті» КеАҚ  Тақырыбы: Электрохимиялық динамика және кинетика Oрындаған: Бекболат Айнур Тобы: ХМ-901 Тексерген: Шәріпхан Ж.Ш Семей 2021 ж Кернеулер қатары металдардың химиялық қасиеттерін сипаттайды: металл неғұрлым сол жаққа қарай тұрса, соғұрлым ол химиялық активті, оңайырақ тотығады және өз иондарынан қиынырақ қалпына келеді; бұл қатардағы әр металл одан кейінгі тұрған металдардың барлығын тұзды ерітіндіден ығыстырады; сутегінен солға қарай орналасқан металлдардың барлығы оны ерітілген қышқылдардан ығыстырады; берілген екі металл бір-бірінен неғұрлым алыс орналасса, соғұрлым олардан құрылған гальваникалық элементтің ЭҚК-і көп болады. Электродтық потенциалдардың түзілуі. Кез келген металдың кристалл торы түйінінде оң зарядты металл ионы орналасады. Металл иондары беттік қабаттан бөлініп гидраттанған күйде ерітіндіге тарайды. Металл иондары әсерінен ерітінді оң зарядталады да, металл пластина артық электрондар болғандықтан теріс зарядталады. Бірақ, металл катиондары онша алыстамай, теріс зарядты металл пластинасына тартылып, сол пластина айналасына орналасады. Соның нәтижесінде ертіндіде екі қабат - қос электрлік қабат пайда болады. Металл мен ерітінді арасында біршама потенциал айырмасы түзіледі. Металл иондарының ерітіндіге бөлінуі қайтымды процесс. Тепе-теңдік орнаған кездегі металл мен оны қоршаған ерітінді арасында пайда болған потенциалдар айырмасын электродтық потенциал дейді. Әрбір электродтық потенциал металдың табиғатына, ерітіндідегі иондар концентрациясына және температураға тәуелді болады. Егер электродтық потенциал стандартты жағдайда өлшенетін болса - T=298 K және Р=105 Па, және металл пластина иондарының активтігі бірге тең өз тұзы ерітіндісіне батырылған болса, оның электрондтық потенциалы берілген температурада тұрақты шама болады. Осындай потенциалды стандартты электродтық потенциал дейді. Металдардың стандартты электродтық қатары олардың химиялық қасиетін көрсетеді. Металдың стандартты электродтық потенциалының алгебралық мәні неғұрлым кіші болса, оның соғұрлым тотықсыздандырғыш қасиеті жоғары, тотықтырғыш қасиеті төмен болады.
Металдың электродтық потенциалының температураға және концентрацияға байланыстылығы мына теңдеуден (Нерст теңдеуі) көрінеді: R - 8,315 Дж/(К×моль) – газ тұрақтысы; F - 96500 Кл – Фарадей саны; Т- абсолюттік температура; n – металл ионының заряды; [Ox] және [Red] – сәйкес тотыққан және тотықсызданған формаларының концентрациялары, моль/л.
Бұл теңдеуге 25°С (298 К) үшін тұрақтылардың мәндерін койғаннан кейін оның түрі мынадай болады: Гальваникалық элемент. Химиялық процестер кезінде электр тогы түзілетін болса, ондай процестерді электрохимиялық процестер дейді. Электрохимиялық процестерге гальвани элементтерінде, электролиз, металдар коррозиясы кезінде жүретін тотықсыздану реакциялары жатады. Егер тотықтырғыш кеңістіктерін бөліп, электрондарды металл өткізгіш бойымен жүргізетін болсақ, мұнда гальвани элементін аламыз. Яғни, гальвани элементі тотығу-тотықсыздану кезінде кезінде түзілетін химиялық энергияны электр тогы энергиясына айналдырады. Мысал ретінде Даниэль-Якоби элементінің жұмыс принципін қарастырайық: екі құтыны алып, оларға мырыш және мыс тұздары ерітіндісін құяды, оларға өздерінің металл пластинасын батырады. Екі құтыны ерітінді толтырылған түтікше арқылы жалғастырады. Мырыш және мыс пластинкаларын металл өткізгішпен қосқан кезде жүйеде электр тогы пайда болады: Zn0 –2ē ® Zn2+. Мырыштан бөлінген электрондар металл өткізгіш бойымен мыс арқылы CuSO4 -беріліп, мыс тотықсызданады: Cu2+ +2ē ® Cu0. Осы кезде түтікше арқылы SO Tеңдеуден бұл қарапайым тотығу-тотықсыздану реакциясы екені көрініп тұр. Бірақ электрон металл өткізгіш арқылы ауысқандықтан бұл процесс кезінде химиялық энергия электр тогғына айналып тұр. Электроды металл өткізгішке беріп тұрған мырыш электроды - теріс, ал мыс электроды - оң деп аталады. Тотығу процесі жүретін электрод анод, ал тотықсыздану процесі жүретін электрод катод деп аталады. Келтірілген мысалда, мырышта тотығу процесі жүреді - ол анод (А), ал мыста тотықсыздану процесі жүреді - ол катод (К). Мұндай таңбалау галвани элементтерінде ғана қолданылады. Электролиз процесі жүргенде электродтар керісінше аталады. Теріс электрод –катод, оң электрод -анод болады. Гальваникалық элементті электрохимиялық сызба-нұсқа түрінде жазады: (–) Zn | Zn2+ || Cu2+ | Cu (+). Mұнда бір сызық электрод пен ерітінді арасындағы шекті, ал екі сызық ерітінділер арасындағы шекті көрсетеді. Екі жағына жақша ішіне электродтар зарядын қояды. Анодты солға, катодты оңға жазады. Отындық элемент. Онда отынның (көмірдің, кокстың, жанар газдардың және т.б.) немесе оларда қайта өңдеу өнімдерінің (сутектің, көмір оксидінің және т.б.) оттекте жану реакциясы жүреді. Бөлінетін энергия бірден тікелей тұрақты тоққа айналады. Отындық элементтердің тиімді жұмысы үшін катализаторларды (мысалы металл пластинасы немесе қоспасы, Co және Al немесе Fe, Mn және Ag) электродқа жұқа қабатпен қаптайды. Отындық элементтердің пайдалану коэффициенті өте жоғары (80%-дан жоғары), үздіксіз жұмысы және т.б. оларды келешекте кеңінен қолдануға жол ашады. Сонымен стандартты электродтық потенциал деп, электродтың үрдісіне қатысатын заттардың концентрациясы бірге тең болғандағы электродтың потенциалын айтамыз. Электродтың атауы – онымен жүзеге асатын реакцияның түрімен аталады: тотығу үрдісі өтетін электрод – анод деп, ал тотықсыздану үрдісі өтетін электрод катод деп аталады. Гальваникалық элементтің жұмыс істеуіне қажетті шарт – электродтардағы потенциалдар айырымы, ол гальваникалық элементтің электр қозғаушы күші (ЭҚК) деп аталады. Әрбір жұмыс істейтін электр қозғалту күші – оң таңбалы болады. Кез-келген бейметалдық элементтің электр қозғалту күші электродтың потенциалдардың айырымынан есептеп алуға болады. Ол үшін үлкен оң мәннен кішісін алып тастау керек. Гиббс энергиясы электродтық потенциалмен мына теңдеумен байланысқан: Гальваникалық элементтің ЭҚК-н біле отырып, гальваникалық элементте жүретін реакциядағы Гиббс энергиясын есептеуге болады. Тоқтың химиялық көздері болып гальваникалық элементтер, аккумуляторлар және т.б. элементтер жатады. Аккумулятор – бірнеше рет қолдануға келетін қайтымды гальваникалық элементтерді айтады. Олар жиналған химиялық энергияны электр энергиясына айналдыра алады (разрядтаған кезде) және электр энергиясын химиялық энергияға айналдырады. Аккумулятордың энергиясын қолданғаннан соң, оны тағы тоқ өткізу арқылы қалпына келтіруге болады. Химиялық энергияны тотығу – тотықсыздану негізінде электр тоғына айналдыру қазіргі ғылым алдында тұрған ең негізгі мәселелелердің бірі болып табылады. Оларды отындық элементтер деп атайды. Тотықтырғыш зат ретінде кәдімгі отын-көмір, кокс, табиғи және қолдан жасалған табиғи газ қолдануда. Тотықтырғыш ретінде оттегі мен ауаны пайдаланады. Энергетикалық тұрғыдан сутегі ыңғайлы. Электролит балқымасында немесе ерітіндісінде әр аттас иондар хаосты қозғалыста болады. Егер осындай балқымаға немесе ерітіндіге электродтар батырып оларды тұрақты ток көзіне қосса катиондар катодқа, ал иондар – анодқа қарай жылжи бастайды. Электролит балқымасы немесе ерітіндісі арқылы электр тогі өткен кезде электродтарда жүретін тотығу-тотықсыздану процесін электролиз дейді. Электролиз кезінде электр энергиясы химиялық реакция энергиясына, атап айтқанда тотығу және тотықсыздану энергиясына айналады. Электролиз кезінде катод – тотықсыздандырғыш, ол катиондарға электрондар береді. Ал анод – тотықтырғыш, өйткені ол атомдардан электрондарды алады. Электролиз кезіндегі электродтық үрдістерге және оның жүруіне электролизденетін заттың құрамы, еріткіш, электрод материалы және электролиз жағдайы әсер етеді. Электролиттердің балқымаларының электролизі. CuCl2 – балқыған кезде молекулалар иондарға ыдырайды және олар сәйкес электродтарға қарай қозғалады: анодқа және катодқа. CuCl2 → Cu2+ + 2Cl Катодта таза мыс бөлінеді: Cu2+ +2ē → Cu0 тотықтырғыш, тотықсыздану процесі. Анодта газ тәрізді таза хлор бөлінеді: 2Cl Электролиттер ерітіндісіндегі электролиз – күрделі процесс, өйткені электролиттерден басқа мұнда су молекулалары бар. Электролиз үрдісінде қатыспайтын, инерттік электродтардың бетін қарастырайық (графит, көмір, платина). Катодта келесі рекциялардың жүруі мүмкін: Электролиттер ерітіндісіндегі электролиз – күрделі процесс, өйткені электролиттерден басқа мұнда су молекулалары бар. Электролиз процесінде қатыспайтын, инертті электродтардың бетін қарастырайық (графит, көмір, платина). Катодта келесі реакциялардың жүруі мүмкін: 1) Электродтық потенциал аз мөлшерлі металдар катионы (Li+-ден Al3+ қоса алғанда) катодта қалпына келмейді, олардың орнына судың молекулалары қалпына келеді және катодта газ тәрізді сутек пайда болады: 2Н2О +2ē → Н 2) Стандартты электродтық потенциалы алюминийден сутекке дейін орналасқан металдар катиондары электролиз кезінде су молекулаларымен бірге қалпына келеді: Меn+ +nē → Me0; 2H2O +2ē → H 3) Стандартты электродтық потенциалы сутектен жоғары (Cu2+-ден Au3+-ке дейін) болатын металдар катиондары толығымен қалпына келеді Mеn+ +nē → Me0. Анодта өтетін реакциялар сипаттамасы су молекулаларының бар болуынан және анод жасаған затқа тәуелді болады. Электролиз кезінде ерімейтін анодтар электрондарды сыртқы ортаға жібермейді, электрондарды аниондар мен су молекулалары тотығу кезінде жібереді. Оттексіз қышқылдар аниондары өте жылдам тотығады 2Cl Егер ерітіндіде оттекті қышқыл болса (мысалы SO 2Н2О –4ē → О Еритін анод жағдайында анод сыртқы ортаға өз электрондарын жібереді. Сол кезде оның иондары ерітіндіге кетеді де, анод ыдырайды Ме0 –nē → Men+. Цинк сульфаты ерітіндісі мен инертті электродтар электролизі. E Катод: Zn2+ +2ē = Zn, 2H2O +2ē = H2↑ + 2OH Aнод: 2Н2О –4ē = О2↑ + 4Н+, Zn2+ + 2H2O = Zn + H2↑ + O2↑ + 2H+, немесе молекулалық түрде: ZnSO4 + 2H2O = Zn + H2↑ + O2↑ + H2SO4. Электролит арқылы өткен электр тоғы мен электролиз кезінде бөлініп шыққан заттың арасында байланыс бар, бұл Фарадейдің екі заңымен түсіндіріледі. Фарадейдің І заңы – электролиз кезінде электродта бөлініп шыққан заттың массасы, электролит ерітіндісі арқылы өткен электр тоғына тура пропорционал: m – электродта бөлінген заттың массасы, г; E – электрохимиялық эквивалент, ол электролит арқылы бір кулон тоқ өткенде түзілетін заттың массасы, г; Q – ток күші (I) мен уақыттың (t) көбейтіндісіне тең электр мөлшері. Фарадейдің ІІ заңы – электролиз кезіндегі бірдей электр тоғы әртүрлі заттардың бірдей эквиваленттік массасын бөліп шығарады: 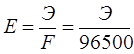 . .Мұндағы Э – заттың химиялық эквиваленті. Фарадейдің екі заңын біріктіріп мынадай теңдеумен көрсетуге болады: 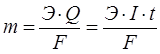 . .Тұздарының балқымаларын электролиздеу арқылы сілтілік, сілтілік – жер металдардың өндіреді, ал ерітінділерін электролиздеу арқылы мыс, мырыш, никель кобальт, марганец т.б. металдар алынады. Еритін анодтарды қолданып тұздарын электролиздеу арқылы мысты, никельді рафинайдтайды (тазартады). Электролизді металдарды және пластмассаларды әр түрлі металдармен қаптау үшін қолданады. Химия өнеркәсәбіңде электролиз арқылы судан сутегі, оттегі хлор жіне әр түрлі тотықтырғыштар алуға қолданады.
|