Бактериофаги
 Скачать 0.61 Mb. Скачать 0.61 Mb.
|
|
ФГБОУ ВПО «Марийский Государственный Университет» Биолого-Химический факультет кафедра Биохимии и Физиологии Реферат по Микробиологии и основам Вирусологии на тему: «Бактериофаги» Выполнила: студентка III курса группы БПГ-21 Чеснокова Елена Проверила: доцент, к.б.н. Гажеева Т.П. Йошкар-Ола, 2011 ОглавлениеОглавление 2 Вступление 3 Бактериофаги. Их роль в биосфере 4 Строение бактериофагов 6 Взаимодействие бактериофага с бактериальными клетками 7 Жизненный цикл 9 Систематика бактериофагов 10 Применение 11 В медицине 11 В биологии 11 В микробиологической промышленности 12 Основные стадии развития и простейшие методы исследования бактериофагов 13 Список источников информации 17 ВступлениеАнглийский бактериолог Фредерик Туорт1 в статье 1915 года описал инфекционную болезнь стафилококков, инфицирующий агент проходил через фильтры, и его можно было переносить от одной колонии к другой. Независимо от Фредерика Туорта французско-канадский микробиолог Феликс Д’Эрель2 3 сентября 1917 год сообщил об открытии бактериофагов. Наряду с этим известно, что российский микробиолог Николай Фёдорович Гамалея3 ещё в 1898 году, впервые наблюдал явление лизиса бактерий (сибиреязвенной палочки) под влиянием перевиваемого агента. После открытия явлений бактериофагии Д’Эрелль развил учение о том, что бактериофаги патогенных бактерий, являясь их паразитами, играют большую роль в патогенезе инфекций, обеспечивая выздоровление больного организма, а затем создания специфического иммунитета. Это положение привлекло к явлению бактериофагии внимание многих исследователей, которые предполагали найти в фагах важное средство борьбы с наиболее опасными инфекционными болезнями человека и животных. Также Феликс Д’Эрель выдвинул предположение, что бактериофаги имеют корпускулярную природу. Однако только после изобретения электронного микроскопа удалось увидеть и изучить ультраструктуру фагов. Долгое время представления о морфологии и основных особенностях фагов основывались на результатах изучения фагов Т-группы — Т1, Т2,…, Т7, которые размножаются на Е. coli (кишечная палочка) штамма B. Однако с каждым годом появлялись новые данные, касающиеся морфологии и структуры разнообразных фагов, что обусловило необходимость их морфологической классификации. Бактериофаги. Их роль в биосфереБ 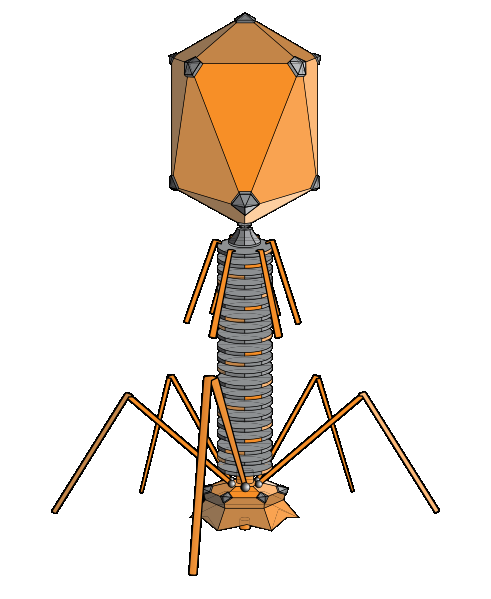 актериофаги (фаги) (от др.-греч. φᾰγω — «пожираю») — вирусы, избирательно поражающие бактериальные клетки. Чаще всего бактериофаги размножаются внутри бактерий и вызывают их лизис4. Как правило, бактериофаг состоит из белковой оболочки и генетического материала одноцепочечной или двуцепочечной нуклеиновой кислоты (ДНК или, реже, РНК). Размер частиц приблизительно от 20 до 200 нм. актериофаги (фаги) (от др.-греч. φᾰγω — «пожираю») — вирусы, избирательно поражающие бактериальные клетки. Чаще всего бактериофаги размножаются внутри бактерий и вызывают их лизис4. Как правило, бактериофаг состоит из белковой оболочки и генетического материала одноцепочечной или двуцепочечной нуклеиновой кислоты (ДНК или, реже, РНК). Размер частиц приблизительно от 20 до 200 нм.Структура типичного миовируса бактериофага (рис. 1). Бактериофаги представляют собой наиболее многочисленную, широко распространенную в биосфере и, предположительно, наиболее эволюционно древнюю группу вирусов. Приблизительный размер популяции фагов составляет более 1030 фаговых частиц. В природных условиях фаги встречаются в тех местах, где есть чувствительные к ним бактерии. Чем богаче тот или иной субстрат (почва, выделения человека и животных, вода и т. д.) микроорганизмами, тем в большем количестве в нём встречаются соответствующие фаги. Так, фаги, лизирующие клетки всех видов почвенных микроорганизмов, находятся в почвах. Особенно богаты фагами черноземы и почвы, в которые вносились органические удобрения. Бактериофаги выполняют важную роль в контроле численности микробных популяций, в автолизе стареющих клеток, в переносе бактериальных генов, выступая в качестве векторных «систем». Действительно, бактериофаги представляют собой один из основных подвижных генетических элементов. Посредством трансдукции они привносят в бактериальный геном новые гены. Было подсчитано, что за 1 секунду могут быть инфицированы 1024 бактерий. Это означает, что постоянный перенос генетического материала распределяется между бактериями, обитающими в сходных условиях. Высокий уровень специализации, долгосрочное существование, способность быстро репродуцироваться в соответствующем хозяине способствует их сохранению в динамичном балансе среди широкого разнообразия видов бактерий в любой природной экосистеме. Когда подходящий хозяин отсутствует, многие фаги могут сохранять способность к инфицированию на протяжении десятилетий, если не будут уничтожены экстремальными веществами либо условиями внешней среды. Строение бактериофаговБактериофаги различаются по химической структуре, типу нуклеиновой кислоты5, морфологии и характеру взаимодействия с бактериями. По размеру бактериальные вирусы в сотни и тысячи раз меньше микробных клеток. 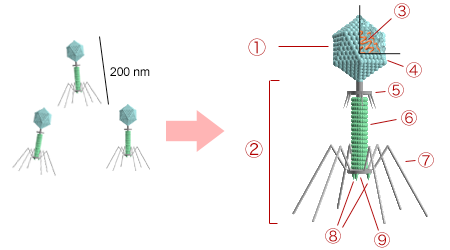 Рис. 2. Строение бактериофага 1 – головка, 2 – хвост, 3 – нуклеиновая кислота, 4 – капсид, 5 – «воротничок», 6 – белковый чехол хвоста, 7 – фибрилла хвоста, 8 – шипы, 9 – базальная пластинка. Типичная фаговая частица (вирион) состоит из головки и хвоста. Длина хвоста обычно в 2 – 4 раза больше диаметра головки. В головке содержится генетический материал – одноцепочечная или двуцепочечная РНК или ДНК с ферментом транскриптазой в неактивном состоянии, окруженная белковой или липопротеиновой оболочкой – капсидом, сохраняющим геном вне клетки. Нуклеиновая кислота и капсид вместе составляют нуклеокапсид. Бактериофаги могут иметь икосаэдральный капсид, собранный из множества копий одного или двух специфичных белков. Обычно углы состоят из пентамеров белка, а опора каждой стороны из гексамеров того же или сходного белка. Более того, фаги по форме могут быть сферические, лимоновидные или плеоморфные. Хвост представляет собой белковую трубку — продолжение белковой оболочки головки, в основании хвоста имеется АТФаза, которая регенерирует энергию для инъекции генетического материала. Существуют также бактериофаги с коротким отростком, не имеющие отростка и нитевидные. Фаги, как и все вирусы, являются абсолютными внутриклеточными паразитами. Хотя они переносят всю информацию для запуска собственной репродукции в соответствующем хозяине, у них отсутствуют механизмы для выработки энергии и рибосомы для синтеза белка. У некоторых фагов в геноме содержится несколько тысяч оснований, тогда как фаг G, самый крупный из секвенированных фагов, содержит 480 000 пар оснований — вдвое больше среднего значения для бактерий, хотя всё же недостаточного количества генов для важнейшего бактериального органоида как рибосомы. Взаимодействие бактериофага с бактериальными клеткамиПо характеру взаимодействия бактериофага с бактериальной клеткой различают вирулентные и умеренные фаги. Вирулентные фаги могут только увеличиваться в количестве посредством литического цикла. Процесс взаимодействия вирулентного бактериофага с клеткой складывается из нескольких стадий: адсорбции бактериофага на клетке, проникновения в клетку, биосинтеза компонентов фага и их сборки, выхода бактериофагов из клетки. 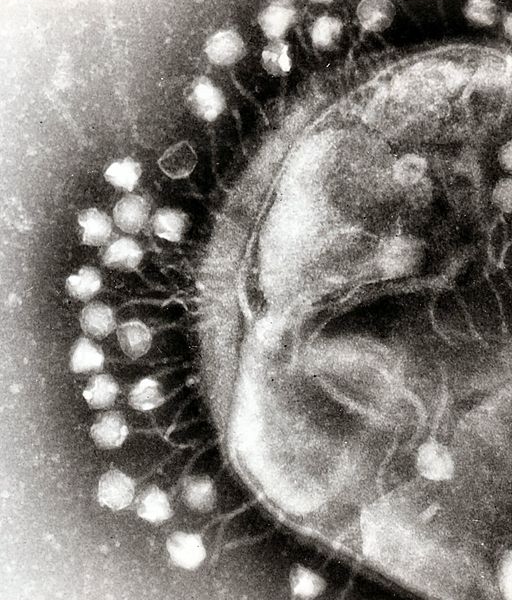 Рис. 3. Адсорбция бактериофагов на поверхности бактериальной клетки Первоначально бактериофаги прикрепляются к фагоспецифическим рецепторам на поверхности бактериальной клетки. Хвост фага с помощью ферментов, находящихся на его конце (в основном лизоцима), локально растворяет оболочку клетки, сокращается и содержащаяся в головке ДНК инъецируется в клетку, при этом белковая оболочка бактериофага остается снаружи. Инъецированная ДНК вызывает полную перестройку метаболизма клетки: прекращается синтез бактериальной ДНК, РНК и белков. ДНК бактериофага начинает транскрибироваться с помощью собственного фермента транскриптазы, который после попадания в бактериальную клетку активируется. Синтезируются сначала ранние, а затем поздние иРНК, которые поступают на рибосомы клетки-хозяина, где синтезируются ранние (ДНК-полимеразы, нуклеазы) и поздние (белки капсида и хвостового отростка, ферменты лизоцим, АТФаза и транскриптаза) белки бактериофага. Репликация ДНК бактериофага происходит по полуконсервативному механизму и осуществляется с участием собственных ДНК-полимераз. После синтеза поздних белков и завершения репликации ДНК наступает заключительный процесс — созревание фаговых частиц или соединение фаговой ДНК с белком оболочки и образование зрелых инфекционных фаговых частиц. Продолжительность этого процесса может составлять от нескольких минут до нескольких часов. Затем происходит лизис клетки, и освобождаются новые зрелые бактериофаги. Иногда фаг инициирует лизирующий цикл, что приводит к лизису клетки и освобождению новых фагов. В качестве альтернативы фаг может инициировать лизогенный цикл, при котором он вместо репликации обратимо взаимодействует с генетической системой клетки-хозяина, интегрируясь в хромосому или сохраняясь в виде плазмиды. Таким образом, вирусный геном реплицируется синхронно с ДНК хозяина и делением клетки, а подобное состояние фага называется профагом. Бактерия, содержащая профаг, становится лизогенной до тех пор, пока при определенных условиях или спонтанно профаг не будет стимулирован на осуществление лизирующего цикла репликации. Переход от лизогении к лизису называется лизогенной индукцией или индукцией профага. На индукцию фага оказывает сильное воздействие состояние клетки хозяина предшествующее индукции, также как наличие питательных веществ и другие условия, имеющие место быть в момент индукции. Скудные условия для роста способствуют лизогенному пути, тогда как хорошие условия способствуют лизирующей реакции. Очень важным свойством бактериофагов является их специфичность: бактериофаги лизируют культуры определенного вида, более того, существуют так называемые типовые бактериофаги, лизирующие варианты внутри вида, хотя встречаются поливалентные бактериофаги, которые паразитируют в бактериях разных видов. Жизненный циклУмеренные и вирулентные бактериофаги на начальных этапах взаимодействия с бактериальной клеткой имеют одинаковый цикл. Адсорбция бактериофага на фагоспецифических рецепторах клетки. Инъекция фаговой нуклеиновой кислоты в клетку хозяина. Совместная репликация фаговой и бактериальной нуклеиновой кислоты. Деление клетки. Далее бактериофаг может развиваться по двум моделям: лизогенный либо литический путь. Умеренные бактериофаги после деления клетки находятся в состоянии профага (Лизогенный путь). Вирулентные бактериофаги развиваются по Литической модели: Нуклеиновая кислота фага направляет синтез ферментов фага, используя для этого белоксинтезирующий аппарат бактерии. Фаг тем или иным способом инактивирует ДНК и РНК хозяина, а ферменты фага совсем расщепляют её; РНК фага «подчиняет» себе клеточный аппарат синтеза белка. Нуклеиновая кислота фага реплицируется, и направляет синтез новых белков оболочки. Образуются новые частицы фага в результате спонтанной самосборки белковой оболочки (капсид) вокруг фаговой нуклеиновой кислоты; под контролем РНК фага синтезируется лизоцим. Лизис клетки: клетка лопается под воздействием лизоцима; высвобождается около 200—1000 новых фагов; фаги инфицируют другие бактерии. Систематика бактериофаговБольшое количество выделенных и изученных бактериофагов определяет необходимость их систематизации. Классификация вирусов бактерий претерпевала изменения: основывалась на характеристике хозяина вируса, учитывались серологические, морфологические свойства, а затем строение и физико-химический состав вириона. В настоящее время согласно Международной классификации и номенклатуре вирусов бактериофаги, в зависимости от типа нуклеиновой кислоты разделяют на ДНК- и РНК- содержащие. По морфологическим характеристикам ДНК-содержащие фаги выделены в следующие семейства: Myoviridae, Siphoviridae, Podoviridae, Lipothrixviridae, Plasmaviridae, Corticoviridae, Fuselloviridae, Tectiviridae, Microviridae, Inoviridae Plectovirus и Inoviridae Inovirus. РНК-содержащие: Cystoviridae, Leviviridae. ПрименениеВ медицинеОдной из областей использования бактериофагов является антибактериальная терапия, альтернативная приёму антибиотиков. Например, применяются бактериофаги: стрептококковый, стафилококковый, клебсиеллёзный, дизентерийный поливалентный, пиобактериофаг, коли, протейный и колипротейный и другие. Бактериофаги применяются также в генной инженерии в качестве векторов, переносящих участки ДНК, возможна также естественная передача генов между бактериями посредством некоторых фагов (трансдукция). Фаговые векторы обычно создают на базе умеренного бактериофага λ, содержащего двухцепочечную линейную молеклул ДНК. Левое и правое плечи фага имеют все гены, необходимые для литического цикла (репликации, размножения). Средняя часть генома бактериофага λ (содержит гены, контролирующие лизогению, то есть его интеграцию в ДНК бактериальной клетки) не существенна для его размножения и составляет примерно 25 тысяч пар нуклеотидов. Данная часть может быть заменена на чужеродный фрагмент ДНК. Такие модифицированные фаги проходят литический цикл, но лизогения не происходит. Векторы на основе бактериофага λ используют для клонирования фрагментов ДНК эукариот (то есть более крупных генов) размером до 23 т.п.н. Причем, фаги без вставок — менее 38 т.п.н или, напротив, со слишком большими вставками – более 52 т.п.н не развиваются и не поражают бактерии. В биологииБактериофаги M136, фаг Т47, T7 и фаг λ8 используют для изучения белок-белковых, белок-пептидных и ДНК-белковых взаимодействий методом фагового дисплея. Поскольку размножение бактериофага возможно только в живых клетках бактериофаги могут быть использованы для определения жизнеспособности бактерий. Данное направление имеет большие перспективы, поскольку, одним из основных вопросов при разных биотехнологических процессах является определение жизнеспособности используемых культур. С помощью метода электрооптического анализа клеточных суспензий была показана возможность изучения этапов взаимодействия фаг-микробная клетка. В микробиологической промышленностиМикробиологическое производство, использующее бактерии-продуценты, может в определенных условиях оказаться зависимым от бактериофагов. Лизис бактерий в промышленных аппаратах – ферментерах, вызванный бактериофагами («фаголизис»), уменьшает выход конечного продукта или ухудшает его качество и тем самым приносит экономический ущерб. Фаголизис может стать и причиной особого, генетического, загрязнения внешней среды. В производстве обычно используются бактериальные культуры ограниченного числа видов. В случае их массового лизиса и попадания определенных фагов во внешнюю среду может наблюдаться не только качественное изменение состава микроорганизмов, но и взаимодействие «производственных» и «природных» фагов. Это может привести к появлению в природных условиях генетически новых вариантов фагов, еще более активно лизирующих данный продуцент или способных визировать близкородственные виды бактерий. Следовательно, нарушаются сложившиеся биоценотические отношения. Основные стадии развития и простейшие методы исследования бактериофаговНесмотря на чрезвычайное разнообразие бактериофагов, процедуры их исследования, за редким исключением, применимы к большинству фагов. В заводской лаборатории можно провести предварительное изучение фага с применением относительно простых методов, а затем в хорошо оснащенной специализированной лаборатории подобрать оптимальные условия для размножения фага и подвергнуть фаг подробному изучению (электронная микроскопия, анализы нуклеиновой кислоты, белков каптида и др.). Так осуществляется классификация фага и делается окончательный вывод о пути его попадания на производство. Следует предостеречь от проведения длительных работ по исследованию бактериофагов в заводских лабораториях, территориально связанных с производством. Требующиеся обычно для проведения исследований препараты фагов в высоких титрах могут стать источником новых загрязнений производства, в том числе и мутантами с расширенными спектрами литической активности. Все основные группы микроорганизмов могут быть загрязнителями биопроизводств - бактерии, грибы, фаги. Оптимальная температура для их развития находится в пределах 24-30°, т.е. это мезофильные организмы. Споры бактерий и конидий грибов могут выносить температуру 100° С, мицелиальные грибы оказываются доминирующими среди микроорганизмов при повышенной влажности. В производстве антибиотиков, некоторых плазмозаменителей крови (декстран), отдельных витаминов существенна роль споровых бактерий типа Вас. brevis, Вас. subtilis, попадающих в ферментеры с загрязненным воздухом. Как правило, в этих случаях имеет место негерметичность аппаратуры или попадание в ферментеры нестерильного наружного воздуха из-за его плохой очистки. С неочищенным воздухом в ферментеры могут попасть и фаги, приводящие к лизису чувствительные культуры. При этом не исключаются случаи активации профагов в лизогенных культурах с последующей гибелью продуцента от вегетирующего фага. Применительно к процессам ферментации вероятность проскока таких микроорганизмов в ферментеры находится в пределах 1:1000-1:100 000. Грамотрицательные бактерии из группы Escherichia coli и Pseudomonas sp. могут попасть в ферментеры с нестерильной водой. В этой связи необходимо следить за тем, чтобы сварные швы в трубопроводах и аппаратах не давали течи; чтобы гладкие поверхности фланцевых соединений оставались неповрежденными и имели резиновые прокладки. Ферментационные аппараты должны всегда иметь избыточное давление в процессе эксплуатации. В противном случае возможны подсосы нестерильного воздуха через сальники вентилей и валов мешалок. Необходимо тщательно следить за выхлопными линиями ферментеров, через которые может проникать в них грамотрицательная подвижная флора. Дрожжевые организмы могут быть в культуральной жидкости вследствие недостаточной стерилизации питательной среды, содержащей, например, кукурузный экстракт, весьма благоприятный для развития названных организмов. Железобактерии Gallionella ferruginea оказываются причиной коррозии, например, канализационных систем. Коррозия сооружений из железистых металлов, меди, свинца, цинка происходит более интенсивно в плохо аэрируемых почвах с большим содержанием растворимых солей и выраженной кислотностью. Анаэробные почвы оказываются подходящими для роста сульфатредуцирующих бактерий, и они, как правило, имеют низкий окислительно-восстановительный потенциал. В любых видах микробиологической порчи материалов или объектов важнейшим фактором является влажность, вне которой не происходит развития микробов. Поддержание относительной влажности на уровне 50-70% предотвращает развитие микрофлоры на различных материалах и объектах. Следует помнить, что микробной порче могут подвергаться самые различные объекты, ферментационные среды, готовые продукты медицинского, пищевого и другого назначения, деревянные и металлические сооружения и изделия, пластические массы, резина, лакокрасочные материалы, оптические приборы и т.д. Следовательно, во всех отраслях народного хозяйства прямо или косвенно мы имеем дело с микробами-вредителями. В основе их вредной деятельности лежит большая или меньшая метаболическая активность, когда продукты обмена веществ проявляют ту или иную агрессивность в отношении соответствующего субстрата. В биопроизводствах часто имеют дело с биомассой таких микробов, выступающих загрязнителями сред или готовых продуктов. Нередко продукты их жизнедеятельности могут явиться причиной пирогенности препаратов. К числу пирогенно действующих веществ относятся комплексно связанные белки, жиры и углеводы (полноценные антигены), тейхоевые кислоты, фосфорилированные липополисахариды. Пирогены проходят через бактериальные фильтры, устойчивы к нагреванию и многим другим факторам внешней среды. Пути действия пирогенов (в том числе бактериальных) в макроорганизме на теплорегулирующие центры многоканальны: Комплекс изменений, наблюдаемых после введения пирогенов в макроорганизм, характеризуется повышением температуры, вазомоторными расстройствами, нарушением обмена веществ. Хотя, например, повышение температуры тела может происходить за счет увеличения доли нефосфорилирующего окисления углеводов вследствие образования некоторыми микробами веществ-разобщителей, способных, подобно динитрофенолу, разобщать биологическое окисление и фосфорилирование (токсины стафилококков). Но это особый случай. Вот почему стерильный продукт должен быть свободным от пирогенных веществ. Все сапрофитные формы микробов-вредителей попадают в сферу технологического процесса из природных субстратов (почва, вода, воздух). Если же речь идет о каких-либо патогенных микробах, то в этом случае источником их выступают больные люди или бактерионосители, которые незамедлительно должны быть отстранены от работы. В других случаях существенно важной является оценка пылевого источника загрязнения. Для этого необходимо учитывать возможности запыленности воздуха рабочих помещений, коридоров, транспортных средств (например, лифтов), а также запыленность стен, выступов, трубопроводов, вентиляционных труб, вспомогательных и упаковочных материалов и т.д. Спорообразующие бактерии в загрязненном воздухе чаще относятся к группам Вас. subtilis, Вас. cereus, Вас. mesentericus, Вас. megaterium. Многие из них образуют активную пенициллиназу и прочие гидролитические ферменты. Грамотрицательные бактерии родов Escherichia, Pseudomonas, Proteus и другие (преимущественно водные обитатели) также обладают активными гидролазами, катализирующими реакции гидролиза, например, отдельных антибиотиков. Дрожжевые организмы рода Candida растут и развиваются в присутствии высоких концентраций противобактериальных антибиотиков. Из числа последних пенициллин может стимулировать их рост. Бактериальная, дрожжевая (Bacterium, Chromobacterium, Pseudomonas, Pseudobacterium, Lactobacterium, Bacillus, Micrococcus, Streptococcus, Sarcina, Mycobacterium, Torulopsis, Pichia и др.) и плесневая микрофлора более или менее постоянно сопутствуют кормовым дрожжам при их выращивании в производственных условиях. При этом снижение выхода целевого продукта может достигать 70-80%. Организмы родов Pseudomonas, Escherichia, Bacillus полностью ингибируют продукцию токсинов анаэробными клостридиями. Выброс во внешнюю среду воздуха и других составных частей материальных потоков, загрязненных грибами и бактериями - продуцентами антибиотиков, витаминов, белка, аминокислот или других биологически активных веществ, может привести к поражению культурных растений, пушных зверей и птицы, грибковым заболеваниям среди людей, а также болезням рыб, пчел и других насекомых. Нитчатые грибы и дрожжи как продуценты определенных веществ могут выступать причиной развития аллергии. Для борьбы с микробами-вредителями биопроизводств используют различные мероприятия, среди которых известны: 1. Общие: а) контроль за герметичностью технологического оборудования и систем, связанных, например, с подачей стерильного воздуха, пеногасителей и т.д.; б) личная гигиена людей, занятых в производстве; в) соблюдение правил санитарии и гигиены на всех участках технологического процесса; г) квалифицированное обслуживание работающих приборов и аппаратов в целях соблюдения регламентированных процессов. 2, Специальные: а) контроль за качеством используемой воды; б) систематический медицинский осмотр людей, занятых в производстве; в) санитарно-бактериологический контроль воздуха рабочих вспомогательных и других помещений, а также контроль влажности и температуры воздуха; г) физические и химические методы борьбы с микробами-вредителями биопроизводств. Гигиенический и санитарно-бактериологический контроль за воздухом ведут по методам, изложенным в практических курсах гигиены. Применительно к микробному обсеменению воздуха учитывают качество и количество микробов, а затем делают вывод о чистоте или загрязненности воздуха и степени его опасности для технологического процесса, а также и для работающих. Среди физических и химических методов борьбы с микробами-вредителями биопроизводств известны многочисленные приемы и вещества, обеспечивающие определенную надежность уничтожения нежелательной микрофлоры. Из физических методов укажем на фильтрацию (воздуха, питательных сред, культуральных жидкостей), тепловую стерилизацию (питательных сред, некоторых готовых средств), создание избыточного давления стерильного воздуха в соответствующих помещениях (например, в фасовочных отделениях медицинских препаратов для инъекций); использование стерильных халатов и масок людьми, занятыми в производстве; лиофилизация готового продукта перед хранением; использование ультрафиолетового и гамма-облучения для стерилизации соответственно помещений и флаконов. Применительно к антимикробным агентам и их использованию существуют следующие определения: 1) статическое действие вещества, т.е. когда агент задерживает размножение клеток. Удаление его из среды сопровождается возобновлением размножения тест-объекта. В зависимости от тест-организмов говорят о бактериостати-ческом и фунгистатическом действиях антимикробных веществ; 2) цидное действие вещества, т.е. когда агент убивает чувствительный организм, который не оживает после удаления из среды этого вещества. Эффект последнего может проявиться в растворении (лизисе) клеток или, напротив, клетки остаются неповрежденными и даже продолжают оставаться «метаболически» относительно активными; цидное действие может быть как бактерицидное, так и фунгицидное. 3. Стерильность – освобождение от любых живых клеток. Стерилизация может быть достигнута химическими веществами (а также фильтрацией и облучением). Стерильный материал может содержать интактные «метаболизирующие» клетки. 4. Дезинфектант – вещество, убивающее патогенные микроорганизмы. 5. Асептичность, характеризующаяся отсутствием микробов. Список источников информации
Электронные ресурсы:
1 Туорт (Twort) Фредерик (22.10.1877, Камберли, Англия, - 20.3.1950, там же), английский микробиолог. Член Лондонского королевского общества (1929). Получил медицинское образование в больнице Сент-Томас (1900) и в 1901-02 работал там же. В 1902-09 помощник бактериолога Лондонской больницы. С 1909 директор Брауновского ветеринарного института и профессор бактериологии Лондонского университета. Основные работы по культивированию микроорганизмов. Первым (1908) применил селективный метод для получения чистой культуры бактерий. Впервые (1912) установил (совместно с Дж. Ингремом) необходимость для роста некоторых микроорганизмов ростового фактора (витамина К). В 1915 описал разрушение гнойного стафилококка перевиваемым фильтрующимся агентом. Тем самым он впервые открыл вирус бактерий, названный Ф. Д'Эреллем в 1917 бактериофагом. 2 Феликс Хьюберт Д’Эрель (1873 Канада – 1949 Париж) – французский и канадский микробиолог. Открыл бактериофаги. Детально описал бактериофагию. Предложил использовать бактериофаги для лечения инфекционных заболеваний. 3 Никола́й Фёдорович Гамалея (5 (17) февраля 1859, Одесса — 29 марта 1949, Москва) — русский и советский врач, микробиолог и эпидемиолог, почётный член АН СССР (с 1940), академик АМН СССР (1945). Лауреат Сталинской премии (1943). 4 Лизис (от греч. λύσις) — растворение, разрушение клеток и их систем, в том числе микроорганизмов, под влиянием различных агентов, например ферментов, бактериолизинов, бактериофагов, антибиотиков. Также, в медицинской практике может обозначать период постепенного и медленного падения температуры при инфекционных заболеваниях; антоним термину кризис. 5 Нуклеи́новые кисло́ты (от лат. nucleus — ядро) — высокомолекулярные органические соединения, биополимеры (полинуклеотиды), образованные остатками нуклеотидов. Нуклеиновые кислоты ДНК и РНК присутствуют в клетках всех живых организмов и выполняют важнейшие функции по хранению, передаче и реализации наследственной информации. 6 M13 - фаг М13. Бактериофаг, геном которого представлен кольцевой одноцепочечной ДНК, специфичен в отношении мужских (F+) клеток E.coli - M13 не лизирует клетку-хозяина, а фаговое потомство постоянно выходит в межклеточную среду; М13-ДНК широко используется в качестве вектора для клонирования, т.к. позволяет выделять клонированные в составе вектора фрагменты ДНК в одноцепочечной форме, что позволяет непосредственно использовать их для секвенирования по методу Сэйнджера. 7 Бактериофаг T4 — один из самых изученных вирусов, бактериофаг, поражающий бактерию E. coli. Имеет геномную ДНК порядка 169—170 тысяч пар нуклеотидов, упакованную в икосаэдрическую головку. Вирион также имеет ствол, основание ствола и стволовые отростки — шесть длинных и шесть коротких. 8 Фаг λ (фаг лямбда) — умеренный бактериофаг, который заражает Escherichia coli. |
