химия. Билет 18 Альдегиды и кетоны. Гомологические ряды. Изомерия. Номенклатура. Физические свойства. Способы получения. Важнейшие представители. Формальдегид, уксусный альдегид, ацетон, их применение. Альдегиды и кетоны
 Скачать 257.92 Kb. Скачать 257.92 Kb.
|
|
Билет 18 1. Альдегиды и кетоны. Гомологические ряды. Изомерия. Номенклатура. Физические свойства. Способы получения. Важнейшие представители. Формальдегид, уксусный альдегид, ацетон, их применение. Альдегиды и кетоны – это производные углеводородов, содержащие функциональную карбонильную группу СО. В альдегидах карбонильная группа связана с атомом водорода и одним радикалом, а в кетонах с двумя радикалами. Общие формулы: 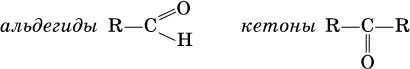 Названия распространенных веществ этих классов приведены в табл. 10. Метаналь – бесцветный газ с резким удушающим запахом, хорошо растворим в воде (традиционное название 40 %‑ного раствора– формалин), ядовит. Последующие члены гомологического ряда альдегидов – жидкости и твердые вещества. Простейший кетон – пропанон‑2, более известный под названием ацетон, при комнатной температуре – бесцветная жидкость с фруктовым запахом, tкип = 56,24 °C. Хорошо смешивается с водой. Химические свойства альдегидов и кетонов обусловлены присутствием в них карбонильной группы СО; они легко вступают в реакции присоединения, окисления и конденсации.  В результате присоединения водорода к альдегидам образуются первичные спирты: 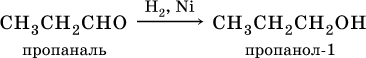 При восстановлении водородом кетонов образуются вторичные спирты: 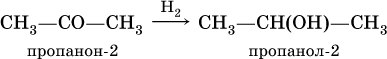 Реакция присоединения гидросульфита натрия используется для выделения и очистки альдегидов, так как продукт реакции малорастворим в воде: 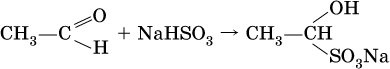 (действием разбавленных кислот такие продукты превращаются в альдегиды). Окисление альдегидов проходит легко под действием кислорода воздуха (продукты – соответствующие карбоновые кислоты). Кетоны сравнительно устойчивы к окислению. Альдегиды способны участвовать в реакциях конденсации. Так, конденсация формальдегида с фенолом протекает в две стадии. Вначале образуется промежуточный продукт, являющийся фенолом и спиртом одновременно: 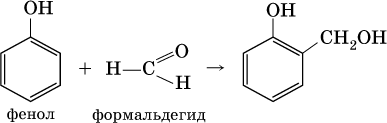 Затем промежуточный продукт реагирует с другой молекулой фенола, и в результате получается продукт поликонденсации – фенолформальдегидная смола: 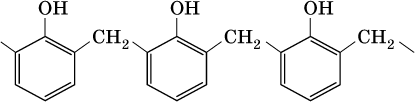 Качественная реакция на альдегидную группу – реакция «серебряного зеркала», т. е. окисление группы С(Н)O с помощью оксида серебра (I) в присутствии гидрата аммиака: 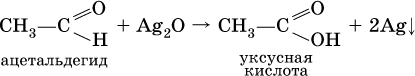 Аналогично протекает реакция с Cu(ОН)2, при нагревании появляется красный осадок оксида меди (I) Cu2O. Получение: общий способ для альдегидов и кетонов – дегидрирование (окисление) спиртов. При дегидрировании первичных спиртов получают альдегиды, а при дегидрировании вторичных спиртов – кетоны. Обычно дегидрирование протекает при нагревании (300 °C) над мелкораздробленной медью: 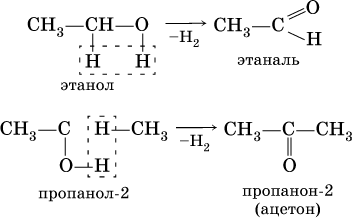 При окислении первичных спиртов сильными окислителями (перманганат калия, дихромат калия в кислотной среде) процесс трудно остановить на стадии получения альдегидов; альдегиды легко окисляются до соответствующих кислот: 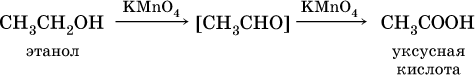 Более подходящим окислителем является оксид меди (II): 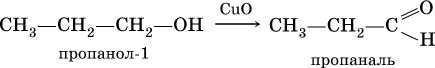 Ацетальдегид в промышленности получают по реакции Кучерова (см. 19.3). Наибольшее применение из альдегидов имеют метаналь и этаналь. Метаналь используют для производства пластмасс (фенопластов), взрывчатых веществ, лаков, красок, лекарств. Этаналь – важнейший полупродукт при синтезе уксусной кислоты и бутадиена (производство синтетического каучука). Простейший кетон – ацетон используют в качестве растворителя различных лаков, ацетатов целлюлозы, в производстве кинофотопленки и взрывчатых веществ. 2. Фенолы одноатомные. Физические свойства. Способы получения. Использование фенолов в промышленности. Фенолформальдегидные смолы. Фенол – гидроксильное производное ароматического углеводорода бензола. С6Н5ОН Физические свойства Фенол – бесцветное, кристаллическое вещество с характерным запахом. Фенол ядовит. Химические свойства Наличие гидроксильной группы предопределяет сходство фенола со спиртами. Влияние бензольного ядра на гидроксильную группу обуславливает большую подвижность её водородного атома. Поэтому фенол обладает слабыми кислотными свойствами. Гидроксильная группа в сою очередь придаёт атома водорода большую подвижность в положении 2,4,6. I. Реакции идущие с участием гидроксильной группы. 1. Взаимодействуют со щелочными металлами с образованием фенолятов. 2С6Н5ОН + 2Na →2С6Н5ОNa + Н2 фенолят натрия. 2. Взаимодействуют со щелочами. С6Н5ОН + NaОН →С6Н5ОNa + Н2О II. Реакции идущие по бензольному кольцу. 1. Реакция бромирования. 2. Реакция нитрования. Получение 1. Фенол выделяют из каменноугольной смолы. 2. Фенол получают из бензола. С6Н6→С6Н5Cl→С6Н5ОН С6Н5Cl+ NaОН → С6Н5ОН + NaCl Применение. Широко применяют для получения фенолформальдегидных пластмасс, лекарственных веществ (тринитрофенол используют для лечения ожогов), красителей, взрывчатых веществ, дезинфицирующих средств. Фенолформальдегидные смолы (ФС) представляют собой класс синтетических полимеров, получаемых в результате реакции фенола (спирт, полученный из бензина) с формальдегидом (полученным из метана). 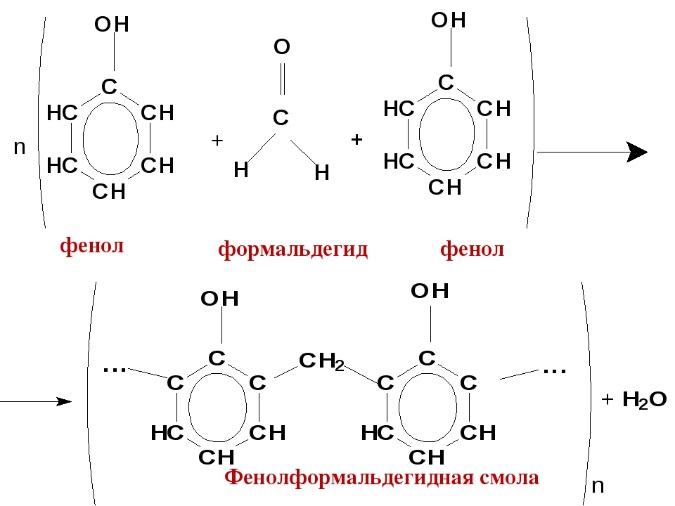 3. Составьте схему таутомерных превращений глюкозы, к какому типу моноз она относится (тетроза, пентоза, гексоза, гептоза и альдоза, кетоза) – верное подчеркнуть. Составьте уравнение реакции, подтверждающее присутствие в глюкозе альдегидной группы. таутомерия 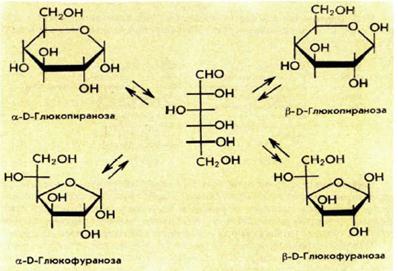 Реакции с участием альдегидной группы глюкозы (свойства глюкозы как альдегида) 1. Восстановление (гидрирование) с образованием многоатомного спирта В ходе этой реакции карбонильная группа восстанавливается и образуется новая спиртовая группа:  Cорбит содержится во многих ягодах и фруктах, особенно много сорбита в плодах рябины. 2. Окисление 1) Окисление бромной водой 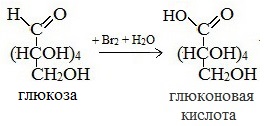 Качественные реакции на глюкозу как альдегид! Протекающие в щелочной среде при нагревании реакции с аммиачным раствором Ag2O (реакция серебряного зеркала») и с гидроксидом меди (II) Cu (OH)2 приводят к образованию смеси продуктов окисления глюкозы. 2) Реакция серебряного зеркала 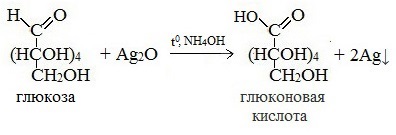 Соль этой кислоты – глюконат кальция – известное лекарственное средство. Видеоопыт «Качественная реакция глюкозы с аммиачным раствором оксида серебра (I)» 3) Окисление гидроксидом меди (II) 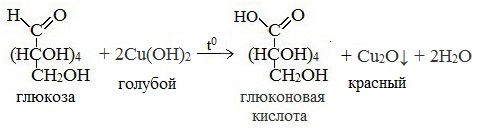 В ходе этих реакций альдегидная группа – СНО окисляется до карбоксильной группы – СООН. |
