Физическая химия - 9 билет. ФХ БИЛЕТ 9. Билет 9 Задание 1
 Скачать 99.19 Kb. Скачать 99.19 Kb.
|
|
Билет 9 Задание 1. Скорость химической реакции. Параметры кинетического уравнения. Порядок реакции по компоненту и общий порядок реакции. Константа скорости. Скорость химической реакции — это изменение количества вещества (исходного или продукта) в единицу времени в единице реакционного пространства (R), рассчитанное на единицу его стехиометрического коэффициента. Знак перед r – либо минус (к исходным реагентам), либо плюс (к продуктам реакции). 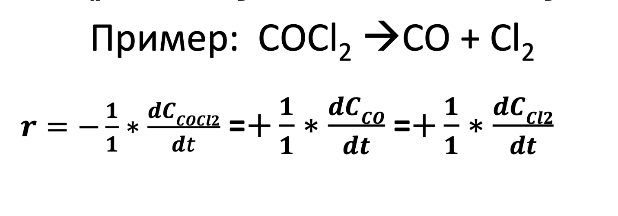 Скорость реакции всегда положительна. Параметры кинетического уравнения – Кинетическое уравнение химических реакций • Кинетическое уравнение это зависимость скорости реакции от концентрации реагентов. • Для простых реакций или элементарных стадий сложных реакций справедлив закон действующих масс (действия масс), установленный Гульдбергом и Вагае 1879 г: ni – порядок реакции по i-му реагенту k – называемый константой скорости реакции, или удельной скоростью реакции при концентрации исходных реагентов равными 1 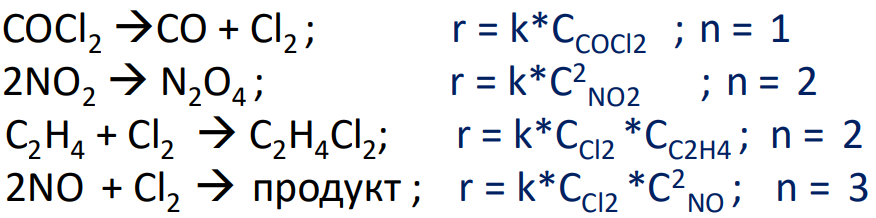 Обратите внимание – в выражение для скорости простой реакции не входят концентрации продуктов реакции. Раствор уксусноэтилового эфира концентрации 0,01 М омыляется раствором едкого натра концентрации 0,03 М в течении 15 мин на 10% при 293 К. Найдите константу скорости реакции, если порядок по каждому компоненту равен 1. Запишите выражение для скорости реакции. Итак, по определению, общий порядок реакции равен сумме порядков реакции по каждому компоненту, у нас общиq порядок равен двум. 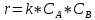 Тогда константа скорости равна – 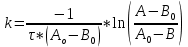 Концентрации равны соответственно – 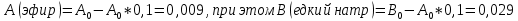 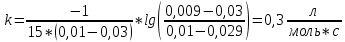 |
