По количеству исходных веществ и продуктов реакции
|
Тип химической реакции
|
Определение
|
Схема
|
Пример
|
Соединения
|
Реакции между несколькими простыми или сложными веществами, при которых образуется одно более сложное вещество.
|
А+В→ АВ
А+ВС→ АВС
|
CaO+H2O→ Ca(OH)2
PbO+SiO2→ PbSiO3
2Na+Cl2→ 2NaCl
|
Разложения
|
Реакции, при которых из одного вещества образуется несколько простых или сложных веществ.
|
АВ→ А+В
АВС → А+ВС
|
Cu(OH)2→ CuO+H2O
CaCO3→ CaO+CO2
|
Замещения
|
Реакции между сложным и простым веществами, при которых атомы простого вещества замещают один из атомов сложного
|
А+ВС→ В+АС
|
CuSO4+Fe→ FeSO4+Cu
2KBr+Cl2→ 2KCl+Br2
|
Обмена
|
Реакции между двумя сложными веществами, при которых они обмениваются своими составными частями
|
АВ+CD→ АD+CВ
|
AgNO3+KBr→ AgBr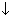 +KNO3 +KNO3
NaOH+HCl→ NaCl+H2O
|
2. По тепловому эффекту
|
Эндотермические реакции
|
реакции, сопровождающиеся поглощением окружающего тепла
|
А+В→ АВ-Q
|
Cu(OH)2=CuO+H2O-Q
|
Экзотермические
|
реакции, сопровождающиеся выделением тепла
|
АВ→ А+В+Q
|
C+O2→ CO2+Q
|
По наличию катализатора
|
Каталитические
|
реакции, при которых используется катализатор
|
А+В кат→ АВ
|
2SО2+O2 V2O5→ 2SО3
N2+H2 Fe → 2NH3
2H202 MnO2→ 2H2O +O2
|
Некаталитические
|
реакции, в которых не используется катализатор
|
А+В → АВ
|
C+O2→ CO2
|
По направлению
|
Необратимые
|
Реакции, которые протекают в одном направлении
|
А+В→ АВ
|
S+O2→ SO2
|
Обратимые
|
Реакции, которые протекают в двух противоположных направлениях
|
А+В <=>АВ
|
N2+H2 <=> 2NH3
|
5.По изменению степеней окисления
|
Окислительно-восстановительные ОВР
|
Реакции, которые идут с изменением степеней окисления
|
А0+В0→ А+1В-1
|
S0+O20→ S+4O2-2
|
Неокислительно-восстановительные НеОВР
|
Реакции, которые идут без изменения степеней окисления
|
А2+В2- +C2++D2-→ А2+D2- + C2+В2-
|
Ca2+Cl2-+Na2+CO32-→ Ca2+CO32-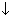 +2 Na+ Cl- +2 Na+ Cl-
|
1.По количеству исходных веществ и продуктов реакции
|
Тип химической реакции
|
Определение
|
Схема
|
Пример
|
Соединения
|
Реакции между несколькими простыми или сложными веществами, при которых образуется одно более сложное вещество.
|
А+В→ АВ
А+ВС→ АВС
|
CaO+H2O→ Ca(OH)2
PbO+SiO2→ PbSiO3
2Na+Cl2→ 2NaCl
|
Разложения
|
Реакции, при которых из одного вещества образуется несколько простых или сложных веществ.
|
АВ→ А+В
АВС → А+ВС
|
Cu(OH)2→ CuO+H2O
CaCO3→ CaO+CO2
|
Замещения
|
Реакции между сложным и простым веществами, при которых атомы простого вещества замещают один из атомов сложного
|
А+ВС→ В+АС
|
CuSO4+Fe→ FeSO4+Cu
2KBr+Cl2→ 2KCl+Br2
|
Обмена
|
Реакции между двумя сложными веществами, при которых они обмениваются своими составными частями
|
АВ+CD→ АD+CВ
|
AgNO3+KBr→ AgBr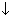 +KNO3 +KNO3
NaOH+HCl→ NaCl+H2O
|
2. По тепловому эффекту
|
Эндотермические реакции
|
реакции, сопровождающиеся поглощением окружающего тепла
|
А+В→ АВ-Q
|
Cu(OH)2=CuO+H2O-Q
|
Экзотермические
|
реакции, сопровождающиеся выделением тепла
|
АВ→ А+В+Q
|
C+O2→ CO2+Q
|
3.По наличию катализатора
|
Каталитические
|
реакции, при которых используется катализатор
|
А+В кат→ АВ
|
2SО2+O2 V2O5→ 2SО3
N2+H2 Fe → 2NH3
2H202 MnO2→ 2H2O +O2
|
Некаталитические
|
реакции, в которых не используется катализатор
|
А+В → АВ
|
C+O2→ CO2
|
4.По направлению
|
Необратимые
|
Реакции, которые протекают в одном направлении
|
А+В→ АВ
|
S+O2→ SO2
|
Обратимые
|
Реакции, которые протекают в двух противоположных направлениях
|
А+В <=>АВ
|
N2+H2 <=> 2NH3
|
5.По изменению степеней окисления
|
Окислительно-восстановительные ОВР
|
Реакции, которые идут с изменением степеней окисления
|
А0+В0→ А+1В-1
|
S0+O20→ S+4O2-2
|
Неокислительно-восстановительные НеОВР
|
Реакции, которые идут без изменения степеней окисления
|
А2+В2- +C2++D2-→ А2+D2- + C2+В2-
|
Ca2+Cl2-+Na2+CO32-→ Ca2+CO32-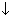 +2 Na+ Cl- +2 Na+ Cl-
|
 Скачать 34.56 Kb.
Скачать 34.56 Kb.