БИОХИМИЯ ОПУХОЛЕВОГО ПРОЦЕССА. Биохимия опухолевого процесса. Молекулярные основы онкопатологии
 Скачать 98.67 Kb. Скачать 98.67 Kb.
|
|
ФГАОУ ВО Северо-восточный федеральный университет им. М.К.Аммосова Медицинский институт Кафедра биохимии и биотехнологий Реферат на тему: Биохимия опухолевого процесса. Молекулярные основы онкопатологии. Выполнила студентка 1 курса Группы СТО-101/1-17 Гоголева Валентина Тимофеевна Проверила: Соловьева М.И Якутск, 2018г. Содержание
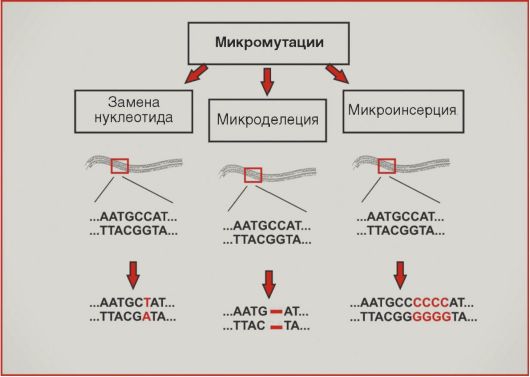
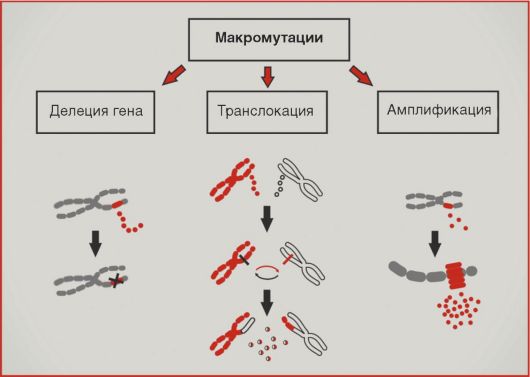
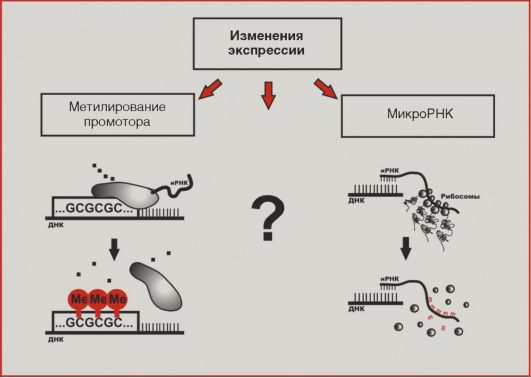
Введение Опухолевый процесс – типический патологический процесс, характеризующийся нерегулируемой гиперплазией клеток, нарушением их дифференцировки, автономностью роста, морфологическим, биохимическим и функциональным атипизмом. Атипизм опухолевой клетки можно определить как «возврат к прошлому», становление на эволюционно более древние, более простые и устойчивые пути жизнеобеспечения: уменьшение поверхности и упрощение строения клеточных мембран, уменьшение количества рецепторов, нексусов, утрата свойства контактного торможения, редукция митохондрий, преобладание гликолиза над аэробным окислением, повышение способности активно поглощать субстраты и т. д. Основа опухолевого роста – это нарушение равновесия между пролиферацией и дифференцировкой клеток. Вероятность опухолевой трансформации наиболее велика для клеток активно пролиферирующих тканей. Процесс превращения нормальной клетки в опухолевую обусловлен действием физических факторов (иони зирующее излучение), химических канцерогенов, вирусов на клеточный геном. Следствием этого является экспрессия онкогенов (структурных генов) и синтез онкобелков, реализующих программу малигнизации (озлокачествления клеток). Выделяют две фазы канцерогенеза: 1-я фаза – инициация, характеризуется экспрессией определенных онкогенов (чаще всего оnс-myc и onc-myb). Онкобелки – продукты этих онкогенов, являются митогенами, стимулирующими клеточную пролиферацию; 2-я фаза – трансформация, характеризуется экспрессией другой группы онкобелков (onc-ras, onc-sis и др.). Онкобелки этих онкогенов способствуют окончательной трансформации инициированной клетки в опухолевую – бесконтрольное деление и утрата дифференцировки. По способности к распространению в организме их делят на: - доброкачественные (не обладающие способностью прорастать в соседние ткани); - злокачественные, способные к разрастанию (инвазии) в определенных тканях и перемещению в другие части тела, давая начало вторичным опухолям (метастазам). Опухоли классифицируют также в зависимости от тканей и типов клеток, из которых они возникли: Карциномы – опухоли из клеток эктодермы и эндодермы; Саркомы – из клеток мезодермы; Гемобластозы (лейкозы и лимфомы) – из камбиальной клетки кроветворной и лимфатической ткани. Биохимия опухолей Для опухолей характерно высокое содержание влаги, богатство нуклеиновыми кислотами, растворимыми белками и т. п. Эти признаки, однако, не специфичны для опухолевого роста, и при сопоставлении с исходной нормальной тканью химические отличия опухолей разного гистогенеза не всегда однородны. Тем не менее при сопоставлении морфологически различных опухолей между собой выявляется значительная биохимическая общность между ними. Эта общность проявляется в относительной однородности ферментативного набора и активности ферментов, в сравнительном сходстве в аминокислотном составе тотального белка, а также в содержании, составе и биохимической активности ряда других химических компонентов. Как правило, в опухолях понижено содержание тех ферментов, которые характерны для специализированных функций исходной ткани, и усилены процессы, связанные с недифференцированным ростом и биосинтезом белков. В этом выражается своего рода химическая анаплазия (или дедифференцировка). Наряду с этим опухоль в той или иной степени сохраняет биохимические черты исходной ткани, причем чем более опухоль дифференцирована, чем она менее злокачественна, тем в большей степени она сохраняет эти черты. Для опухолевой ткани весьма характерны пониженное окисление и повышенный гликолиз. Особенно существенно, что, в отличие от большинства нормальных тканей, гликолиз в опухоли продолжается в присутствии кислорода воздуха, т. е. имеет место аэробный гликолиз. Несмотря на то, что эта особенность характерна для опухолей, ее все же нельзя считать специфической. Низкое окисление может быть связано с относительной бедностью опухолевых клеток митохондриями и нестабильностью последних. Характеризуясь усиленным и недифференцированным ростом, опухолевые клетки обладают способностью к повышенному биосинтезу белков и нуклеиновых кислот. Эта способность резко выражена при инкубации клеток и тканей вне организма, тогда как в самом организме биосинтез макромолекул в опухолевых клетках того же порядка, что и в нормальных. Одним из механизмов, имеющих большое значение для этой особенности, является высокая способность опухолевых клеток к активному концентрированию аминокислот и Сахаров из окружающей среды. Вследствие этого концентрация глюкозы в асцитной жидкости, окружающей клетки асцитной опухоли, падает до очень низкого уровня, недостаточного для поддержания жизни нормальных клеток; тем не менее раковые клетки продолжают активно расти. В опухолях выявлены также нарушения регуляторных механизмов обмена веществ. Так, в отличие от нормальных исходных тканей, опухоли не способны или почти не способны к индуцированному синтезу ферментов в ответ на появление субстрата или другого индуктора. Это явление может быть поставлено в связь с автономностью опухолевого роста. В этой связи следует рассматривать и нарушения в ядерном аппарате опухолевой клетки, а именно—измененные соотношения белков и нуклеиновых кислот в ядре, накопление белков кислого характера, в особенности инертных и, по-видимому, балластных белков, и повышенное содержание в клеточном ядре РНК. Нарушение регуляции гликолиза находится в связи с повреждением митохондрий, неспособностью их к активному сокращению и изменению проницаемости. Таким образом, патогенез опухолевого роста связан с нарушениями в аппарате биосинтеза белков, в специфичности и регуляции этого процесса. Большинство исследователей считает, что нарушения эти носят эпигенетический характер, т. е. не затрагивают структуры молекул ДНК, а скорее обязаны изменениям в белках или других веществах в ядре, выполняющих регуляторную функцию. Особенность биохимии опухолевых клеток Одной из отличительных особенностей биохимии опухолевых клеток является более низкая, чем в нормальной ткани, активность окислительных ферментов. Окислительно-восстановительный потенциал в опухоли снижен. Опухолевая клетка содержит полный набор ферментов цикла Кребса и сбалансированную систему переноса электронов, способную обеспечить достаточно высокую интенсивность окислительных процессов. Уровень дыхания опухолевых клеток всегда ниже, чем в большинстве нормальных тканей. Три основные причины низкой дыхательной активности опухолевой ткани. Первая из них обусловлена сильным развитием ядерного аппарата опухолевой клетки с уменьшенным количеством митохондрий и лабильностью структуры последних. В митохондриях опухолевой клетки отмечается низкое содержание НАД, в результате чего ограничивается скорость окислительных процессов на стадии переноса электронов с НАД-Н2 на флавопротеины. Таким образом, речь идет об ущербности системы дыхательных ферментов опухолевой клетки. Другой причиной низкого уровня дыхания в опухолевой клетке является конкуренция из-за недостающих пиридиннуклеотидов между митохондриальной системой дыхания и мощной системой гликолиза, локализованной в растворимой части протоплазмы. Третья причина — нарушение или извращение таких мощных регуляторов скорости гликолиза и дыхания, какими являются процессы сопряженного с ними фосфорилирования. Опухолевые клетки в организме испытывают одновременно относительное кислородное и глюкозное голодание. При этом регуляторные механизмы энергетики опухолевых клеток оказываются резко перестроенными. Если в нормальных клетках величина пастеровского эффекта достигает нередко 90 — 100%, то в опухолевых она не превышает 20%. С другой стороны, угнетение дыхания гликолизом, т. е. обратный пастеровский эффект, или Крэбтри-эффект, достигает 50 — 60% . Опухолевые клетки более чувствительны к высокой температуре, чем нормальные. Различные опухоли по-разному чувствительны к повышенной температуре. Это связано, вероятнее всего, с особенностями их структуры, морфологических, метаболических, антигенных и других свойств, а также с фазой митотического цикла в момент воздействия тепла и особенностями питания опухолевой ткани и т. д. Различия эффекта теплового воздействия на нормальные и опухолевые клетки определяются степенью повышения температуры и продолжительностью ее экспозиции.
|