Биотехнологии биология. Биотехнологии
 Скачать 0.79 Mb. Скачать 0.79 Mb.
|
|
Министерство образования и науки РФ Доклад по биологии на тему «Биотехнологии» Выполнила студентка 2 курса, ФЕНМиПО, направление подготовки география, группа 0212-02 Гнездилова Мария Александровна Псков 2017 Содержание: 1. Определения биотехнологии. Общие сведения. 2. История биотехнологии. 2.1. Объекты биотехнологии. 3. Направления в биотехнологии. 4. Основные цели и задачи биотехнологии. 5. Направления и виды биотехнологий. 5.1. Генная инженерия. 5.2. Клеточная инженерия. 5.3. Эмбриогенез 5.4. Применение биотехнологий для очистки окружающей среды. 5.5. Промышленная биотехнология и её разновидности. 6. Биотехнологии сегодня. Последние изобретения учёных. 7. Вывод. 8. Список литературы. Биотехнологии. 1. Биотехнология — дисциплина, изучающая возможности использования живых организмов, их систем или продуктов их жизнедеятельности для решения технологических задач, а также возможности создания живых организмов с необходимыми свойствами методом генной инженерии. Также есть и другое определение: биотехнология — это сознательное производство необходимых человеку продуктов и материалов с помощью живых организмов и биологических процессов. Это важный раздел современной биологии. Она стала, как и физика, одним из основных приоритетов в мировой экономике и науке в конце 20 века. Еще полвека назад никто не знал, что такое биотехнология. Однако основы её заложил ученый, живший ещё в 19 веке. Биотехнология получила мощный толчок к развитию благодаря работам исследователя из Франции Луи Пастера (1822-1895 г.г.). Он является основоположником современной иммунологии и микробиологии. В 20 веке бурно развивалась генетика и молекулярная биология с использованием достижений физики и химии. В это время важнейшим направлением была разработка методов, с помощью которых можно было бы культивировать клетки животных и растений. Биотехнологией часто называют применение генной инженерии в XX—XXI веках, но термин относится и к более широкому комплексу процессов модификации биологических организмов для обеспечения потребностей человека, начиная с модификации растений и животных путём искусственного отбора и гибридизации. С помощью современных методов традиционные биотехнологические производства получили возможность улучшить качество пищевых продуктов и увеличить продуктивность живых организмов. До 1971 года термин «биотехнология» использовался, большей частью, в пищевой промышленности и сельском хозяйстве. С 1970 года учёные используют термин в применении к лабораторным методам. Биотехнология основана на генетике, молекулярной биологии, биохимии, эмбриологии и клеточной биологии, а также прикладных дисциплинах — химической и информационной технологиях и робототехнике. 2. Впервые термин «биотехнология» применил венгерский инженер Карл Эреки (рис. 1) в 1917 году. Использование в промышленном производстве микроорганизмов или их ферментов, обеспечивающих технологический процесс, известно издревле, однако систематизированные научные исследования позволили существенно расширить арсенал методов и средств биотехнологии. Так, в 1814 году петербургский академик К. С. Кирхгоф открыл явление биологического катализа и пытался биокаталитическим путём получить сахар из доступного отечественного сырья (до середины XIX века сахар получали только из сахарного тростника). В 1891 году в США японский биохимик Дз. Такамине получил первый патент на использование ферментных препаратов в промышленных целях: учёный предложил применить диастазу для осахаривания растительных отходов. В начале XX века активно развивалась бродильная и микробиологическая промышленность. В эти же годы были предприняты первые попытки наладить производство антибиотиков, пищевых концентратов, полученных из дрожжей, осуществить контроль ферментации продуктов растительного и животного происхождения. Первый антибиотик — пенициллин — удалось выделить и очистить до приемлемого уровня в 1940 году, что дало новые задачи: поиск и налаживание промышленного производства лекарственных веществ, продуцируемых микроорганизмами, работа над удешевлением и повышением уровня биобезопасности новых лекарственных препаратов. С незапамятных времен биотехнология применялась преимущественно в пищевой и легкой промышленности: в виноделии, хлебопечении, сбраживании молочных продуктов, при обработке льна и кож, основанных на применении микроорганизмов. В последние десятилетия возможности биотехнологии необычайно расширились. Это связано с тем, что ее методы выгоднее обычных по той простой причине, что в живых организмах биохимические реакции, катализируемые ферментами, идут при оптимальных условиях (температуре и давлении), более производительны, экологически чисты и не требуют химических реактивов, отравляющих среду.  Рис. 1. Константин Сигизмундович Кирхгоф. 2.1. Объектами биотехнологии являются многочисленные представители групп живых организмов — микроорганизмы (вирусы, бактерии, простейшие, дрожжевые грибы), растения, животные, а также изолированные из них клетки и субклеточные компоненты (органеллы) и даже ферменты. Биотехнология базируется на протекающих в живых системах физиолого-биохимических процессах, в результате которых осуществляются выделение энергии, синтез и расщепление продуктов метаболизма, формирование химических и структурных компонентов клетки. 3. Главным направлением биотехнологии является производство с помощью микроорганизмов и культивируемых эукариотических клеток биологически активных соединений (ферменты, витамины, гормоны), лекарственных препаратов (антибиотики, вакцины, сыворотки, высокоспецифичные антитела и др.), а также ценных соединений (кормовые добавки, например, незаменимые аминокислоты, кормовые белки и т. д.). Методы генетической инженерии позволили осуществить синтез в промышленных количествах таких гормонов, как инсулин (рис. 2) и соматотропин (гормон роста), которые необходимы для лечения генетических болезней человека. Одним из важнейших направлений современной биотехнологии является также использование биологических методов борьбы с загрязнением окружающей среды (биологическая очистка сточных вод, загрязненной почвы и т. п.). Так, для извлечения металлов из сточных вод могут широко использоваться штаммы бактерий, способные накапливать уран, медь, кобальт. Другие бактерии родов Rhodococcus и Nocardia с успехом применяют для эмульгирования и сорбции углеводородов нефти из водной среды. Они способны разделять водную и нефтяную фазы, концентрировать нефть, очищать сточные воды от примесей нефти. Ассимилируя углеводороды нефти, такие микроорганизмы преобразуют их в белки, витамины из группы В и каротины. Некоторые из штаммов галобактерий с успехом применяют для удаления мазута с песчаных пляжей. Получены также генно-инженерные штаммы, способные расщеплять октан, камфару, нафталин, ксилол, эффективно утилизировать сырую нефть. Большое значение имеет использование методов биотехнологии для защиты растений от вредителей и болезней. Биотехнология проникает в тяжелую промышленность, где микроорганизмы используются для добычи, превращения и переработки природных ископаемых. Уже в древности первые металлурги получали железо из болотных руд, производимых железобактериями, которые способны концентрировать железо. Теперь разработаны способы бактериальной концентрации ряда других ценных металлов: марганца, цинка, меди, хрома и др. Эти методы используются для разработки отвалов старых рудников и бедных месторождений, где традиционные методы добычи экономически невыгодны. Биотехнология решает не только конкретные задачи науки и производства. У нее есть более глобальная методологическая задача — она расширяет и ускоряет масштабы воздействия человека на живую природу и способствует адаптации живых систем к условиям существования человека, т. е. к ноосфере. Биотехнология, таким образом, выступает в роли мощного фактора антропогенной адаптивной эволюции. У биотехнологии, генетической и клеточной инженерии многообещающие перспективы. При появлении все новых и новых векторов человек с их помощью будет внедрять нужные гены в клетки растений, животных и человека. Это позволит постепенно избавиться от многих наследственных болезней человека, заставить клетки синтезировать необходимые лекарства и биологически активные соединения, а затем — непосредственно белки и незаменимые аминокислоты, употребляемые в пищу. Используя методы, уже освоенные природой, биотехнологи надеются получать с помощью фотосинтеза водород — самое экологически чистое топливо будущего, электроэнергию, превращать в аммиак атмосферный азот при обычных условиях. 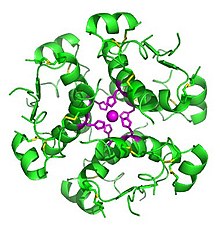 Рис. 2. Компьютерное изображение инсулина. Рис. 2. Компьютерное изображение инсулина.4. Человечеству необходимо научиться эффективно изменять наследственную природу живых организмов, чтобы обеспечить себя доброкачественной пищей и сырьем и при этом не привести планету к экологической катастрофе. Поэтому не случайно главной задачей селекционеров в наше время стало решение проблемы создания новых форм растений, животных и микроорганизмов, хорошо приспособленных к индустриальным способам производства, устойчиво переносящих неблагоприятные условия, эффективно использующих солнечную энергию и, что особенно важно, позволяющих получать биологически чистую продукцию без чрезмерного загрязнения окружающей среды. Принципиально новыми подходами к решению этой фундаментальной проблемы является использование в селекции генной и клеточной инженерии. Основные задачи и цели биотехнологий: 1. Активация и поддержание путей обмена клеток, ведущих к накоплению заданных продуктов при доминировании над другими реакциями обмена у культивируемого организма. 2. Получение клеток или их составных частей (преимущественно ферментов) для направленного изменения сложных молекул (например, рестриктазы, изомеразы, пенициллинамидазы). 3. Углубление и совершенствование форм рДНК для биотехнологии и клеточной инженерии с целью получения особо ценных результатов в фундаментальных и прикладных разработках. 4. Создание безотходных и экологически безопасных биотехнологических процессов. 5. Совершенствование и оптимизация аппаратурного оформления биотехнологических процессов с целью достижения максимального выхода конечных продуктов при культивировании естественных видов с измененной наследственностью методами клеточной и генной инженерии. 6. Повышение технико-экономических показателей биотехнологических процессов по сравнению с существующими. Также в задачи биотехнологии входит создание и широкое освоение: 1. новых биологически активных веществ (БАВ) и лекарственных препаратов для медицины (интерферона, инсулина, гормонов, моноклональных антител), позволяющих осуществить раннюю диагностику и лечение тяжелых заболеваний; 2. микробиологических средств защиты растений от болезней и вредителей, бактериальных удобрений и регуляторов роста культур; 3. новых высокопродуктивных и устойчивых к неблагоприятным факторам внешней среды сортов и гибридов; 4. ценных кормовых добавок и БАВ для повышения продуктивности животноводства; 5. новых методов биоинженерии для эффективной профилактики, диагностики и терапии основных болезней сельскохозяйственных животных; 6. новых технологий получения хозяйственно-ценных продуктов для использования в пищевой, химической, микробиологической и др. отраслях промышленности; 7. технологий глубокой и эффективной переработки сельскохозяйственных, бытовых и промышленных отходов, использования сточных вод для производства биогаза и высококачественных удобрений. Эти задачи определяют перспективы развития биотехнологии. 5. Как уже отмечалось выше, биотехнология возникла на стыке многих наук. Для данной науки свойственна трансдисциплинарность. Фундамент биотехнологии составили такие науки, как микробиология, вирусология, физиология, биохимия, генетика, селекция, цитология, молекулярная биология, генетическая инженерия, клеточная инженерия, энзимология, иммунология, биофизика, экология, медицина, сельскохозяйственные науки, химия, физика, математика, кибернетика и др. Можно выделить, по крайней мере, четыре направления, определивших развитие биотехнологии. Прежде всего, это наиболее «старая» область - микробиология. Микробиология – наука о микроорганизмах. Микроорганизмы – это мельчайшие организмы, различимые только под микроскопом. Основные преимущества промышленного культивирования микроорганизмов: простота их организации, высокая скорость роста и размножения, большое разнообразие физиологических и биохимических свойств, способность развиваться в условиях непригодных для жизни других организмов, способность разлагать сложные органические соединения (белки, углеводы, в том числе целлюлозу и т.п.), вещества, токсичные для человека и животных (например, метанол, сероводород и т.п.), ксенобиотики (вещества неприродного происхождения). На настоящем этапе именно микробиологические процессы в наибольшей степени развиты до уровня промышленного использования. Это, прежде всего, крупнотоннажное производство микробной биомассы, антибиотиков и других лекарственных веществ, аминокислот. Второе направление биотехнологии – инженерная энзимология. Инженерная энзимология – это отрасль биотехнологии, базирующаяся на использовании каталитических функций ферментов (или ферментных систем) в изолированном состоянии или в составе живых клеток для получения соответствующих целевых продуктов. Биообъект (в данном случае) – фермент (или комплекс ферментов). На практике обычно используются иммобилизованные ферменты (иммобилизованные клетки), благодаря чему стабилизируется и пролонгируется их ферментативная активность. Иногда инженерную энзимологию отождествляют с биотехнологией. В этом содержится большая доля истины, так как все реакции в клетках катализируются ферментами. Однако термин «инженерная» привносит свою специфику , заключающуюся в акценте на создание конструкции, в данном случае – на конструирование биокатализаторов с заданными свойствами с последующим их использованием в биотехнологическом процессе. Два других направления биотехнологии – генная инженерия и клеточная инженерия – самые молодые, но очень перспективные области биотехнологии. Первое состоит в искусственном конструировании молекул ДНК, несущих всю генетическую информацию о данном организме, т.е. заключающих в себе всю программу его роста и развития. Таким образом, можно направленно влиять на наследственность и получать новые виды с необходимыми свойствами. Генетическая инженерия – один из важнейших методов биотехнологии, предполагающий целенаправленное искусственное создание определенных комбинаций генетического материала, способных нормально функционировать в клетке, т.е. размножаться и контролировать синтез конечных продуктов. Таким образом, генетическая инженерия включает выделение из клеток отдельных генов или синтез генов вне клеток, направленную перестройку, копирование и размножение выделенных или синтезированных генов, а также их перенос и включение в подлежащий изменению геном и таким путем можно добиться включения в клетки бактерий «чужых» генов и синтеза бактериями важных для человека соединений. Развитие генетической инженерии стало возможным благодаря открытию двух ферментов: рестриктаз, разрезающих молекулу ДНК в строго определенных участках и лигаз, сшивающих определенные участки различных молекул ДНК друг с другом. Кроме того, в основе генетической инженерии лежит открытие векторов, которые представляют собой короткие, самостоятельно размножающиеся в клетках бактерий кольцевые молекулы ДНК. С помощью рестриктаз и лигаз в векторы встраивают необходимый ген, добиваясь в последствии его включения в геном клетки-хозяина. 5.1. Появившись в начале 1970 годов, генная инженерия сегодня добилась значительных успехов. Ее методы преобразуют клетки млекопитающих, дрожжей, бактерий в настоящие "фабрики" для производства любого белка. Такое достижение науки предоставляет возможность детально изучить функции и структуру белков для того, чтобы использовать их как лекарственные средства. Генная (генетическая) инженерия (рис. 3) — раздел молекулярной генетику связанный с целенаправленным созданием новых молекул ДНК, способных размножаться в клетке-хозяине и осуществлять контроль за синтезом необходимых метаболитов клетки. Возникнув на стыке химии нуклеиновых кислот и генетики микроорганизмов, генная инженерия занимается расшифровкой структуры генов, их синтезом и клонированием, вставкой выделенных из клеток живых организмов или вновь синтезированных генов в клетки растений и животных с целью направленного изменения их наследственных свойств. Для осуществления переноса генов (или трансгенеза) от одного вида организмов в другой, часто очень далекий по своему происхождению, необходимо выполнить несколько сложных операций: 1. выделение генов (отдельных фрагментов ДНК) из клеток бак-терий, растений или животных. В отдельных случаях эту операцию заменяют искусственным синтезом нужных генов; 2. соединение (сшивание) отдельных фрагментов ДНК любого происхождения в единую молекулу в составе плазмиды; 3. введение гибридной плазмидной ДНК, содержащей нужный ген, в клетки хозяина; 4. копирование (клонирование) этого гена в новом хозяине с обеспечением его работы. Клонированные гены путем микроинъекции вводят в яйцеклетку млекопитающих или протопласты растений (изолированные клетки, лишенные клеточной стенки) и из них выращивают целых животных или растения, в геном которых встроены (интегрированы) клонированные гены. Растения и животные, геном которых изменен путем генноинженерных операций, получили название трансгенных растений или трансгенных животных. Уже получены трансгенные мыши, кролики, свиньи, овцы, в геноме которых работают чужеродные гены различного происхождения, в том числе гены бактерий, дрожжей, млекопитающих, человека, а также трансгенные растения с генами других, неродственных видов. Трансгенные организмы свидетельствуют о больших возможностях генной инженерии как прикладной ветви молекулярной генетики. Например, в последние годы получено новое поколение трансгенных растений, для которых характерны такие ценные признаки, как устойчивость к гербицидам, к насекомым и др. Трансгенные растения в 1999 г. занимали в мире площадь, равную 48,2 млн. га. Есть все основания предполагать, что уже в ближайшем будущем будет решена проблема направленного изменения наследственности высших растений, что приведет к революции в сельском хозяйстве. В первую очередь речь идет о создании симбиоза между злаками и азотфиксирующими клубеньковыми бактериями, а это решит проблему азотных удобрений. Имеются уже доказательства того, что свободноживущие азотфиксирующие бактерии способны ассоциировать с корнями злаков, давая возможность растению-хозяину получать некоторое количество азота в результате бактериальной азотфиксации. Теперь генетически нужно добиться, чтобы азотфиксирующие бактерии более эффективно присоединялись к корням злаков, что способствовало бы их более полезной и успешной ассоциации (симбиозу). Разрабатывается метод переноса в определенные растения более эффективных ферментных систем метаболического пути фиксации атмосферного углерода (темновой фазы фотосинтеза), что позволит повысить скорость фиксации углекислого газа и, как следствие, продуктивность фотосинтеза культурных растений. Самым важным шагом к победе не только над генетическими болезнями, но и над старостью будет разработка методов геноте-рапии, безопасных для клетки. Тогда у врачей появится возможность заменять в организме пожилых людей поврежденные в результате мутаций гены на нормальные.  Рис. 3. Рис. 3.5.2. В основе клеточной инженерии (рис.4.) лежит использование методов культивирования изолированных клеток и тканей на искусственной питательной среде в регулируемых условиях. Это стало возможным благодаря способности растительных клеток в результате регенерации формировать целое растение из единичной клетки. Условия регенерации разработаны для многих культурных растений — картофеля, пшеницы, ячменя, кукурузы, томатов и др. Работа с этими объектами делает возможным использование в селекции нетрадиционных методов клеточной инженерии — соматической гибридизации, гаплоидии, клеточной селекции, преодоления нескрещиваемости в культуре и др. Соматическая гибридизация — это слияние двух различных клеток в культуре тканей. Сливаться могут разные виды клеток одного организма и клетки разных, иногда очень далеких видов, например мыши и крысы, кошки и собаки, человека и мыши, Культивирование клеток растений стало возможным, когда научились с помощью ферментов избавляться от толстой клеточной стенки и получать изолированный протопласт, который можно культивировать так же, как и клетки животных. Кроме того, можно заставить слиться с протопластом других видов растений и получить в соответствующих условиях новые гибриды. Протопласт является также идеальным реципиентом для чужеродной ДНК, что дает возможность образования генетически модифицированных растений. Из протопластов многих растений в подходящих условиях формируются полноценные организмы, которые можно пересадить в землю и далее размножать обычным способом. Таким путем получают гибриды между растениями, которые иначе не скрещиваются, освобождаются от вирусов или, наоборот, вводят в растения иные гены. У растений-регенерантов выявлен широкий спектр мутаций как по качественным, так и по количественным признакам. Для проведения направленной селекции мутантов в культуре создается селективный фон, позволяюеций отобрать клетки с нужными качествами. Именно этот тип клеточной селекции обеспечивает возможность повышения приспособленности генотипов, т. е. в культуре возможна селекция на устойчивость к патогенам, гербицидам, засолению почв, высокой или низкой их кислотности, засухе и т, п. Общий принцип отбора растительных клеток в культуре на питательной среде заключается в том, что признак растения, по которому ведется отбор, как правило, должен проявляться на клеточном уровне. Например, если в культуру растительных клеток добавить токсичные аналоги аминокислот, то будут размножаться только те мутанты, у которых собственный синтез этих аминокислот выше обычного. Так удалось получить клетки, а из них растения моркови, синтезирующие в 20 раз больше метионина, в 30 раз — триптофана, в 5 раз — лизина. Проведение такой селекции на целых растениях потребовало бы огромной работы в течение многих десятков лет.  Рис.4. Рис.4.5.3. Очень важное направление клеточной инженерии связано с ранними стадиями эмбриогенеза. Например, оплодотворение яйцеклеток в пробирке уже сейчас позволяет преодолевать некоторые распространенные формы бесплодия у человека. У сельскохозяйственных животных с помощью инъекции гормонов удается получить от одной коровы-рекордистки десятки яйцеклеток, оплодотворить их в пробирке спермой породистого быка, а затем имплантировать в матку других коров; в результате один ценный экземпляр дает в 10 раз больше потомства, чем это было возможно обычным путем. Культуру растительных клеток выгодно использовать для быстрого размножения медленно растущих растений — женьшеня, маслинной пальмы, малины, персиков и др. Так, при обычном разведении куст малины дает не более 50 отростков в год, а с помощью культуры клеток можно получить более 50 тыс. растений. При таком разведении иногда вырастают растения более продуктивные, чем исходный сорт. Так были выведены новые ценные сорта картофеля, грейпфрута и т. д. 5.4. Уже многие годы для решения проблемы загрязнения окружающей среды используются биологические методы, разработанные биотехнологами. Так, бактерии родов Rhodococcus и Nocardia с успехом применяют для эмульгирования и сорбции углеводородов нефти из водной среды. Они способны разделять водную и нефтяную фазы, концентрировать нефть, очищать сточные воды от примесей нефти. Ассимилируя углеводороды нефти, такие микроорганизмы преобразуют их в белки, витамины группы В и каротины. Если в питательную среду из нефтяных фракций добавить азотистые вещества с минеральными солями, то процесс образования белков пойдет необычайно интенсивно. Практически с каждой тонны углеводородов таким путем можно получить до тонны белков. Это означает, что менее одного процента обрабатываемой теперь сырой нефти хватило бы для возмещения недостатка в белках на всей планете. Некоторые из штаммов галобактерий с успехом применяют для удаления мазута с песчаных пляжей. Получены также генно-инженерные штаммы, способные расщеплять октан, камфору, нафталин, ксилол, эффективно утилизировать сырую нефть. Для извлечения металлов из сточных вод могут широко использоваться штаммы Citrobacter, Zoogloea, способные накапливать уран, медь, кобальт. Получены высокоэффективные штаммы Pseudomonas и термофильной бактерии Sulfolobus для удаления серы из угля; это одна из сложнейших экологических проблем; так как при сжигании угля происходит сильное загрязнение окружающей среды серой. 5.4. В промышленной биотехнологии можно выделить как разновидность красную биотехнологию (медицину). Она считается самой важной сферой применения биотехнологий. Все большую роль они играют при разработке медикаментов (в частности, для лечения рака). Большое значение биотехнологии имеют также в диагностике. Они применяются, например, при создании биосенсоров, чипов ДНК. В Австрии красная биотехнология сегодня пользуется заслуженным признанием. Она даже считается двигателем развития остальных отраслей. Переходим к следующей разновидности промышленной биотехнологии. Это биотехнология зеленая. Она используется, когда осуществляется селекция. Биотехнология эта предоставляет сегодня особые методы, с помощью которых разрабатываются средства противодействия против гербицидов, вирусов, грибков, насекомых. Все это также очень важно, согласитесь. Биоинженерия или биомедицинская инженерия — это дисциплина, направленная на углубление знаний в области инженерии, биологии и медицины и укрепление здоровья человечества за счёт междисциплинарных разработок, которые объединяют в себе инженерные подходы с достижениями биомедицинской науки и клинической практики. Биоинженерия/биомедицинская инженерия — это применение технических подходов для решения медицинских проблем в целях улучшения охраны здоровья. Эта инженерная дисциплина направлена на использование знаний и опыта для нахождения и решения проблем биологии и медицины. Биоинженеры работают на благо человечества, имеют дело с живыми системами и применяют передовые технологии для решения медицинских проблем. Специалисты по биомедицинской инженерии могут участвовать в создании приборов и оборудования, в разработке новых процедур на основе междисциплинарных знаний, в исследованиях, направленных на получение новой информации для решения новых задач. Среди важных достижений биоинженерии можно упомянуть разработку искусственных суставов, магниторезонансной томографии, кардиостимуляторов, артроскопии, ангиопластики, биоинженерных протезов кожи, почечного диализа, аппаратов искусственного кровообращения. Также одним из основных направлений биоинженерных исследований является применение методов компьютерного моделирования для создания белков с новыми свойствами, а также моделирования взаимодействия различных соединений с клеточными рецепторами в целях разработки новых фармацевтических препаратов. Следующая разновидность промышленной биотехнологии - биотехнология зеленая. Она используется, когда осуществляется селекция. Биотехнология эта предоставляет сегодня особые методы, с помощью которых разрабатываются средства противодействия против гербицидов, вирусов, грибков, насекомых. Все это также очень важно. Для области зеленой биотехнологии особое значение имеет генная инженерия. С помощью нее создаются предпосылки для переноса генов одного вида растений на другие, и таким образом ученые могут влиять на развитие устойчивых характеристик и свойств (рис. 5).  Рис. 5. Переноса генов одного вида растений на другое. Серая биотехнология используется для охраны окружающей среды. Ее методы применяются для очистки канализационных стоков, санации почв, очистки газов и отработанного воздуха, для переработки отходов. Но и это еще не все. Существует и белая биотехнология, которая охватывает сферу использования в химической промышленности. Биотехнологические методы в данном случае применяются для безопасного с экологической точки зрения и эффективного производства ферментов, антибиотиков, аминокислот, витаминов, а также алкоголя. И наконец, последняя разновидность. Синяя биотехнология основана на техническом применении различных организмов, а также процессов морской биологии. В этом случае в центре исследований - биологические организмы, населяющие Мировой океан. 6. Одни из последних новостей в мире биотехнологии: 1. Изготовлена бактерия с синтетическим минимальным геномом (рис. 6). Сотрудники института Крейга Вентера сообщили о новом успехе на пути к созданию искусственных микроорганизмов с заданными свойствами. Используя разработанные ранее методы изготовления синтетических геномов и внедрения их в бактериальные клетки, исследователи создали жизнеспособную бактерию, геном которой содержит всего лишь 531 тысячу пар оснований и 473 гена — меньше, чем у любых существующих в природе микробов, способных к самостоятельному размножению. В ходе работы стало ясно, что современные знания об устройстве клетки и функциях генов всё еще недостаточны для проектирования геномов с чистого листа, поэтому без метода проб и ошибок обойтись пока не удается. Функции 149 из 473 генов «минимального генома» неизвестны: эксперименты показали, что эти гены необходимы для устойчивого роста бактерий, но что именно они делают, еще предстоит выяснить.  Рис. 6. Группа бактерий JCVI-syn3.0 с синтетическим минимальным геномом, содержащим всего лишь 473 гена — меньше, чем у любого другого самостоятельно размножающегося организма. Изменчивый размер клеток — одна из отличительных черт нового микроба. Длина масштабного отрезка — 200 нм. 2. Нефотосинтезирующую бактерию можно обучить фотосинтезу, поместив ее в подходящую среду (рис. 7.) Американские химики и биоинженеры создали «гибридную» фотосинтезирующую систему, в которой светособирающую функцию выполняют наночастицы сульфида кадмия, а живая нефотосинтезирующая бактерия Moorella thermoacetica забирает у них возбужденные светом электроны, которые она затем использует для восстановления CO2 и синтеза органики. Ожидается, что подобные биотехнические устройства, преобразующие энергию солнечного света в нужные человеку органические вещества, в дальнейшем превзойдут по эффективности и удобству использования обычные фотосинтезирующие организмы. 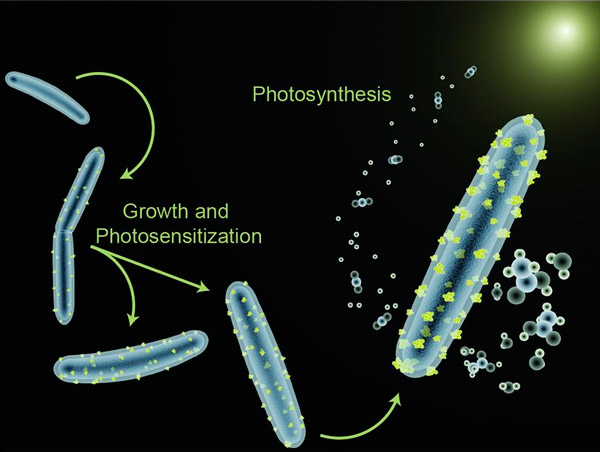 Рис. 7. Схема гибридной фотосинтезирующей системы, созданной американскими биоинженерами. Бактерии Moorella thermoacetica делятся и растут, осаждая на своей поверхности наночастицы сульфида кадмия (показаны желтым цветом). В результате бактерии «фотосенситизируются», то есть приобретают способность к фотосинтезу: производству органики (уксусной кислоты) из CO2 за счет энергии света. 3. В бактерию без циркадных ритмов встроили «часы» от цианобактерии (рис. 8). Ученые снабдили молекулярными циркадными часами бактерию, у которой не было природных циркадных ритмов. К таким часам можно подключить любые гены, и их работа станет зависимой от времени суток. С помощью имплантации суточных часов можно будет лечить заболевания, связанные с расстройством циркадных ритмов, или наладить адресную доставку лекарств в пораженные ткани строго по расписанию. 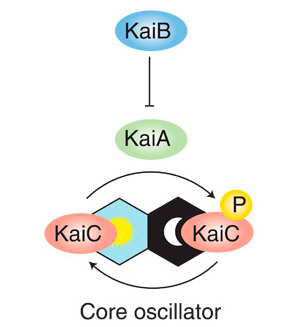 Рис. 8. Схема работы осциллятора бактерий Synechococcus elongatus. Белок KaiC может фосфорилировать или дефосфорилировать сам себя. Днем ему в этом помогает белок KaiA. Ночью работу KaiA подавляет KaiB. Так происходит в природных условиях, но цикл можно воспроизвести и в пробирке, и в полной темноте. Рис. 8. Схема работы осциллятора бактерий Synechococcus elongatus. Белок KaiC может фосфорилировать или дефосфорилировать сам себя. Днем ему в этом помогает белок KaiA. Ночью работу KaiA подавляет KaiB. Так происходит в природных условиях, но цикл можно воспроизвести и в пробирке, и в полной темноте.4. Получены растения, у которых можно «включать» режим устойчивости к засухе (рис. 9). При недостатке воды растения выделяют фитогормон — абсцизовую кислоту (АБК), — который изменяет активность генов, переводя растение в режим экономии. Однако этот гормон дорог в получении и быстро разлагается. Ученые создали вариант рецептора, который вместо АБК активируется уже используемым в сельском хозяйстве химикатом, безвредным для человека. У растений с таким рецептором режим устойчивости к засухе можно включать при первой необходимости. Растения чутко реагируют на недостаток воды: у них выделяется фитогормон под названием абсцизовая кислота (АБК), который изменяет активность генов, переводя растение в режим экономии воды. При этом у растения уменьшается просвет устьиц в листьях, благодаря чему оно теряет меньше воды за счет испарения. Для сельского хозяйства было бы очень удобно поставить этот процесс под контроль, чтобы у ценных растений режим экономии воды можно было включать заблаговременно, еще до того, как растение начнет чувствовать влияние засухи. Самый простой, на первый взгляд, способ помочь растениям бороться с засухой — это опрыскивать их раствором абсцизовой кислоты. Однако синтез этого вещества обходится дорого, и, кроме того, оно довольно быстро разлагается.  Рис. 9. Arabidopsis thaliana обычный (WT, wild type) и модифицированный, переведенный в режим экономии воды (PYR1MANDI), после небольшой самодельной засухи. 5. Создана насадка на смартфон для молекулярной диагностики. Наши смартфоны мощнее компьютеров, которые использовались при запуске миссий «Аполлон». Но, что еще замечательнее, их возможности шире. Уже созданы специальные насадки, которые позволяют использовать смартфоны для микроскопии и даже для диагностики глазных болезней. А теперь американские ученые разработали насадку и программу для смартфона, чтобы превратить его в своеобразную минилабораторию для сверхбыстрой молекулярной диагностики. В биологии есть методы, которые позволяют получить очень важные данные (например, позволяющие поставить диагноз больному), но при этом простые по своей сути. Один из таких методов — это молекулярная диагностика с помощью антител, использующая их способность хорошо распознавать определенные виды молекул. Антитела снабжаются метками, благодаря которым их легко увидеть (например, к ним пришивают флуоресцирующие молекулы). Потом такие антитела добавляют к образцу, выжидают, пока произойдет связывание, и смывают лишние антитела. В итоге по флуоресценции связавшихся с образцом антител можно видеть, где находятся интересующие нас молекулы. Модификация этого метода — это вылавливание целевых молекул из образца с использованием антител в качестве наживки. Для этого применяют относительно крупные шарики, облепленные антителами к тому, что нам интересно. Шарики нужно добавить в образец, подождать, пока на антитела налипнут их мишени, а потом извлечь шарики, а с ними — и целевые молекулы. Похожий метод ученым удалось адаптировать для сверхбыстрой диагностики, которую теперь можно проводить с помощью обычного смартфона. Чтобы превратить смартфон в диагностическую лабораторию, устройство нужно будет снабдить специальной насадкой, в которой есть отделение для образца и источник света, а также приложением, которое отправляет данные для анализа на сервер, а потом демонстрирует результаты молекулярного исследования пользователю (рис. 10). С помощью такого устройство можно будет проверять наличие определенных молекул на поверхности клеток образца (например, крови). К клеткам нужно будет добавить шарики с антителами к интересующим нас молекулам (такие шарики можно купить, как и любые другие лабораторные реактивы). Камера смартфона используется, чтобы запечатлевать дифракционную картину, которая образуется при рассеянии лучей на смеси шариков и исследуемых клеток. Картинка отправляется на сервер, который восстанавливает по дифракционной картине расположение клеток и шариков (рис. 11). Чем больше шариков налипло на определенную клетку — тем больше на ее поверхности целевых молекул. 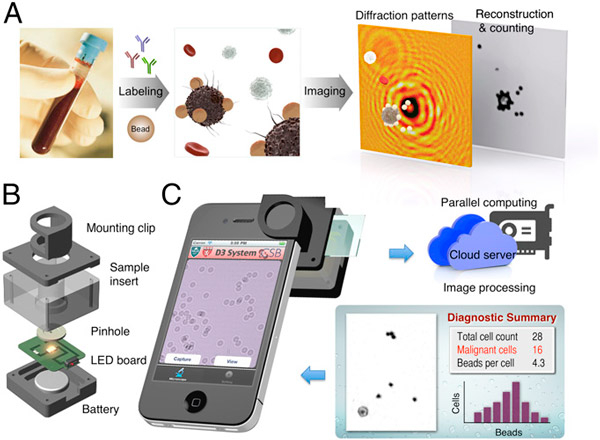 Рис. 10. Схема работы системы молекулярной диагностики с использованием смартфона. А — схема проведения диагностики: сначала нужно подготовить образец исследуемой ткани (например, крови); затем, используя антитела, пометить цели специальными шариками; после чего снять дифракционную картину и отправить ее для анализа на сервер. В — устройство насадки. С — взаимодействие смартфона и сервера. 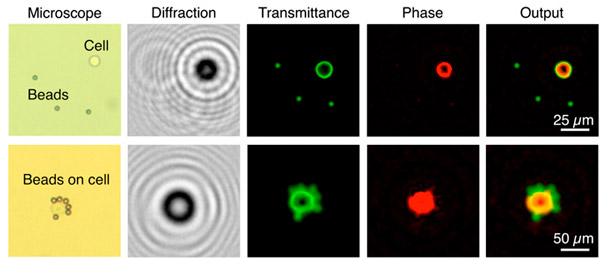 Рис. 11. Пример работы системы диагностики. Верхний ряд — шарики не прикрепились к клетке, нижний ряд — шарики налипли на клетку (размер шариков — 7 мкм). Одних только дифракционных картин (Diffraction) для корректного распознавания не достаточно, алгоритм также использует данные по прозрачности (Transmittance) и фазовому сдвигу (Phase) объектов — по этим параметрам шарики сильно контрастировали с изучаемыми клетками. 6. Выращенный в лаборатории зачаток печени превратился в организме мыши в функционирующий орган. Японским исследователям удалось создать трансплантат печени необычным методом: они не стали выращивать искусственный орган вне организма целиком, а получили в лаборатории лишь его зачаток, напоминающий эмбриональный. Спустя двое суток после вживления такого зачатка печени в организм подопытного животного трансплантат прирастал к кровеносным сосудам хозяина и начинал функционировать и развиваться. При искусственном запуске гепатита трансплантат помогал подопытному животному выжить, беря на себя функции его печени. Получение искусственных органов из индуцированных плюрипотентных клеток — область исследований, стремительно прогрессирующая прямо у нас на глазах. Некоторое время назад на «Элементах» мы рассказывали о создании искусственных костей; для этого клетки — предшественники костной ткани выращивались на специальной основе, полученной из кости теленка после удаления его клеток. А недавно в журнале Nature Communications появилась статья о получении искусственного сердца, по сути дела, тем же методом — культивированием человеческих клеток на каркасе, полученном из сердца мыши, из которого были удалены все мышиные клетки. Кроме того, методу выращивания искусственных органов вне организма реципиента была найдена интересная альтернатива: оказывается, в лаборатории достаточно получить лишь зачаток будущего органа, который при вживлении в организм будущего хозяина разовьется в полноценный орган с требуемыми характеристиками. Эффективность такого подхода продемонстрировала группа японских исследователей, получив трансплантаты человеческой печени из выращенных в лаборатории небольших зачатков, напоминающих эмбриональные. Такие зачатки устроены несравненно проще, чем зрелые органы, поэтому для их выращивания не нужны сложные биореакторы и структурные основы анатомической формы. Для получения зачатка печени необходимо иметь лишь клетки нескольких типов: клетки сосудов, мезенхимные стволовые клетки, а также клетки энтодермы печени, соответствующие тем клеткам кишки зародыша, которые выпячиваются от нее, образуя зачаток будущей печени. Последние клетки получали из индуцированных плюрипотентных клеток человека, превращая их сначала в клетки энтодермы (клетки первичной кишки зародыша), а затем в клетки энтодермы печени, в которых уже работают некоторые характерные для клеток зрелой печени гены (рис. 12). При правильном количественном соотношении этих типов клеток, а также при культивации их на подходящей подложке создаются условия, напоминающие те, в которых формируется зачаток печени эмбриона. При этом клетки, растущие на обычной чашке Петри, формируют компактную структуру, которую можно успешно пересадить в организм-реципиент (см. рис. 13). 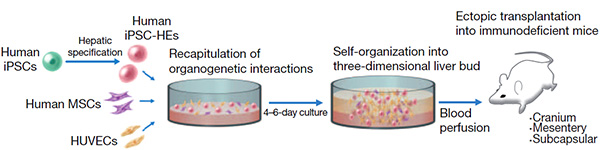 Рис. 12. Схема эксперимента. Из плюрипотентных клеток человека (iPSC) получали клетки энтодермы печени (iPSC-HE, клетки энтодермы печени — предшественники зрелых клеток печени). Эти клетки культивировали на чашке Петри вместе с мезенхимными клетками (MSC) и клетками эндотелия сосудов (HUVEC). После формирования компактного зачатка печени его пересаживали иммунодефицитным мышам и исследовали функционирование трансплантата. 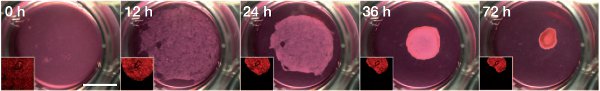 Рис. 13. Образование компактного зачатка печени при совместной культивации на чашке Петри мезенхимных клеток, клеток эндотелия сосудов и клеток энтодермы печени. 7. Одноклеточные водоросли — перспективная платформа для производства противораковых иммунотоксинов (рис. 14). Одноклеточные водоросли могут стать экономически эффективной системой для производства противораковых иммунотоксинов. В отличие от других клеток эукариот, клетки водорослей быстро размножаются на дешевых питательных средах, а хлоропласты водорослей, в отличие от бактерий, способны не только синтезировать чужеродные белки, но и осуществлять сложные постсинтетические процессы, необходимые для активации белков. Гены, кодирующие чужеродный белок, встраивают в геном хлоропластов водорослей, после чего те начинают синтезировать белок иммунотоксина в больших количествах. Традиционные химио- или радиотерапия, применяемые для лечения рака, обладают принципиальным недостатком. Они преимущественно убивают раковые клетки, но в той или иной мере подавляют и нормальные. Известно, что многие клетки злокачественных опухолей или злокачественные клетки кровеносной системы имеют на поверхности специфические белки. Поэтому с помощью антител против этих белков можно доставлять поражающие агенты именно к этим клеткам, что сейчас активно используется в разработке специфичных противоопухолевых препаратов. Антитела (иммуноглобулины) являются важнейшим фактором иммунитета. Они распознают чужеродные для организма агенты — бактерии, вирусы, белки и др. Антитела могут инактивировать эти агенты просто путем связывания или запускать иммунный ответ, например систему комплемента — комплекса протеолитических ферментов. Одним из путей исследований по адресному поражению раковых клеток является разработка методами генной инженерии иммунотоксинов — антител против белков, специфичных для этих клеток, с прикрепленным к антителам химическим или природным токсичным агентом. Антитело должно «узнать» раковую клетку, а токсичный агент — убить ее. Идея высказана давно, но практическая реализация оказалась затруднительной из-за сложности задачи и отсутствия экономически эффективных технологий для изготовления таких весьма сложных комплексов. Так, рекомбинантный иммунотоксин — фрагмент антитела с присоединенным к нему токсином, — можно производить в клетках бактерий (в основном для этого используется кишечная палочка Esherichia coli; чтобы бактерии продуцировли чужеродные белки, в них вводят гены этих белков при помощи плазмид). Однако бактерии не могут осуществлять многие постсинтетические процессы, необходимые для обеспечения биологической активности белков эукариот: они неспособны формировать правильные дисульфидные связи, правильно укладывать синтезированные полипептидные цепи чужеродных белков, что необходимо для их активности (иначе белки не смогут выполнять свою функцию). Рекомбинантный иммунотоксин в клетках бактерий получается в виде неактивного нерастворимого агрегата. Чтобы этот белок активировать, приходится его выделять, денатурировать (снова его разворачивать) и укладывать белковые цепи искусственно. В культурах клеток эукариот эта проблема формирования правильной трехмерной структуры чужеродного белка решается, но токсины будут отравлять клетки-продуценты (клетки, которые производят белок). Тем не менее эти трудности, по крайней мере частично, удается преодолеть обходным путем, если исключить прямой контакт культуры клеток-продуцентов с токсином. Например, активные антитела против специфичного для некоторых лимфом (злокачественного перерождения лимфоцитов) белка клеточной мембраны CD30 изготовляют в культурах клеток млекопитающих — CHO-клетках хомячков (см. CHO cells). Их очищают и связывают с химическим соединением ауристатином Е (Monomethyl auristatin E), подавляющим деление эукариотических клеток. Показана высокая активность и избирательность действия этого препарата (Brentuximab vedotin) против злокачественных клеток. Он уже разрешен в США для применения в клинике по крайней мере против двух форм лимфомы. Однако, вследствие больших затрат на разработку, сложности и дороговизны производства, цена Brentuximab vedotin оказалась поистине астрономической: курс лечения будет стоить примерно 100 тысяч долларов.  Рис. 14. Одноклеточная зеленая водоросль Chlamydomonas reinhardtii. Диаметр клетки примерно 10 мкм. Единственный зеленый хлоропласт занимает почти весь объем клетки. Рис. 14. Одноклеточная зеленая водоросль Chlamydomonas reinhardtii. Диаметр клетки примерно 10 мкм. Единственный зеленый хлоропласт занимает почти весь объем клетки.7. Развитие биотехнологических методов существенно изменит жизнь человека в лучшую сторону, посредством повышения качества пищи, использования новых медицинских препаратов, а также понижения уровня загрязнения экологии планеты. У биотехнологии, генетической и клеточной инженерии многообещающие перспективы. Со временем человек будет внедрять нужные гены в клетки растений, животных и человека, что позволит постепенно избавиться от многих наследственных болезней, заставит клетки синтезировать необходимые лекарства и биологически активные соединения, а затем — непосредственно белки и незаменимые аминокислоты, употребляемые в пищу. Используя методы, уже освоенные природой, биотехнологи надеются получать с помощью фотосинтеза водород — самое экологически чистое топливо будущего, а также превращать в аммиак атмосферный азот при обычных условиях и т. д. Биотехнология решает не только конкретные задачи науки и производства. У нее есть более глобальная методологическая задача — она расширяет и ускоряет масштабы воздействий человека на живую природу и способствует адаптации живых систем к условиям существования человека, т. е. к ноосфере. Биотехнология, таким образом, выступает в роли мощного фактора антропогенной адаптивной эволюции.  Список литературы: 1. Н.А. Лемеза Л.В.Камлюк Н.Д. Лисов «Пособие по биологии для поступающих в ВУЗы». 2. Образование и наука Екатерина Кириллова «Что такое биотехнология? Основные направления и достижения». 3. Интернет-источник: http://jbio.ru/biotexnologiya-osnovnye-napravleniya-i-dostizheniya 4. Интернет-источник: https://ru.wikipedia.org/wiki/Биотехнология 5. Интернет-источник: https://vseobiology.ru/biotekhnologiya/242-3-zadachi-sovremennoj-biotekhnologii-tendentsii-i-perspektivy-ee-razvitiya |
