биотехнология. 8_теория_стероиды. Биотехнология стероидных соединений
 Скачать 174.8 Kb. Скачать 174.8 Kb.
|
|
БИОТЕХНОЛОГИЯ СТЕРОИДНЫХ СОЕДИНЕНИЙ Стероиды – это вещества, обладающие высокой биологической активностью, в основе структуры которых лежит скелет циклапентанпергидрофенантрена (гонана, стерана). 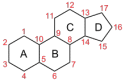 К стероидам относятся: • витамины D • желчные кислоты • сапонины • сердечные гликозиды • стероидные алкалоиды • стероидные гормоны глюкокортикоиды (гидрокортизон, кортизон); минералокортикоиды (альдостерон); женские половые гормоны – эстроген, прогестерон, экстрадиол); мужские половые гормоны – тестостерон, дигидротестостерон, андростендион) ОСОБЕННОСТИ СТРОЕНИЯ ПРИРОДНЫХ СТЕРОИДОВ Для природных стероидов характерно присутствие • при С-3 – гидроксильной группы или кетогруппы (эстрогены) • при С-17 – карбонильная или гидроксильная группа (андрогены и эстрогены); боковая углеродная цепь; • у кортикостероидов – наличие кислородной группы при С-11; • стероидные соединения различаются числом и месторасположением заместителей (гидроксильной, аминной, карбонильной группы) в ядре и появления или исчезновения двойных связей. Стероиды обнаружены практически во всех организмах. Способность к биосинтезу стероидов наиболее выражена у высших позвоночных. Насекомые стероиды не вырабатывают, а получают с пищей, однако функция их линьки контролируется стероидами. БИОСИНТЕЗ СТЕРОИДОВ Все стероиды объединяются одной схемой биогенеза. Предшественником стероидных гормонов является холестерин. Он синтезируется в основном в печени. Ас-КоА → мевалоновая кислота → изопреновые фрагменты(изопентенилпирофосфат и изомерный ему диметилаллилпирофосфат) → сквален → ланостерин → холестерин. Транспортируется холестерин липопротеидами (ЛНП, ЛОНП, ЛВП, ХМ). Деградация стероидных гормонов происходит в основном в печени. Их ОН-группы обычно связаны с сульфатом или глюкуроновой кислотой и экскретируются в желчь или мочу. Проблема сырья для получения стероидных препаратов Стероиды можно получить из: • спинного мозга и желчи рогатого скота, • щелочного гидролизата дрожжей, • растительных масел • животных жиров, • отходов целлюлозо-бумажного производства, • растений • культуры клеток растений; • синтезируют из неприродного сырья; • микробиологической трансформацией уже имеющего стероида (с использованием бактерий и грибов) виды стероидного сырья • Эргостерин является провитамином витамина Д. Особенно много эргостерина в пекарских дрожжах. • Стигмастеринсодержится в большом количестве соевом масле, в сахарном тростнике. • β-ситостерин.Содержится во всех растениях и в отходах древесины. Коммерческий источник: тростник и хлопковое масло. Стигмастерин и ситостерины – наиболее перспективные и дешевые исходные продукты для получения стероидных препаратов. • Соласодинсодержится в паслене дольчатом(Solanum laciniatum), который растет в Казахстане. Однако производство соласодина нерентабельно, поэтому недостаток исходного сырья для медицинской промышленности восполняется за счет импортируемого диосгенина. • Диосгенинсодержится в растении диоскорее – это дорогое импортное сырье. В качестве сырья для его получения используют корневища дикорастущих и культивируемых видов диоскореи с высоким содержанием этого стероида. Также в качестве промышленного сырья за рубежом используются агавы, различные виды паслена, пажитника, юкки. Экономически выгодный источник для получения диосгенина: диоскорея дельтовидная (Dioscorea deltoidea), в ее корневищах – до 6% этого стероида. В последние годы перспективный источник диосгенина – высокопродуктивные штаммы суспензионной культуры клеток диоскореи дельтовидной, содержащие до 10% стероидных гликозидов. Проблема селективного отщепления боковых цепей стероидов При использовании фитостеринов необходимо добиться селективного удаления насыщенной алифатической боковой цепи и сохранением ядра (скелета) молекулы. Решение: 1. синтез модифицированных стеринов, ограничивающих действие микроорганизмов (заместители в кольце А или В которых не позволяют микроорганизмам осуществлять 1,2-дегидрирование или 9α-гидроксилирование) 2. инкубация стеринов в присутствии соединений, ингибирующих действие ферментов гидролаз (9α-гидроксилазы или 1,2-дегидрогеназы), 3. получение мутантных штаммов ограниченного действия на стероидное ядро. БИОКОНВЕРСИЯ (БИОТРАНСФОРМАЦИЯ) Микробиологическая трансформация стероида – это использование ферментативной активности микроорганизмов для селективного изменения стероида. Микроорганизмы могут влиять только на отдельные (единичные) стадии довольно сложных и длительных процессов химического синтеза. Преимущества использования микробиологической трансформации: • мягкие условия протекания; • значительноупрощается синтез лекарственных средств (меньше стадий); • появляется возможность осуществления тех реакций, которые достаточно трудны или вообще не осуществимы в химическом синтезе; • небольшое количество вредных для биосферы отходов и побочных продуктов; • позволяет осуществлять рентабельный промышленный синтез лекарственных средств (пример промышленного синтеза гидрокортизона, преднизолона, дексаметазона, осуществленного только после разработки микробиологических способов их получения). Недостатки микробиологических методов по сравнению с химическими: • ферменты функционируют в большинстве случаев в водной среде, а большинство субстратов, как правило, плохо растворимы в воде. Поэтому в процессах приходится использовать растворы низкой концентрации, что приводит к низкому выходу целевого продукта с единицы объема аппарата. • Трудности, связанные с культивированием микроорганизмов (необходимость асептических условий, интенсивного массообмена и обработки больших количеств микробной массы или культуральной среды, загрязнением целевого продукта биотрансформации питательными веществами и продуктами их метаболизма и др.) • крупнотоннажное производство на основе методов микробиологической трансформации требует высоких энергетических затрат. Иногда для биоконверсии требуются смешанные культуры или последовательное добавление микробных штаммов или видов, каждый из которых осуществляет специфическую стадию биоконверсии. К основным процессам микробиологической трансформации относятся: окисление, восстановление, гидролиз, дегидрирование, декарбоксилирование, дезаминирование, образование гликозидов, метилирование, ацетилирование и др. В определении скорости и направления реакции главную роль играют положение и ориентация замещающих групп в молекуле стероидов. История развития микробиологической трансформации стероидов Еще в конце Х1Хв. стало известно, что бактериальная флора кишечника млекопитающих превращает холестерин в копростерин, а холевую кислоту в дезоксихолевую. В 1908 году была открыта способность кишечной палочки (E.coli) окислять гидроксильные группы стероидных соединений. В 1948 году впервые осуществили введение гидроксильной группы в молекулу стероида микробиологическим путем. В 1949 году было выявлено эффективное антиревматическое свойство кортизона и ученые синтезировали ацетат кортизона из дезоксихолевой кислоты с выходом продукта всего 15%. Первоначально химический синтез кортизона включал 37 стадий, а стоимость 1г вещества: 200 долларов. Но только в 1952 году, после получения 11-α-гидроксипрогестерона (авторы Петерсон и Меррей) из прогестерона культурой плесневого гриба Rhizopus nigricans уже с высоким выходом продукта, представилась возможность промышленного использования микроорганизмов в синтезе лекарственных средств стероидной структуры. В результате микробиологической трансформации синтез кортизола упал до 11 стадий, а стоимость 1г – 6 долл. Основоположник биотрансформации стероиов в российской науке: Скрябин. В конце 60-х – начале 70-х годов были разработаны и внедрены в производство технологии получения преднизона и преднизолона, впервые в СССР было освоено промышленное производство стероидных препаратов на основе микробиологической трансформации. Использование мутантных штаммов позволило к 2002 г снизить цену кортизола в США до 0,3 долл. за 1 г, т.е. в 600 раз меньше по сравнению с чисто химическим синтезом. Проведение биотрансформации стероидов Это аэробный процесс глубинной ферментации, для проведения которой используется оборудование, отвечающее высокой степени массообмена. Чтобы провести трансформацию какого-либо вещества, вначале размножают культуру соответствующего микроорганизма до количества, равного 5-10% объема трансформируемого раствора. Раствор для трансформации вещества готовят, учитывая, что в нем надо растворить максимально возможное количество трансформируемого вещества (обычно 10-25%) и надо использовать минимальное количество необходимых для развития культуры питательных веществ, в таком виде, чтобы не было затруднено химическое выделение вещества. Если трансформируемое вещество не растворяется в воде, его предварительно растворяют в нейтральном органическом растворителе и затем, при интенсивном перемешивании, смешивают с основной средой. При поисковых работах ограничиваются проведением реакции в колбах на качалках, загрузка стероида в колбу составляет 100—200 мг. Для загрузок порядка 1—2 г стероида применяют стеклянные ферментеры. В промышленности и на опытных установках применяют стальные аппараты, оборудованные аэрирующими и перемешивающими устройствами. Обычно используют культуру-трансформатор в стадии замедления роста, когда питательные компоненты среды в значительной степени израсходованы, а сильно разросшаяся культура подавляет рост других микроорганизмов. Трансформация может осуществляться • растущей на среде культурой, • отмытыми от питательной среды клетками микроорганизма. Это предпочтительнее – облегчает выделение и очистку целевого продукта. Но, как показала производственная практика, не все микроорганизмы переносят промышленное сепарирование без потери активности (мукоровые грибы очень чувствительны к сепарированию, а несовершенные грибы теряют свою активность незначительно). Трансформация стеринов микроорганизмами основана на их использовании в качестве источника углерода, поэтому стимуляция роста трансформирующих штаммов должна приводить к увеличению выхода продуктов расщепления стеринов. Процесс стимулируется насыщением среды кислородом. Добавление в питательную среду некоторых масел (соевого, арахисового, рапсового, оливкового) повышает выход продукта трансформации. Аналогичные результаты получены с применением глицеридов животного и растительного происхождения. Механизм – в устранении гидрофобности стеринов (глицериды действуют как неионные ПАВ). Т: 24—33°С. Микробиологический контроль: только на стадии выращивания трансформирующей культуры. Аналитический контроль реакции трансформации ведется путем отбора проб через определенные временные интервалы и анализа их методом тонкослойной хроматографии в присутствии «свидетелей» (стандартные вещества – исходный стероид, целевой продукт трансформации и некоторых промежуточные и побочные продукты). После завершения трансформации культуральная жидкость, отделенная от мицелия (или другой биомассы), экстрагируется несмешивающимся с водой органическим растворителем, пригодным для растворения соответствующего стероида (этилацетат, метиленхлорид или хлороформ). Экстракт, отделенный от водной фазы, проходит требуемую очистку (окрашенные примеси обычно отделяют обработкой с активированным углем, затем уголь отфильтровывают); далее его концентрируют в вакууме и полученный осадок стероида перекристаллизовывают из подходящего растворителя. В препаративных целях при работе с небольшими количествами стероидов очистку продукта трансформации можно проводить методом колоночной хроматографии. Все операции по подготовке и выращиванию трансформирующих культур проводят в стерильных условиях. Однако внесение стероидного субстрата на трансформацию и сам процесс трансформации, как правило, проводят не стерильно. Для уменьшения вероятности загрязнения используют стерильную воду при приготовлении суспензии стероидных субстратов, поскольку сами стероиды обычно неустойчивы в условиях автоклавирования. Одним из вариантов решения этой проблемы может служить способ внесения стероидного субстрата в питательную среду до засева ее трансформирующей культурой в момент, когда температура среды после автоклавирования снизится до 80°С и безопасна для субстрата. После выдержки в течение 30 мин среду со стероидом охлаждают до 33°С и в нее стерильно вносят трансформирующую культуру. Правильность преобразования стероидного субстрата контролируют, сочетая химический подход со специфичностью биологической системы. Например, образование уксуснокислого эфира препятствует другим побочным реакциям. ПРОБЛЕМЫ БИОТРАНСФОРМАЦИИ Главным препятствием, стоящим на пути микробиологических трансформаций стеринов, является низкая производительность ферментации, несмотря на высокий процентный выход по субстрату. Это обусловлено: 1. Деградация субстрата.Решение:регулярное его добавления или использования других микроорганизмов. Кроме того, ход синтеза можно контролировать, применяя метод химической модификации. Так, метилирование по 16α-положению подавляет нежелательное восстановление кетогруппы при С20, а образование уксуснокислого эфира по С17 стереохимически препятствует другим побочным реакциям. 2. Проблема растворимости стероидов. Стероиды – малорастворимые в воде соединения: (растворимость: 0,3 – 0,01 г/л). Решение: • стероид сильно измельчается (поступает в среду в микронизированном виде). • подача стероида в растворителе, смешивающемся с водой (ацетоне, метаноле, этаноле, диметилформамиде, диметилсульфоксиде и др.). Ограничение: токсичность определенных концентраций растворителей. • использование водорастворимых форм стероидов в виде натриевых солей 2,1-гемисукцинатов или фосфатов. Трудности: высокая степень избирательности по отношению к ним со стороны микроорганизмов (для некоторых микроорганизмов эти формы стероидов оказались недоступны). • заключение стероидов в растворимый комплекс с циклодекстрином (природные циклические олигосахариды, внешняя поверхность – гидрофильная, внутренняя – гидрофобная). Одним из путей интенсификации процессов трансформации является предварительное индуцирование растущей культуры-трансформаторасоответствующим субстратом или его аналогом (при этом индуцируются соответствующие ферментные системы, применяется в процессах микробиологической дегидрогенизации). Примеры промышленного использования микробиологических трансформаций Получение вещества S Ключевым веществом в производстве кортикостероидов является «вещество S Рейхштейна», стадия его получения в значительной степени определяет конечный выход готовых продуктов следующих трансформаций. Вещество S является модифицированным продуктом биотрансформации моноацетата «вещества R» с помощью культуры Corynebacterium mediolanum. Этот процесс состоит из следующих стадий: - гидролиза 21-ацетогруппы - окисления 3β-гидроксигруппы в 3-кетогруппу - перемещения двойной связи от С-5 к С-4. 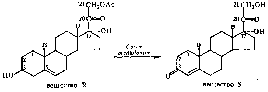 Для коринебактерий нехарактерны реакции расщепления стероидной молекулы → выход вещества S очень большой (почти количественный). КОРТИЗОЛ из ВЕЩЕСТВА S Получение гидрокортизона (кортизола) из вещества S осуществляется с помощью плесневого гриба Сurvukaria linata.  Выращивание трансформирующей культуры производят путем трех последовательных генераций на питательной среде, содержащей сахарозу, дрожжевой автолизат и сложный набор неорганических солей.  Крышку инокулятора перед засевом обрабатывают водным раствором формалина, аппарат и все помещение облучают бактерицидной лампой и весь процесс выращивания трансформирующей культуры проводят в стерильных условиях. Далее полученная трансформирующая культура поступает в сепаратор, откуда отделенный мицелий в виде водной суспензии передается в ферментер для проведения основной реакции трансформации вещества S. 2. Трансформация вещества S (стерилизация ферментера и воздушного фильтра формалином, добавка антибиотика и пеногасителей) 3. Выделение продукта трансформации — гидрокортизона. Культуральная жидкость вместе с мицелием поступает на сепарацию. Отделенный мицелий промывается, промывные воды присоединяются к основной культуральной жидкости. Далее производится экстракция-сепарация продукта трансформации из водной среды органическим растворителем. Осветленный активированным углем экстракт подвергается многократному упариванию с различными растворителями, осветлению, снова упариванию досуха и промывке подходящим растворителем. Микробиологическое гидроксилирование Это наиболее важный и часто применяемый метод. Наличие гидроксильных групп в 3, 11, 16, 17 положениях молекулы стероида, как правило, обусловливает физиологическую активность большинства гормональных стероидных препаратов. Гидроксилирование стероидов осуществляется очень многими микроорганизмами, чаще всего грибами. Гидроксилированию подвергаются субстраты самого различного строения. Причина этого: очень широкая субстратная специфичность гидроксилаз, которую демонстрируют многие микроорганизмы. Гидроксилирование прогестерона 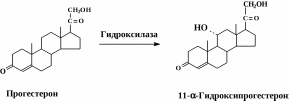 Первым запатентованным процессом микробной трансформации стероидов является процесс 11-α-гидроксилирования прогестерона некоторыми видами грибов, разработанный еще в 1937 г., но внедрить его в промышленность удалось лишь 1952 г. При этом синтез кортизона сократился до 11 стадий вместо 37. В качестве микроорганизма трансформатора применяется плесневый гриб рода ризопус. Дегидрогенизация (ГИДРОКОРТИЗОН в ПРЕДНИЗОЛОН) Распространенность этой реакции объясняется: • наличием соответствующих дегидрогеназ у большого числа микроорганизмов, • доступность связи 1,2 и 4-5 для микробных оксидоредуктаз (особенно при наличии кетогруппы в 3-м положении и (или) двойной связи 4,5). Наличие двойных связей коренным образом влияет на физиологическую активность препаратов (преднизолон).  Удалось снизить стоимость этого препарата в 200 раз. Широкая субстратная специфичность дегидрогеназ позволяет использовать в качестве субстратов ацетаты стероидов, которые являются полупродуктами во многих технологических схемах получения стероидов. Пример: Mycobacteriumglobiformeэффективно превращает и кортизонацетат в преднизонацетат с выходом 86%. БИОТРАНСФОРМАЦИЯ СТЕРОИДОВ С ИСПОЛЬЗОВАНИЕМ КУЛЬТУР РАСТИТЕЛЬНЫХ КЛЕТОК Биотрансформация стероидов с использованием культур растительных клеток имеет целый ряд преимуществ перед микробиологической трансформацией. Так, если трансформация в положения 3 и 5 характерна практически для всех используемых культур (микроорганизмы, растительные клетки), то реакции Iβ-, 4β-, I2β- (дигитоксин в дигоксин), 16β-гидроксилирования и изомеризации 17β-лактонного кольца, осуществляются только некоторыми культурами растительных клеток, и сильно, зависят от происхождения ткани и условий трансформации. Пример: дигитоксин в дигоксин клетками Digitalis lanata (наперстянки шерстистой) – 12-гидроксилирование. 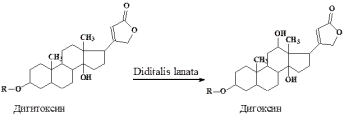 Недифференцированные культуры Digitalis не образуют сердечных гликозидов, но могут осуществлять определенные реакции биотрансформации субстратов, добавленных в питательную среду. Использование соевой муки Изучение влияние различных источников углеводов и азота на процесс биотрансформации холестерина в андростендион легло в основу разработки новой композиции ферментационной среды, в состав которой не вошла соевая мука. Исключение этого белкового компонента из композиции питательной среды дает положительный эффект при дальнейших стадиях (выделение и химическая очистка) получения конечного продукта. Микробиологическое восстановление Селективность действия микробных ферментов позволяет восстановить определенную кето-группу стероидов (химическим путем это невозможно). Гидролиз эфиров стероида Использование гидролиза эфиров стероидов имеет практическое значение, так как ацилированные стероиды являются обычными промежуточными продуктами химического синтеза, в котором применяется ацильная защита функциональных групп. Хотя гидролиз ацильной группы легко осуществим химическим путем, он часто приводит к побочным нежелательным продуктам. Микробиологическое расщепление эфирной связи осуществляется флавобактериями, актиномицетами, мукоровыми и несовершенными грибами. Ценность представляют как культуры, избирательно отщепляющие ацильную группу, так и микроорганизмы, способные наряду с гидролизом эфирной связи осуществлять еще какую-либо практически важную реакцию. Пути интенсификации микробиологических трансформаций 1. Применение иммобилизованных клеток; 2. Использование оптимального сочетания биологических и химических превращений; 3. Совершенствование технологии очистки получаемых соединений. ИММОБИЛИЗОВАННЫЕ КЛЕТКИ Преимущества этого направления: • не нужно выделять и очищать ферменты, • более высокая активность работы клеток, • стабильность работы клеток, • не нужно выделять и очищать продукты реакции (они уже изолированы от биомассы), • применение автоматизации процесса • длительное функционирование клеток микроорганизма. Именно стероиды были одними из первых субстратов, которые удалось трансформировать с помощью иммобилизованных клеток. Методы иммобилизации клеток: 1. адсорбция; 2. ковалентное и поперечное связывание; 3. метод включения в различные полимеры (целлюлозные волокна мембраны или альгинатные гели; 4. микрокапсулирование. |
