1 доменды ад. Бірдоменді антидене. Бірдоменді антидене
 Скачать 359.25 Kb. Скачать 359.25 Kb.
|
25 кДа, екі өзгермелі домен, біреуі жеңіл, екіншісі ауыр тізбектен тұратын) де кіші [1]. Бірдоменді антидене Бір доменді антидене (sdAb), сонымен қатар нанодене деп аталады, бұл бір мономерлі антидененің өзгермелі доменінен тұратын антидене фрагменті. Тұтас антидене сияқты, ол арнайы антигенмен таңдамалы байланысуға қабілетті. Молекулалық салмағы небары 12-15 кДа болатын бір доменді антиденелер, екі ауыр нәруыз тізбектерінен және екі жеңіл тізбектерден тұратын кәдімгі антиденелерден (150-160 кДа) әлдеқайда кіші, олар тіпті бір жеңіл тізбек және ауыр тізбектің жартысынан тұратын Fab бөлігінен ( |
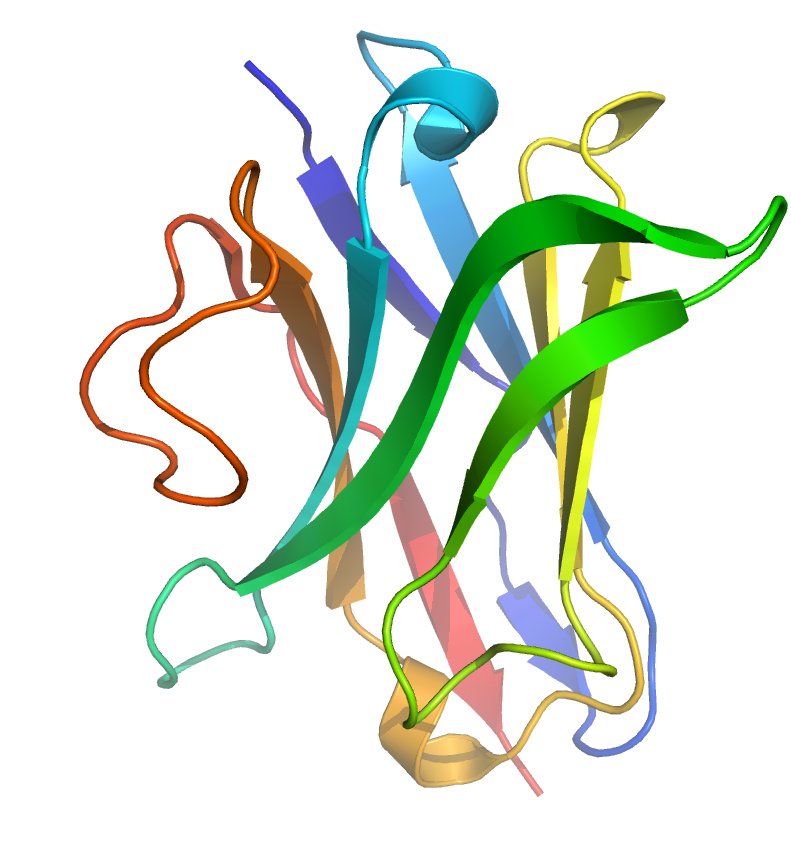 | Лама VHH домен жолағының сызбасы. CDR3 кеңейтілген ілмегі қызғылт сары түске боялған. |
Алғашқы бірдомендік антиденелер түйе тұқымдастарында табылған ауыр тізбекті антиденелерден құрылды; олар VHH фрагменттері деп аталады. Шеміршекті балықтарда да ауыр тізбекті антиденелер бар (IgNAR, «иммуноглобулиндік жаңа антигені рецепторы»), олардан VNAR фрагменттері деп аталатын бір доменді антиденелер алуға болады [2]. Адамдардың немесе тышқандардың жалпы иммуноглобулин G-нің (IgG) димерлі өзгермелі домендерін мономерлерге бөлу балама тәсіл болып табылады. Бір доменді антиденелерді зерттеудің көпшілігі қазіргі кезде ауыр тізбектің өзгермелі домендеріне негізделгенімен, жеңіл тізбектерден алынған наноденелер мақсатты эпитоптармен арнайы байланысатындығы да дәлелденді [3].
Түйенің бір доменді антиденелері кәдімгі антиденелер сияқты арнайылық, ал кейбір жағдайларда олардан да төзімді болып шықты. Сонымен қатар, олар дәстүрлі антиденелер үшін қолданылатын фагты пэннинг процедурасының көмегімен оңай оқшауланады, бұл оларды in vitro жағдайында жоғары концентрацияда өсіруге мүмкіндік береді. Жаппай өндіріс үшін кіші көлемі және жалғыз домен бұл антиденелерді бактериялық жасушаларға енгізуге жеңілдетеді, оларды зерттеу мақсатында өте ыңғайлы етеді [4].
Бір доменді антиденелер әртүрлі фармацевтикалық қолдану үшін зерттелуде және жедел коронарлық синдром, қатерлі ісік және Альцгеймер ауруын емдеуде қолдану мүмкіндігі бар [5] [6].
Қасиеттері
Бірдомендік антидене - бұл антидененің ауыр тізбекті немесе қарапайым IgG бір өзгермелі доменін (VH) қамтитын ұзындығы шамамен 110 амин қышқылының пептидтік тізбегі. Бұл пептидтер әдеттегі антиденелер сияқты антигендерге ұқсастыққа ие, бірақ детергенттерге және мочевинаның жоғары концентрациясына қатысты тұрақты және температураға төзімді. Түйелер мен балық антиденелері липофильдігі төмен және суда жеңіл ериді, өйткені комплементтілікті анықтайтын 3-аймақ (CDR3) кеңейтілген ілмекті құрайды (жоғарыдағы таспа диаграммасында түрлі-түсті қызғылт сары), ол жеңіл тізбегімен қалыпты жағдайда байланысатын липофильді аймақты жауып тұрады [7] [8]. Кәдімгі антиденелерден айырмашылығы, 1999 жылы жүргізілген зерттеуде алты бірдомендік антиденелердің екеуі антигенмен байланыс қабілетін жоғалтпай, 90°C-та (194°F) тірі қалды [9]. Асқазан қышқылы мен протеазаларға төзімділік аминқышқылдарының реттілігіне байланысты. Кейбір түрлердің ішке қабылдағаннан кейін ішекте белсенді екендігі дәлелденген [10] [11], бірақ олардың ішектен сіңуі төменділігі жүйелік белсенді ішке енгізілетін бір доменді антиденелердің дамуына кедергі болады.
Бір доменді антидене және нәруызды антиген кешені жасырын байланыс орнын анықтайды [12]. Лизоциммен кешен түзген тәрбиеші акуланың бір доменді VNAR (PDB 1T6V) (сол жақта). Гумизирленген Fv HyHEL-10 лизоциммен кешені (PDB 2EIZ) (оң жақта).
Салыстырмалы түрде төмен молекулалық салмағы тіндерге өтуінің жақсаруына және плазмадан бүйрек арқылы жартылай шығарылу кезеңінің қысқалығына ықпал етеді [1]. Тұтас антиденелерден айырмашылығы, олар комплемент тудыратын цитотоксикалықты көрсетпейді, өйткені оларда Fc аймағы жоқ. Түйе мен балықтан алынған SdAbs тұтас антиденелер байланыса алмайтын аймақтармен, мысалы, ферменттердің белсенді жерлері сияқты жасырын антигендермен байланысуға қабілетті [12]. Олардың жасырын жерлерге енуге қабілетті бұл қасиеті кеңейтілген CDR3 ілмегінің нәтижесі екендігі көрсетілген [8] [13] [12].
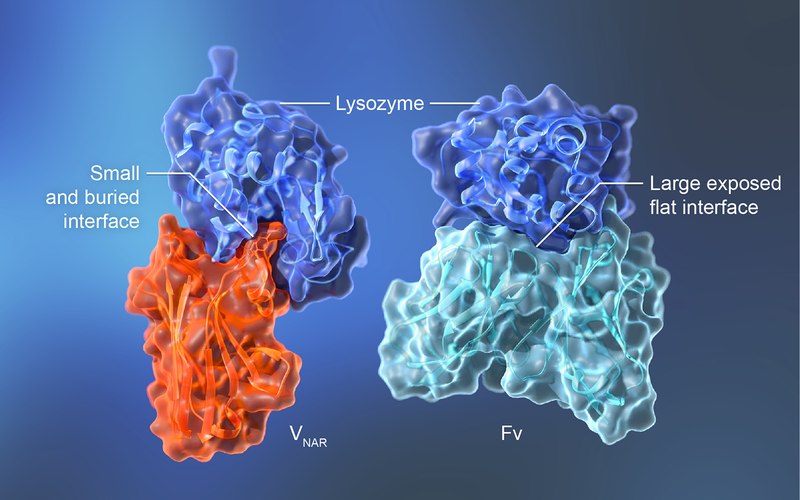
Бір доменді антидене мен протеинді антиген кешені жасырын байланыс орнын анықтайды. [12] (сол жақта) лизоциммен (PDB 1T6V) байланысқан тәрбиеші акуланың бірдоменді VNAR. (оң жақта) лизоциммен кешенделген гуманизацияланған Fv HyHEL-10 (PDB 2EIZ)
Өндірісі
Ауыр тізбекті антиденелерден
Бір доменді антиденені дромедарларды, түйелерді, ламаларды, альпакаларды немесе акулаларды қажетті антигенмен иммунизациялау, содан кейін ауыр тізбекті антиденелерді кодтайтын мРНҚ бөліп алу арқылы алуға болады. ПТР-ұзарту және өздігінен оқшаулауды жинақтау (EASeL) негізінде кітапхананы құру әдісін қолдана отырып, Митчелл Хо мен Мартин Флейник VNAR антиденелерінің үлкен кітапханасын құрды. VNAR антиденелері 1,2 × 1010 өлшемді фагтармен көрсетілген, олар аңғал тәрбиеші акулалардан алынған [14]. Фаг дисплейі және рибосомалық дисплей сияқты скринингтік әдістер антигенді байланыстыратын клондарды анықтауға көмектеседі [15] [14].
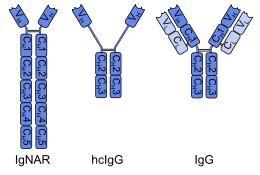 | Акула (сол жақта) және түйе (орталықта) ауыр тізбекті антиденесі, әдеттегі антиденемен (оң жақта) салыстырғанда. Ауыр тізбектер қанықтау көк, жеңіл тізбектер ашық көк реңде көрсетілген. VH және VL - өзгермелі домендер. |
Әдеттегі антиденелерден
Сонымен қатар, балама жолы ретінде, бір доменді антиденелерді тышқанның [16], қоянның [17] немесе адамның төрт тізбекті IgG-ден алуға болады. [18] Алу үрдісі ұқсас, оған иммунизацияланған немесе аңқау донорлардың гендік кітапханалары және неғұрлым арнайы антигендерді анықтау үшін қолданылатын әдістері кіреді. Бұл тәсілдің проблемасы мынада: жалпы IgG байланыстыру аймағы липофилдігіне байланысты димерленуге немесе агрегациялануға бейім екі доменнен тұрады (VH және VL). Мономеризация, әдетте, липофильді амин қышқылдарын гидрофильді қышқылдармен алмастыру арқылы жүзеге асырылады, бірақ көбінесе антигеннің жақындығын жоғалтады. [19] Егер жақындықты сақтауға болатын болса, бір доменді антиденелерді E. coli, S. cerevisiae немесе басқа организмдерде де өндіруге болады.
Адамның бір доменді антиденелерінен
Кейде адамдар кездейсоқ жеңіл тізбекте тежеу-кодон құру арқылы бір доменді антиденелер өндіреді. Ұлттық қатерлі ісік институтының қызметкерлері Митчелл Хо мен Димитр Димитров VH домендік кітапханасынан алынған адамның фаг-дисплейінен мезотелин [20], GPC2 [21] және GPC3 [22] [23] қоса, ісік антигендерінің алуан түріне бағытталған адамның бір-домендік антиденелерін жасады. Адамның бір доменді антиденелері қатерлі ісіктерді емдеу үшін иммунотоксиндерді (HN3-PE38, HN3-mPE24, HN3-T20) [23] [25] [26] және Т-жасушаларын химерлі антигендік рецепторларын (CAR) [21] жасау үшін қолданылған. GPC3-тегі Wnt байланыстырушы доменді адамның HN3 бір доменді антиденелерімен блоктау арқылы бауыр ісігі жасушаларында Wnt активтенуін тежейді [27].
Қолданылу мүмкіншіліктері
Бір доменді антиденелерді биотехникалық және терапевтік мақсатта кең қолдануға болады, өйткені олардың мөлшері аз, дайындалу жолы ыңғайлылы және аффинділігі жоғары [28] [29].
Биотехнологиялық және диагностикалық мақсаттарда қолдану
Флуоресцентті нәруыз наноденемен біріктірілген кезде хромодене деп аталатын кешен түзіледі. Хромоденелерді тірі жасушалардың әртүрлі бөлімдеріндегі нысандарды тану және бақылау үшін пайдалануға болады. Осылайша, олар тірі жасуша микроскопиясының мүмкіндіктерін кеңейтіп, жаңа функционалдық зерттеулер жүргізуге мүмкіндік береді [30]. GFP қарсы наноденелерді моновалентті матрицамен тіркестіру, GFP-пен тіркескен нәруыздарды және олардың өзара әрекеттесетін серіктестерін әрі қарай биохимиялық талдамалар үшін оқшаулауға мүмкіндік береді [31]. Асажоғары ажыратымдылықты кескіндеу әдістерін қолдана отырып, бір молекуланың локализациясы флуорофорларды мақсатты нәруызға жақын жеткізуді қажет етеді. Үлкен мөлшеріне байланысты, органикалық бояғыштармен байланысқан антиденелерді қолдану флуорофор мен мақсатты нәруыз арасындағы қашықтыққа байланысты жалған сигналдарға әкелуі мүмкін. Органикалық бояғыштардың GFP таңбаланған протеиндерге бағытталған анти-GFP наноденемен бірігуі нанометрді кеңістіктік ажыратымдылықты және кішігірім өлшемдер мен жоғары жақындылыққа байланысты байланыс минимумын қамтамасыз етеді [32]. Наноденелердің өлшемдерін бөлу сонымен қатар жеңіл электронды микроскопия көмегімен корреляциялық зерттеулерді жеңілдетеді. Өткізгіштікті күшейтетін қандай-да бір агентсіз, химиялық бекітілген клеткалардың цитоплазмасына флуорофорлы наноденелер қол жетімді. Олардың кішігірім мөлшері әдеттегі антиденелерден гөрі көлемді өспелерге тереңірек енуге мүмкіндік береді. Флюоресценттік микроскоп, содан кейін электронды микроскоп көмегімен бейнеленетін тінде жоғары сапалы ультрақұрылымы сақталады. Бұл әсіресе молекулалық таңбалауды және электронды микроскопияны қажет ететін нейробиологияны зерттеу үшін өте пайдалы [33].
Биосенсорлардың диагностикалық қосымшаларында наноденелерді болашақта құрал ретінде пайдалануға болады. Кішкентай өлшемдеріне байланысты олар биосенсорлық беттермен тығыз байланысуы мүмкін. Эпитоптарға қол жетімділіктің артықшылығынан басқа, олардың конформациялық тұрақтылығы бетінің регенерация жағдайларына төзімділіктің жоғарылауына әкеледі. Адамның простата-спецификалық антигені (hPSA) бір доменді антиденелерді сенсорлық беттерге иммобилизациялаудан кейін сыналды. Наноденелер клиникалық маңызды hPSA концентрациясын анықтауда классикалық антиденелерден асып түседі [34].
Нысаналы молекуланың кристалдану мүмкіндігін арттыру үшін наноденелерді кристалдану шаперондары ретінде пайдалануға болады. Қосымша нәруыздар ретінде олар конформациялық күйлердің тек бір бөлігін байланыстыру және тұрақтандыру арқылы конформациялық біртектілікті төмендете алады. Олар кристалдануға кедергі жасайтын беттерді кристалды байланыс түзетін аймақтарды кеңейту арқылы бүркемелеуі мүмкін [35] [29].
Қолданудың терапевтік мақсаттары
Бір доменді антиденелер бірнеше мақсатқа қарсы жаңа терапиялық құрал ретінде сыналды. А тұмауының H5N1 вирусын жұқтырған тышқандарда гемагглютининге қарсы нанободиялар тірі организмде H5N1 вирусының репликациясын басып, аурушаңдық пен өлімді төмендетеді. [36] Clostridium difficile токсині мен В токсинінің вируленттілік факторларының жасушалық рецепторлармен байланысатын аймағын бағыттайтын наноденелердің in vitro фибробласттардағы цитопатиялық әсерлерді бейтараптандыратындығы көрсетілген [37]. Антигентаныстырушы жасушаларды танитын наноденелер конъюгаттары ісіктерді анықтау үшін [38] немесе күшті иммундық жауап құру үшін антигенді бағытты жіберу үшін сәтті қолданылған [39].
Торайлардың ішек таяқшасының диареясына қарсы ауыз арқылы қолданылатын бір-домендік антиденелер жасалып, сәтті тексерілді. [11] Асқазан-ішек жолдарының басқа аурулары, мысалы ішектің қабынуы және ішектің қатерлі ісігі, сонымен қатар ауызға қолданатын бір доменді антиденелердің мүмкін нысандары болып табылады. [40]
Malassezia furfur беткей нәруызына бағытталған жуғыш заттың тұрақты түрлері қайызғаққа қарсы сусабындарда қолдану үшін жасалған. [7]
Фототермиялық терапия әдісі ретінде, HER2 антигенімен байланысатын, сүт безі мен аналық бездің қатерлі ісігі жасушаларында шамадан тыс әсер ететін наноденелер тармақталған алтын нанобөлшектермен біріктірілген (суретті қараңыз). Ісік жасушалары сынақ ортасында лазердің көмегімен фототермиялық жолмен жойылды [41].
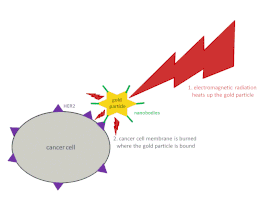 | Фототермиялық терапияға арналған наноденелер. HER2 сияқты ісік антигендерін байланыстыра алатын наноденелер жарық энергиясын сіңіретін және рак клеткаларын жою үшін жылу шығаратын алтынның тармақталған нанобөлшектерімен байланысады. |
Каплацизумаб, фон Виллебранд факторына бағытталған, бір доменді антидене, жедел коронарлық синдромы бар науқастарда тромбоздың алдын алу бойынша клиникалық зерттеулерден өтіп жатыр. [42] ALX-0081-дің жоғары қауіпті тері астылық коронарлық араласу кезіндегі қолданылуына арналған клиникалық зерттеудің II фазасы 2009 жылдың қыркүйегінде басталды [43].
Ablynx, олардың наноденелері гематоэнцефалды тосқауылынан өтіп, тұтас антиденелерге қарағанда үлкен қатты ісіктерге оңай еніп, ми ісіктеріне қарсы дәрі-дәрмектерді шығаруға мүмкіндік береді деп күтеді. [40]
Жақында бета-коронавирустардың (CoV-19 қоса алғанда) масақ протеинінің RBD доменімен тығыз байланысатын және оның ACE2 жасушалық рецепторымен өзара әрекеттесуін блоктайтын наноденелер анықталды [44].
Адамның әртүрлі патогенді коронавирустарымен (CoV) инфекцияның алдын алу және емдеу үшін әр түрлі бір доменді антиденелерді (наноденелерді) қолдану туралы бірнеше рет айтылды. Жақында SARS-CoV-2 және сол сияқтыларды байланыстыру және бейтараптандыру үшін наноденелерді қолданудың болашағы, тиімділігі және проблемалары атап өтілді [45].
Сілтемелер:
Harmsen MM, De Haard HJ (November 2007). "Properties, production, and applications of camelid single-domain antibody fragments". Applied Microbiology and Biotechnology. 77 (1): 13–22. doi:10.1007/s00253-007-1142-2. PMC 2039825. PMID 17704915.
^ English H, Hong J, Ho M (January 2020). "NAR single domain antibody sequences, phage libraries and potential clinical applications". Antibody Therapeutics. 3 (1): 1–9. doi:10.1093/abt/tbaa001. PMC 7034638. PMID 32118195.
^ Möller A, Pion E, Narayan V, Ball KL (December 2010). "Intracellular activation of interferon regulatory factor-1 by nanobodies to the multifunctional (Mf1) domain". The Journal of Biological Chemistry. 285 (49): 38348–61. doi:10.1074/jbc.M110.149476. PMC 2992268. PMID 20817723.
^ Ghannam A, Kumari S, Muyldermans S, Abbady AQ (March 2015). "Camelid nanobodies with high affinity for broad bean mottle virus: a possible promising tool to immunomodulate plant resistance against viruses". Plant Molecular Biology. 87 (4–5): 355–69. doi:10.1007/s11103-015-0282-5. PMID 25648551.
^ "Nanobodies herald a new era in cancer therapy". The Medical News. 12 May 2004.
^ "Pipeline". Ablynx. Retrieved 20 January 2010.
^ Jump up to:a b Dolk E, van der Vaart M, Lutje Hulsik D, Vriend G, de Haard H, Spinelli S, et al. (January 2005). "Isolation of llama antibody fragments for prevention of dandruff by phage display in shampoo". Applied and Environmental Microbiology. 71 (1): 442–50. doi:10.1128/AEM.71.1.442-450.2005. PMC 544197. PMID 15640220.
^ Jump up to:a b Stanfield RL, Dooley H, Flajnik MF, Wilson IA (September 2004). "Crystal structure of a shark single-domain antibody V region in complex with lysozyme". Science. 305 (5691): 1770–3. Bibcode:2004Sci...305.1770S. doi:10.1126/science.1101148. PMID 15319492.
^ van der Linden RH, Frenken LG, de Geus B, Harmsen MM, Ruuls RC, Stok W, et al. (April 1999). "Comparison of physical chemical properties of llama VHH antibody fragments and mouse monoclonal antibodies". Biochimica et Biophysica Acta (BBA) - Protein Structure and Molecular Enzymology. 1431 (1): 37–46. doi:10.1016/S0167-4838(99)00030-8. PMID 10209277.
^ Harmsen MM, van Solt CB, Hoogendoorn A, van Zijderveld FG, Niewold TA, van der Meulen J (November 2005). "Escherichia coli F4 fimbriae specific llama single-domain antibody fragments effectively inhibit bacterial adhesion in vitro but poorly protect against diarrhoea". Veterinary Microbiology. 111 (1–2): 89–98. doi:10.1016/j.vetmic.2005.09.005. PMID 16221532.
^ Jump up to:a b Harmsen MM, van Solt CB, van Zijderveld-van Bemmel AM, Niewold TA, van Zijderveld FG (September 2006). "Selection and optimization of proteolytically stable llama single-domain antibody fragments for oral immunotherapy". Applied Microbiology and Biotechnology. 72 (3): 544–51. doi:10.1007/s00253-005-0300-7. PMID 16450109.
^ Jump up to:a b c Ho M (June 2018). "Inaugural Editorial: Searching for Magic Bullets". Antibody Therapeutics. 1 (1): 1–5. doi:10.1093/abt/tby001. PMC 6086361. PMID 30101214.
^ Desmyter A, Transue TR, Ghahroudi MA, Thi MH, Poortmans F, Hamers R, et al. (September 1996). "Crystal structure of a camel single-domain VH antibody fragment in complex with lysozyme". Nature Structural Biology. 3 (9): 803–11. doi:10.1038/nsb0996-803. PMID 8784355.
^ Jump up to:a b Feng M, Bian H, Wu X, Fu T, Fu Y, Hong J, et al. (January 2019). "NAR single-domain antibody library from six naïve nurse sharks". Antibody Therapeutics. 2 (1): 1–11. doi:10.1093/abt/tby011. PMC 6312525. PMID 30627698.
^ Arbabi Ghahroudi M, Desmyter A, Wyns L, Hamers R, Muyldermans S (September 1997). "Selection and identification of single domain antibody fragments from camel heavy-chain antibodies". FEBS Letters. 414 (3): 521–6. doi:10.1016/S0014-5793(97)01062-4. PMID 9323027.
^ Ward ES, Güssow D, Griffiths AD, Jones PT, Winter G (October 1989). "Binding activities of a repertoire of single immunoglobulin variable domains secreted from Escherichia coli". Nature. 341 (6242): 544–6. Bibcode:1989Natur.341..544W. doi:10.1038/341544a0. PMID 2677748.
^ Feng R, Wang R, Hong J, Dower CM, Croix BS, Ho M (January 2020). "Isolation of rabbit single domain antibodies to B7-H3 via protein immunization and phage display". Antibody Therapeutics. 3 (1): 10–17. doi:10.1093/abt/tbaa002. PMC 7052794. PMID 32166218.
^ Holt LJ, Herring C, Jespers LS, Woolven BP, Tomlinson IM (November 2003). "Domain antibodies: proteins for therapy". Trends in Biotechnology. 21 (11): 484–90. doi:10.1016/j.tibtech.2003.08.007. PMID 14573361.
^ Borrebaeck CA, Ohlin M (December 2002). "Antibody evolution beyond Nature". Nature Biotechnology. 20 (12): 1189–90. doi:10.1038/nbt1202-1189. PMID 12454662.
^ Tang Z, Feng M, Gao W, Phung Y, Chen W, Chaudhary A, et al. (April 2013). "A human single-domain antibody elicits potent antitumor activity by targeting an epitope in mesothelin close to the cancer cell surface". Molecular Cancer Therapeutics. 12 (4): 416–26. doi:10.1158/1535-7163.MCT-12-0731. PMC 3624043. PMID 23371858.
^ Jump up to:a b Li N, Fu H, Hewitt SM, Dimitrov DS, Ho M (August 2017). "Therapeutically targeting glypican-2 via single-domain antibody-based chimeric antigen receptors and immunotoxins in neuroblastoma". Proceedings of the National Academy of Sciences of the United States of America. 114 (32): E6623–E6631. doi:10.1073/pnas.1706055114. PMC 5559039. PMID 28739923.
^ Feng M, Gao W, Wang R, Chen W, Man YG, Figg WD, et al. (March 2013). "Therapeutically targeting glypican-3 via a conformation-specific single-domain antibody in hepatocellular carcinoma". Proceedings of the National Academy of Sciences of the United States of America. 110 (12): E1083-91. Bibcode:2013PNAS..110E1083F. doi:10.1073/pnas.1217868110. PMC 3607002. PMID 23471984
Gao W, Tang Z, Zhang YF, Feng M, Qian M, Dimitrov DS, Ho M (March 2015). "Immunotoxin targeting glypican-3 regresses liver cancer via dual inhibition of Wnt signalling and protein synthesis". Nature Communications. 6: 6536. Bibcode:2015NatCo...6.6536G. doi:10.1038/ncomms7536. PMC 4357278. PMID 25758784.
^ Chen W, Zhu Z, Feng Y, Xiao X, Dimitrov DS (October 2008). "Construction of a large phage-displayed human antibody domain library with a scaffold based on a newly identified highly soluble, stable heavy chain variable domain". Journal of Molecular Biology. 382 (3): 779–89. doi:10.1016/j.jmb.2008.07.054. PMC 2551765. PMID 18687338.
^ Wang C, Gao W, Feng M, Pastan I, Ho M (May 2017). "Construction of an immunotoxin, HN3-mPE24, targeting glypican-3 for liver cancer therapy". Oncotarget. 8 (20): 32450–32460. doi:10.18632/oncotarget.10592. PMC 5464801. PMID 27419635.
^ Fleming BD, Urban DJ, Hall M, Longerich T, Greten T, Pastan I, Ho M (September 2019). "The engineered anti-GPC3 immunotoxin, HN3-ABD-T20, produces regression in mouse liver cancer xenografts via prolonged serum retention". Hepatology. 71 (5): 1696–1711. doi:10.1002/hep.30949. PMC 7069773. PMID 31520528.
^ Li N, Wei L, Liu X, Bai H, Ye Y, Li D, et al. (October 2019). "A Frizzled-Like Cysteine-Rich Domain in Glypican-3 Mediates Wnt Binding and Regulates Hepatocellular Carcinoma Tumor Growth in Mice". Hepatology. 70 (4): 1231–1245. doi:10.1002/hep.30646. PMC 6783318. PMID 30963603.
^ Muyldermans S (2013). "Nanobodies: natural single-domain antibodies". Annual Review of Biochemistry. 82: 775–97. doi:10.1146/annurev-biochem-063011-092449. PMID 23495938.
^ Jump up to:a b Gulati S, Jin H, Masuho I, Orban T, Cai Y, Pardon E, et al. (May 2018). "Targeting G protein-coupled receptor signaling at the G protein level with a selective nanobody inhibitor". Nature Communications. 9 (1): 1996. Bibcode:2018NatCo...9.1996G. doi:10.1038/s41467-018-04432-0. PMC 5959942. PMID 29777099.
^ Rothbauer U, Zolghadr K, Tillib S, Nowak D, Schermelleh L, Gahl A, et al. (November 2006). "Targeting and tracing antigens in live cells with fluorescent nanobodies". Nature Methods. 3 (11): 887–9. doi:10.1038/nmeth953. PMID 17060912.
^ Rothbauer U, Zolghadr K, Muyldermans S, Schepers A, Cardoso MC, Leonhardt H (February 2008). "A versatile nanotrap for biochemical and functional studies with fluorescent fusion proteins". Molecular & Cellular Proteomics. 7 (2): 282–9. doi:10.1074/mcp.M700342-MCP200. PMID 17951627.
^ Ries J, Kaplan C, Platonova E, Eghlidi H, Ewers H (June 2012). "A simple, versatile method for GFP-based super-resolution microscopy via nanobodies". Nature Methods. 9(6): 582–4. doi:10.1038/nmeth.1991. PMID 22543348.
^ Fang T, Lu X, Berger D, Gmeiner C, Cho J, Schalek R, et al. (December 2018). "Nanobody immunostaining for correlated light and electron microscopy with preservation of ultrastructure". Nature Methods. 15 (12): 1029–1032. doi:10.1038/s41592-018-0177-x. PMC 6405223. PMID 30397326.
^ Saerens D, Frederix F, Reekmans G, Conrath K, Jans K, Brys L, et al. (December 2005). "Engineering camel single-domain antibodies and immobilization chemistry for human prostate-specific antigen sensing". Analytical Chemistry. 77 (23): 7547–55. doi:10.1021/ac051092j. PMID 16316161.
^ Koide S (August 2009). "Engineering of recombinant crystallization chaperones". Current Opinion in Structural Biology. 19 (4): 449–57. doi:10.1016/j.sbi.2009.04.008. PMC 2736338. PMID 19477632.
^ Ibañez LI, De Filette M, Hultberg A, Verrips T, Temperton N, Weiss RA, et al. (April 2011). "Nanobodies with in vitro neutralizing activity protect mice against H5N1 influenza virus infection". The Journal of Infectious Diseases. 203 (8): 1063–72. doi:10.1093/infdis/jiq168. PMID 21450996.
^ Hussack G, Arbabi-Ghahroudi M, van Faassen H, Songer JG, Ng KK, MacKenzie R, Tanha J (March 2011). "Neutralization of Clostridium difficile toxin A with single-domain antibodies targeting the cell receptor binding domain". The Journal of Biological Chemistry. 286 (11): 8961–76. doi:10.1074/jbc.M110.198754. PMC 3058971. PMID 21216961.
^ Fang T, Duarte JN, Ling J, Li Z, Guzman JS, Ploegh HL (February 2016). "Structurally Defined αMHC-II Nanobody-Drug Conjugates: A Therapeutic and Imaging System for B-Cell Lymphoma". Angewandte Chemie. 55 (7): 2416–20. doi:10.1002/anie.201509432. PMC 4820396. PMID 26840214.
^ Fang T, Van Elssen CH, Duarte JN, Guzman JS, Chahal JS, Ling J, Ploegh HL (August 2017). "Targeted antigen delivery by an anti-class II MHC VHH elicits focused αMUC1(Tn) immunity". Chemical Science. 8 (8): 5591–5597. doi:10.1039/c7sc00446j. PMC 5618788. PMID 28970938.
^ Jump up to:a b "Nanobodies". Nanobody.org. 2006.
^ Van de Broek B, Devoogdt N, D'Hollander A, Gijs HL, Jans K, Lagae L, et al. (June 2011). "Specific cell targeting with nanobody conjugated branched gold nanoparticles for photothermal therapy". ACS Nano. 5 (6): 4319–28. doi:10.1021/nn1023363. PMID 21609027.
^ "Ablynx Announces Interim Results of First Nanobody Phase I Study of,ALX-0081 (ANTI-VWF)". Bio-Medicine.org. 2 July 2007.
^ Clinical trial number NCT01020383 for "Comparative Study of ALX-0081 Versus GPIIb/IIIa Inhibitor in High Risk Percutaneous Coronary Intervention (PCI) Patients" at ClinicalTrials.gov
^ Wrapp, McLellan. "Structural Basis for Potent Neutralization of Betacoronaviruses by Single-Domain Camelid Antibodies". Cell. doi:10.1016/j.cell.2020.04.031.
^ Konwarh, Rocktotpal (23 June 2020). "Nanobodies: Prospects of Expanding the Gamut of Neutralizing Antibodies Against the Novel Coronavirus, SARS-CoV-2". Frontiers in Immunology. doi:10.3389/fimmu.2020.01531.
