КР по токсикологической химии. ТОкса ПГФА 17.01.23. Блок i организационнопрововые основы судебномедицинской деятельности в рф. Порядок и проведение судебно медицинских и химикотоксикологических исследований
 Скачать 1.3 Mb. Скачать 1.3 Mb.
|
1 2 20. При минерализации 100 г печени получен минерализат объемом 200 мл. Качественный анализ минерализата дробным методом показал наличие катионов свинца. Рассчитать количественное содержание катионов свинца (г) в биологическом объекте (100 г), если к 50 мл минерализата прибавили 5 мл 0,01 M трилона Б и оттитровали его избыток 0,01 М раствором цинка хлорида. На титрование затрачено 4,40 мл 0,01 М раствора цинка хлорида (индикатор - эриохром черный Т). Т Pb2+/ ZnCl2 = 0,002072 г/мл. Комплексонометрия (трилонометрия). Вариант обратного титрования. Индикатор– эриохром черный, титруют до фиолетового окрашивания Среда – щелочная, создаваемая аммиачным буферным раствором. Определение основано на растворении определяемых веществ в избытке титрованного раствора трилона Б, остаток которого оттитровывают вторым титрантом – цинка хлоридом 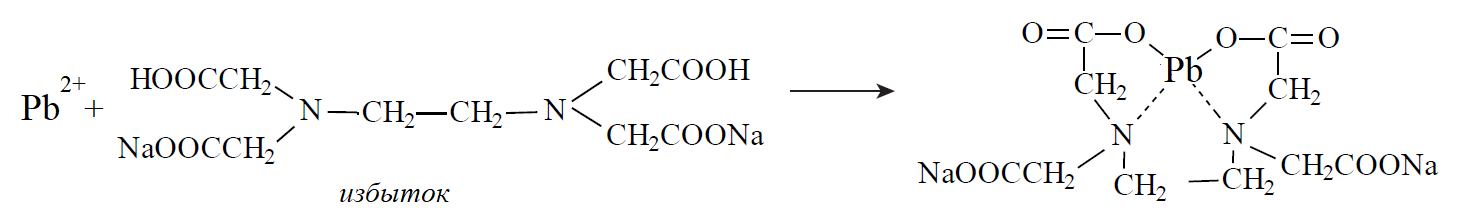 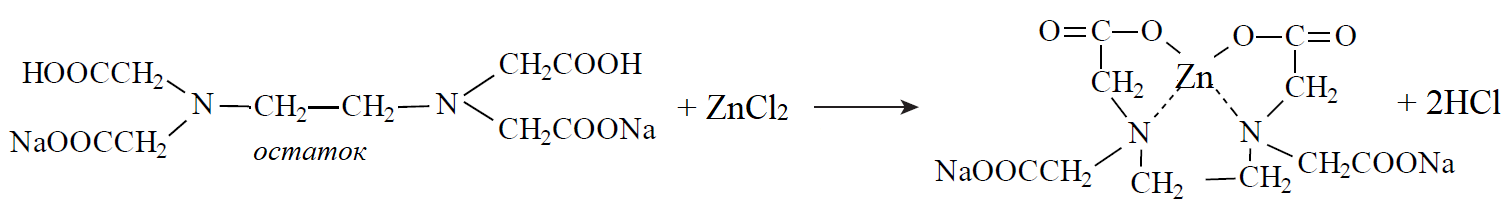 Принцип индикации при обратном титровании: титруют от окраски свободного индикатора до окраски комплексного соединения индикатора с металлом титранта [ZnCl2]. Определяемый ион металла не участвует в индикации, т.к. он прочно связан трилоном Б. Кстех = 1:1 = 1 Т = 0,002072 г/мл Расчет количественного содержания находят по формуле: Хг = Т × (V1 – V2) × Vмк × Р а × Vаликв Хг = 0,002072 × (5,0 – 4,40) × 200 × 100,0 = 0,004973 г = 4,973 мг 100,0 × 50 мл Заключение. Обнаружены ионы свинца в концентрации 4,973 мг/100 г. Тема: «Лекарственные яды» 25. При экстракции 10 мл плазмы крови хлороформом при рН 10-11 получено извлечение объемом 5 мл. Качественный анализ показал наличие кокаина. 2 мл хлороформного извлечения упарили до сухого остатка и растворили в 5 мл 0,1 М кислоты хлористоводородной. Оптическая плотность полученного раствора при аналитической длине волны 233 нм составила 0,131. Оптическая плотность стандартного раствора вещества с концентрацией 0,001% составила 0,430. Рассчитайте концентрацию кокаина в плазме крови (мкг/мл). РЕШЕНИЕ. Стандартный раствор 10 мл 0,001% (0,0001 г в 10 мл) Расчет ведут по стандартному раствору: Хг = 0,131× 0,0001 × 5 мл × 5 мл = 0,000076 г/ 10 мл = 76 мкг/10 мл 0,430 × 10 мл Заключение. Обнаружен кокаин в количестве 76мкг/10 мл БЛОК VII ХТА группы токсикологически важных веществ, изолируемых неполярными растворителями («Пестициды») 8. Пестициды из группы галогенпроизводных (группа ДДТ): общая характеристика, токсичность, методы обнаружения и количественного определения. Группа ДДТ (инсектициды) 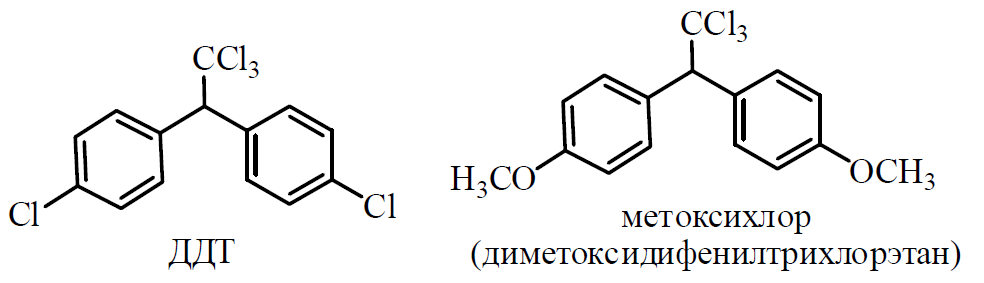 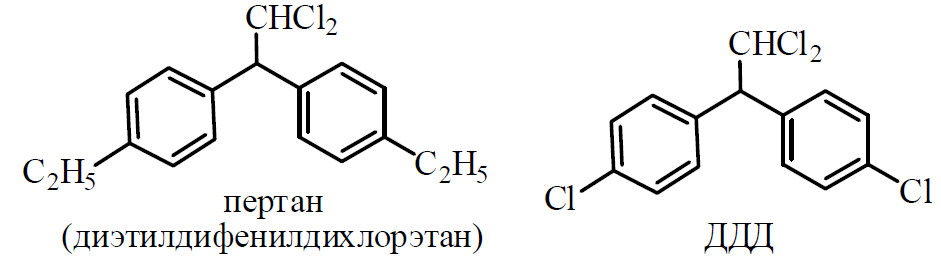 Поражающее действие ХОС связано с параличом нервной системы. Высоколипофильные ХОС нарушают структуру мембран нервных клеток и препятствуют прохождению нервных импульсов. В настоящее время использование ХОС как инсектицидов в сельском хозяйстве запрещено практически во всех странах. Класс средней токсичности (300 – 500 мг/кг). ДДТ обладает сильным инсектицидным действием и незначительной токсичностью по отношению к теплокровным животным. Однако применение этих веществ в большинстве стран было запрещено в связи с их способностью накапливаться в жировых тканях человека и животных, давать высокую остаточную токсичность и медленно разрушаться в окружающей среде. Методы обнаружения. 1. Реакция Витали – Морена – фиолетовое окрашивание. 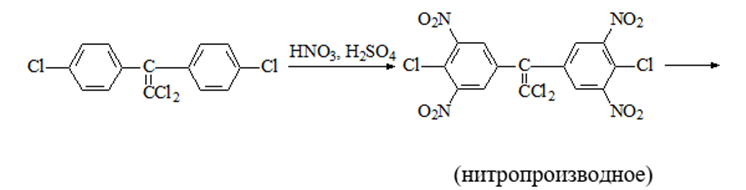 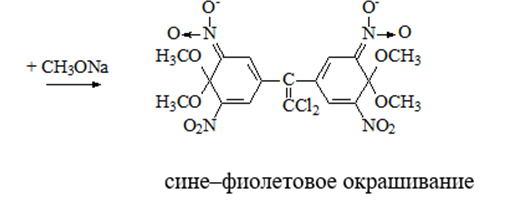 2. Дехлорирование, с последующим определением продуктов реакции На исследуемое вещество действуют спиртовым раствором щелочи, либо раствором алкоголята натрия. В зависимости от характера реагента от молекулы отщепляется различное количество атомов хлора: 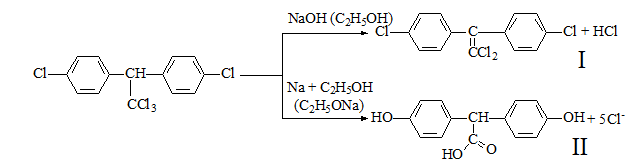 I – 2,2–бис(n–хлорфенил)1,1 – дихлорэтилен II – дигидроксидифенилуксусная кислота. После дехлорирования проводят реакции на хлорид–ион и ароматические соединения. Обнаружение иона хлора – образуется осадок белого цвета: Cl- + Ag+ AgCl Количественное определение. 1.Ранее применялось аргентометрическое титрование по хлорид – иону поле отщепления. Объем титранта и эквивалент вещества связаны с количеством отщепленного атомов хлора, которое зависит от способа дегалогенирования. 1.Метод Фольгарда – обратное титрование Титрование проводят в азотнокислой среде (pH<2). Метод заключается в осаждении галогенидов избытком раствора серебра нитрата, избыток последнего определяют титрованием раствором аммония роданида (тиоцианата) в присутствии индикатора железоаммонийных квасцов до появления красной окраски, свойственной железа (III) роданиду. 2Cl- + 2AgNO3 → 2AgCl ↓ + 2NO3- AgNO3 + NH4SCN → AgSCN↓ + NH4NO3 Fe (NH4)(SO4)2 + 3NH4CNS → Fe(CNS)3 + 2(NH4)2SO4 Э = М.м. 2.СФМ в видимой области проводится по окрашенному продукту, полученное в результате реакции Витали – Морена. Проводят сравнение оптических плотностей стандартного и анализируемого окрашенных растворов. Из частей анализируемого и стандартного растворов приготавливают окрашенные растворы и измеряют величину их оптической плотности при одной и той же толщине слоя (в тех же кюветах). C1 = А1 × C2 А2 где А1 — оптическая плотность окрашенного анализируемого раствора; А2 — оптическая плотность окрашенного стандартного раствора; С2— концентрация стандартного раствора. 3.Тонксослойная хроматография (ТСХ). Количественное определение осуществляют сравнением площадей пятен пробы и стандартных растворов. Между количеством препарата в пробе, не превышающим 20 мкг, и площадью его пятна существует прямая пропорциональная зависимость. При большом содержании препарата следует использовать пропорциональную часть исследуемого экстракта. Количество препарата в пробе (Х, мг/кг или мг/л) вычисляют по формуле: 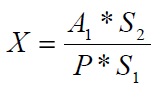 где A1 – содержание препарата в стандартном растворе, (мкг); S1 – площадь пятна стандартного раствора, (мм2); S2 – площадь пятна пробы, (мм2); Р – масса или объем исследуемой пробы, (г или мл). БЛОК VIII Ситуационные задания по судебно-химическому и химико-токсикологическому анализу веществ, имеющих токсикологическое значение 1. Гражданин Д., рабочий химического завода, в состоянии опьянения на работе выпил неизвестную жидкость. Сразу почувствовал резкую боль в желудке, началась рвота белыми хлопьевидными массами. При доставке в больницу скончался. На основании клинических данных и характерных признаков (моча оливкового цвета, запах фенола изо рта) поставлен диагноз – острое отравление фенолом на фоне алкогольного опьянения. Обосновать выбор биологического объекта, привести ход химико-токсикологического анализа. Химико-токсикологическое исследование печени трупа на фенол  Фенол (карболовая кислота) представляет собой тонкие длинные игольчатые кристаллы или бесцветную кристаллическую массу со своеобразным запахом. На воздухе он постепенно розовеет. Фенол обладает кислотными свойствами. Перечь объектов исследования. Приказ Минздравсоцразвития РФ от 12.05.2010 № 346н: остатки жидкости в стакане, емкости, флаконах, найденных на месте происшествия; кровь, моча; желудок с содержимым; головной мозг, легкое; печень, селезенка Изолирование – методом дистилляции. Процесс. Объект массой 100,0 г тщательно измельчают, смешивают с водой до состояния густой кашицы, помещают в круглодонную колбу таким образом, чтобы она заполнилась не более чем на 1/3 объема, подкисляют щавелевой или виннокаменной кислотой до рН 2 – 3 и подвергают перегонке. Подкисление объекта слабой органической кислотой проводят с целью перевода веществ кислотного характера (цианиды калия, натрия, феноляты, салицилаты) в свободные кислоты. Собирают два дистиллята. Первый в количестве 1 – 3 мл собирают в приемник с 5% раствором гидроксида натрия для улавливания летучей синильной кислоты. 2 – ю порцию дистиллята отгоняют в объеме 25 – 50 мл. Вещества кислотного и нейтрального характера перегоняются из кислых растворов в такой последовательности: синильная кислота, диэтиловый эфир, хлороформ, ацетон, спирты алифатического ряда, нитробензол, муравьиная кислота, хлоралгидрат, формальдегид, сероуглерод, салициловая кислота и другие. Во втором дистилляте обычно содержатся вещества средней летучести. Для обнаружения фенола используется часть второго дистиллята, который подвергают пробоподготовке, так как проведению реакций на фенол мешают карбоновые кислоты и этанол. Содержащиеся в дистилляте летучие кислоты нейтрализуют гидрокарбонатом натрия (фенол не реагирует с гидрокарбонатом) и экстрагируют фенол эфиром. Эфир выпаривают при комнатной температуре (это повышает концентрацию фенола в остатке, вместе с эфиром улетучиваются одноатомные спирты, которые мешают проведению реакций на фенол). Внешний вид дистиллята: остаток имеет вид маслянистых капель с резким характерным запахом фенола. Остаток растворяют в 2 – 3 мл воды и с полученным раствором проводят реакции на фенол. Химические реакции обнаружения фенола. 1.Реакция с бромной водой. От прибавления бромной воды выпадает осадок трибромфенола: 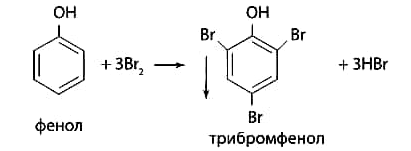 Такой же осадок дает и салициловая кислота. Однако при подщелачивании дистиллята гидрокарбонатом натрия салициловая кислота дает соль, которая не экстрагируется эфиром. Реакция высоко чувствительна, но не специфична. В токсикологической химии этой реакции придается значение при ее отрицательном результате для доказательства отсутствия фенола. 2.Реакция с хлоридом железа (III). Фенол с раствором хлорида железа (III) дает соединение, имеющее сине – фиолетовую окраску: 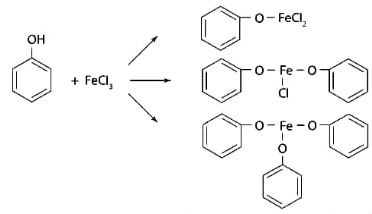 Реакция менее чувствительна, чем реакция с бромной водой. Это дает ей возможность придать положительное значение, поскольку количество фенола, образующегося в трупном материале за счет гнилостных процессов, не достигает концентрации реакции (1:1000). 3.Индофеноловая реакция. В качестве окислителей используют гипохлорит натрия, хлорную или бромную воду, пероксид водорода и др. Появление грязно-фиолетовой окраски указывает на наличие фенола в пробе.  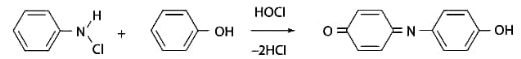 Реакция является подтверждающей. 4.Реакция с реактивом Миллона. Фенол с реактивом Миллона (смесь нитратов одно – и двухвалентной ртути, содержащая азотистую кислоту) дает соединение красного цвета: 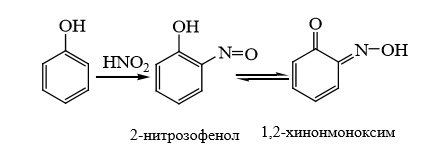 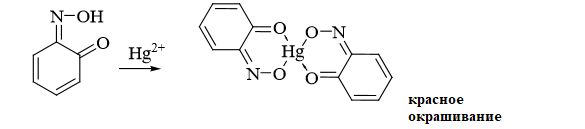 Реакция является подтверждающей. 5.Реакция Либермана. Азотистая кислота, образующаяся при взаимодействии нитрита натрия и серной кислоты, с фенолом образует n – нитрозофенол, который изомеризуется до n – хиноидоксима. n – хиноидоксим с избытком фенола дает индофенол (синяя окраска появляется после добавления гидроксида натрия к охлажденной смеси): 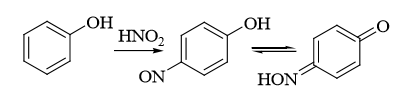 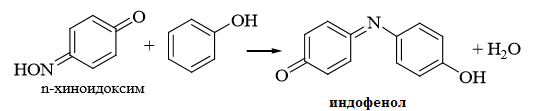 Реакция является подтверждающей. Количественное определение 1.Броматометрическое титрование после пробоподготовки. Метод используется при определении в дистиллятах малых количеств фенола. После изолирования перегонкой с водяным паром дистиллят подщелачиваем натрия гидрокарбонатом и экстрагируем эфиром. Эфир испаряем, остаток растворяем в воде очищенной и к жидкости добавляем бромид калия, титрованный раствор калия бромата и кислоту хлористоводородную. Для определения избытка брома добавляем калия йодид и выделившийся йод оттитровываем раствором натрия тиосульфата. В качестве индикатора используем крахмал: KBrO3 + 5KBr + 3H2SO4 → 3Br2 + 3K2SO4 + 3H2O 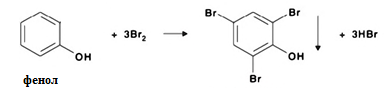 Br2 + 2KI → I2 + KB I2 + 2Na2S2O3 → 2NaI + Na2S4O6 Содержание летучих с паром фенолов в пересчете на фенол (Х) в мг/л вычисляем по формуле: Х = (b – a) · K· 0,784 · 500 · 1000 (V · V1) где b – объем раствора тиосульфата натрия, израсходованного при втором титровании, мл, a – объем раствора тиосульфата натрия, израсходованного на титрование пробы, мл, К – поправочный коэффициент для приведения концентрации раствора тиосульфата натрия к точно 0,05 н, V – объем дистиллята, взятой для анализа, мл; V1 – объем аликвотной части фильтрата или дистиллята, взятого для бромирования и титрования, мл, 0,784 – количество фенола, эквивалентное 1 мл 0,05 н раствора тиосульфата натрия, мг. 2.Метод газожидкостной хроматографии Определение проводят на 2 или 4 хроматографических колонках; на хроматограмме появляется пик, время удерживания или объем которого должен совпасть с параметрами удерживания фенола – стандарта. Время удерживания на колонке характерно для каждого из разделяемых веществ, поэтому служит качественной характеристикой вещества. Исправленное время удерживания рассчитывается как разность абсолютного времени удерживания вещества и времени удерживания несорбируемого компонента: t испр = t абс – t н.к. Удерживаемый объем также является качественной характеристикой анализируемого вещества. Удерживаемый объем V – это объем газа-носителя, необходимый для вымывания всего количества вещества из колонки, который численно равен произведению скорости газа – носителя U на время удерживания t: V = U · t Скорость газа измеряется в мл/мин, время удерживания – в минутах. При получении соответствующего пика наличие фенола в исследуемом объекте подтверждают химическими методами. Количество фенола, извлеченного из биологического материала прямо пропорционально высоте или площади пика. Для расчета количества фенола в исследуемом объекте используют метод внутреннего стандарта, в качестве которого рекомендован н – пропанол. К каждому из стандартных растворов, предназначенных для построения графика, а также к анализируемой пробе добавляют определенное количество н – пропанола (внутренний стандарт) и хроматографируют. Рассчитывают отношение площадей Sх или высот hx пиков исследуемого вещества к Sст(hст). Строят калибровочный график зависимости Sx /Sст (hx/hст) от концентрации исследуемого вещества. Для расчета концентрации фенола в исследуемой пробе используют калибровочный коэффициент, который является постоянным для данной пары веществ на колонке и зависит от летучести определяемых веществ в условиях опыта. Калибровочный коэффициент рассчитывают по формуле: 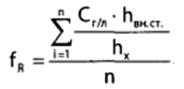 Где Сг/л – концентрация фенола, %; hвн.ст. – высота пика внутреннего стандарта (н – пропанола); hх – высота пика фенола; n – число измерений (не менее трех). Калибровочный коэффициент вводят в формулу расчета концентрации ацетона в исследуемом образце: 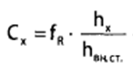 Где Сх – концентрация фенола в пробе %; hх – высота пика фенола; hвн.ст. – высота пика внутреннего стандарта (н – пропанола). Токсикологическое значение. Используется в химической промышленности для получения красителей, пластмасс, лекарственных средств. В медицине применяется как дезинфицирующее средство. В организм поступает через слизистые оболочки, кожу. При приеме внутрь 8-15 г фенола наступает смерть. Наибольшее количество фенола обнаруживается в почках, печени, сердце, крови, головном мозгу. Метаболизм. I фаза метаболизма. Часть подвергается окислению с образованием хинона, гидрохинона и хингидрона, который окрашивает мочу: 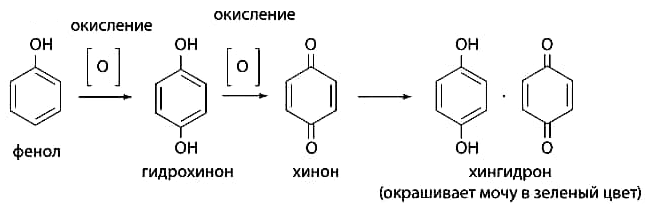 II фаза метаболизма. Реакции конъюгации. Конъюгация с серной кислотой: 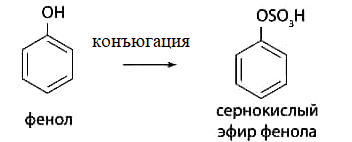 Конъюгация с глюкуроновой кислотой: 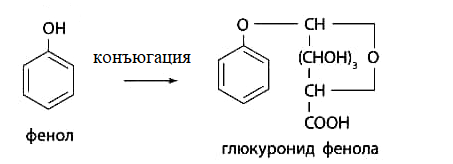 Л И Т Е Р А Т У Р А 1.Вергейчик Т.Х. Токсикологическая химия – М .: МЕДпресс-информ, 2016 - 400 с. 2.Плетнева Т.В. Токсикологическая химия: учебник для вузов / под ред. Т.В. Плетеневой. – М.: ГЭОТАР-Медиа, 2013 г – 512с. 3.Федосеева, Л. М. Токсикологическая химия: учеб.-метод. пособие для студ. к практ. занятиям / Л. М. Федосеева, Л. Е. Кудрикова, Н, Н. Кнауб.-Барнаул: АГМУ, 2007.-108с., учебная 4.Береговых Г.В.Химико-токсикологический анализ соединений металлов (Металлические яды)/ Учебно-методическое пособие для студентов 4 курса дневного и 5 курса заочного отделений фармацевтического факультет. Кемерово 2014 г 139 с 5. Лекционный материал 6. Кутяков В.А. Токсикологическая химия: учебное пособие в 2-х частях. Для студентов 4 и 5 курсов, обучающихся по специальности 060108 «Фармация». Ч. 2. – Красноярск, Изд. Изд. КрасГМУ, 2010. – 166 с. 1 2 |
