КР по токсикологической химии. ТОкса ПГФА 17.01.23. Блок i организационнопрововые основы судебномедицинской деятельности в рф. Порядок и проведение судебно медицинских и химикотоксикологических исследований
 Скачать 1.3 Mb. Скачать 1.3 Mb.
|
1 2 БЛОК I Организационно-прововые основы судебно-медицинской деятельности в РФ. Порядок и проведение судебно – медицинских и химико-токсикологических исследований. 17. Порядок приема и регистрации материалов экспертизы. Обязанности эксперта. Приказ Минздравсоцразвития РФ от 12.05.2010 N 346-н «Об утверждении порядка организации и производства судебно-медицинских экспертиз в государственных судебно-экспертных учреждениях Российской Федерации». 1. Постановление или определение о назначении экспертизы и прилагаемые к ним объекты исследования и материалы, необходимые для проведения экспертизы и выдачи заключения эксперта, принимаются непосредственно руководителем ГСЭУ либо специально назначенным им сотрудником. Сведения о поступивших в ГСЭУ постановлениях и определениях о назначении экспертиз и прилагаемых к ним объектах исследования и материалах в обязательном порядке регистрируются в специальном журнале ГСЭУ. 2. Объектами экспертизы являются трупы и их части, живые лица, вещественные доказательства, образцы для сравнительного исследования, материалы уголовных, гражданских и арбитражных дел, а также дел об административных правонарушениях; документы, в том числе медицинские, представленные органом или лицом, назначившим экспертизу, и содержащие сведения, необходимые для производства экспертизы. 3. Прилагаемые к постановлению или определению о назначении экспертизы объекты исследования, в том числе, материалы дела, принимаются в упакованном и опечатанном виде. Упаковка должна содержать соответствующие пояснительные надписи и исключать возможность несанкционированного доступа к содержимому без ее повреждения. 4. Вскрывать упаковку с поступившими в ГСЭУ объектами имеет право только эксперт, которому поручено производство экспертизы. В случае, когда постановление или определение о назначении экспертизы было упаковано вместе с объектами исследования и материалами дела, вскрытие упаковки может быть произведено самим руководителем ГСЭУ либо специально назначенным им сотрудником 5. Сведения об отсутствии упаковки объектов исследования и материалов дела, а также о наличии ее повреждений указывают в реестре или почтовом уведомлении, в акте вскрытия упаковки, подписываемом экспертом и руководителем ГСЭУ, а также в заключении эксперта. 6. Доставка объектов и материалов осуществляется органом или лицом, назначившим экспертизу, в соответствующие структурные подразделения ГСЭУ: в подразделение судебно-медицинской экспертизы трупов (судебно-медицинский морг, морг медицинского учреждения, подведомственного органу исполнительной власти субъекта Российской Федерации в сфере здравоохранения) - трупы и их части, документы, в том числе медицинские; в подразделение экспертизы живых лиц - живые люди, документы, в том числе медицинские; в подразделение экспертизы вещественных доказательств - вещественные доказательства (в том числе, биологического происхождения), образцы для сравнительного исследования; документы, в том числе медицинские; в подразделение сложных экспертиз - материалы уголовных, гражданских и арбитражных дел, а также дел об административных правонарушениях; документы, в том числе медицинские; в иные экспертные подразделения, в которых производятся соответствующие лабораторные и инструментальные экспертные исследования - объекты от трупов и живых людей, образцы для сравнительного исследования; документы, в том числе медицинские. 7. В случае если транспортировка объектов исследования в ГСЭУ невозможна, орган или лицо, назначившее экспертизу, обеспечивает эксперту беспрепятственный доступ к объектам непосредственно на месте и возможность их максимально полноценного исследования. 8. Орган или лицо, назначившее экспертизу, дополнительно представляет образцы для сравнительного исследования, а также документы, содержащие сведения, относящиеся к предмету экспертизы (протоколы осмотров, допросов и иных процессуальных действий, справки, выписки, схемы мест происшествия, фотоснимки, электронные носители и т.п.). Если получение образцов для сравнительного исследования является частью экспертизы, то данная процедура проводится экспертом. В этом случае сведения о получении образцов эксперт отражает в своем экспертном заключении. Эксперт обязан: – принять к производству порученную ему руководителем соответствующего государственного судебно-экспертного учреждения судебную экспертизу; – провести полное исследование представленных ему объектов и материалов дела, дать обоснованное и объективное заключение по поставленным перед ним вопросам; – составить мотивированное письменное сообщение о невозможности дать заключение и направить данное сообщение в орган или лицу, которые назначили судебную экспертизу, если поставленные вопросы выходят за пределы специальных знаний эксперта, объекты исследований и материалы дела непригодны или недостаточны для проведения исследований и дачи заключения и эксперту отказано в их дополнении, современный уровень развития науки не позволяет ответить на поставленные вопросы; – не разглашать сведения, которые стали ему известны в связи с производством судебной экспертизы, в том числе сведения, которые могут ограничить конституционные права граждан, а также сведения, составляющие государственную, коммерческую или иную охраняемую законом тайну; – обеспечить сохранность представленных объектов исследований и материалов дела. Эксперт также исполняет обязанности, предусмотренные соответствующим процессуальным законодательством. Процессуальное законодательство (ст.16 ФЗ ОГСЭД РФ и ст.57 УПК РФ) 24. Порядок организации контроля и учета производства экспертиз. Приказ МЗ РФ от 12.05.2010 № 346-н «Об утверждении порядка организации и производства судебно-медицинских экспертиз в государственных судебно-экспертных учреждениях РФ» (часть ХI). Контроль производства экспертиз осуществляет руководитель ГСЭУ, который обязан: – создавать необходимые условия для производства экспертиз, сохранности представленных объектов и материалов дела, соблюдения правил противопожарной и техники безопасности, санитарно-гигиенических правил и норм – контролировать сроки и качество выполнения экспертиз, не нарушая принцип независимости эксперта – организовывать взаимодействие сотрудников ГСЭУ со специалистами экспертных, образовательных, медицинских и научных организаций – организовывать выборочное письменное рецензирование заключений экспертов При выявлении нарушений экспертом требований действующего законодательства по производству экспертиз, медицинских технологий и методик их производства, а также при наличии иных оснований, вызывающих сомнения в обоснованности выводов конкретной экспертизы, руководитель ГСЭУ вправе письменно проинформировать об этом в процессуально установленном порядке орган или лицо, назначившее экспертизу. Учет производства экспертиз и иных форм экспертной деятельности осуществляется в журналах учета материалов, поступивших на экспертизу или исследование. Листы журналов нумеруют, прошнуровывают, опечатывают печатью ГСЭУ и скрепляют подписью лица, ответственного за делопроизводство в ГСЭУ. Журналы именуют в соответствии с наименованиями структурных подразделений ГСЭУ. Также ведут общий журнал регистрации поступивших в ГСЭУ постановлений и определений о назначении экспертиз, материалов и объектов исследования, а также вызовов экспертов для участия в иных процессуальных действиях. Внесение сведений в журналы учета материалов, поступивших на экспертизу, осуществляет сотрудник ГСЭУ, назначенный его руководителем соответствующим приказом. Ответственность за своевременность, полноту и достоверность внесения сведений в журнал несет лицо, осуществляющее регистрацию материалов конкретной экспертизы. При регистрации в журнале материалов комиссионных и комплексных экспертиз каждый вид исследования, заканчивающийся составлением отдельного заключения эксперта, регистрируется с присвоением своего учетного номера. При этом в итоговом заключении эксперта указывают отдельно присвоенный учетный номер для всей экспертизы в целом. Руководитель ГСЭУ обязан регулярно контролировать правильность ведения журналов, своевременность, полноту и достоверность регистрации предусмотренных сведений. Результаты проверки вносятся непосредственно в журнал после последней регистрационной записи с указанием соответствующей даты. Хранение материалов, образуемых в ГСЭУ в результате производства экспертиз, организуют в номенклатурном деле. В дело комплектно подшивают постановление или определение о назначении экспертизы, копию сопроводительного письма руководителя ГСЭУ к экспертному документу, второй экземпляр заключения эксперта (включая все приложения), материалы о заявленных ГСЭУ письменных ходатайствах в связи с производством экспертизы и результатах их разрешения, иные документы, образовавшиеся в результате производства экспертизы. Срок хранения журналов и номенклатурных дел с материалами экспертиз составляет двадцать пять ле БЛОК II Токсикокинетика и метаболизм токсикантов в организме. 1. Отразите основные пути метаболизма барбитала. Поясните стадии метаболизма. Метаболизм барбитуратов протекает преимущественно в печени Барбитал (веронал, 5,5-диэтилбарбитуровая кислота) Большая часть барбитала (примерно 70–90 %) выводится из организма с мочой в неизмененном виде. Незначительная часть дозы этого вещества выделяется в виде метаболитов: 5-этил-5-β-оксиэтил-барбитуровая кислота (a), ее глюкуронид (b), 5-этил-барбитуровая кислота (c). 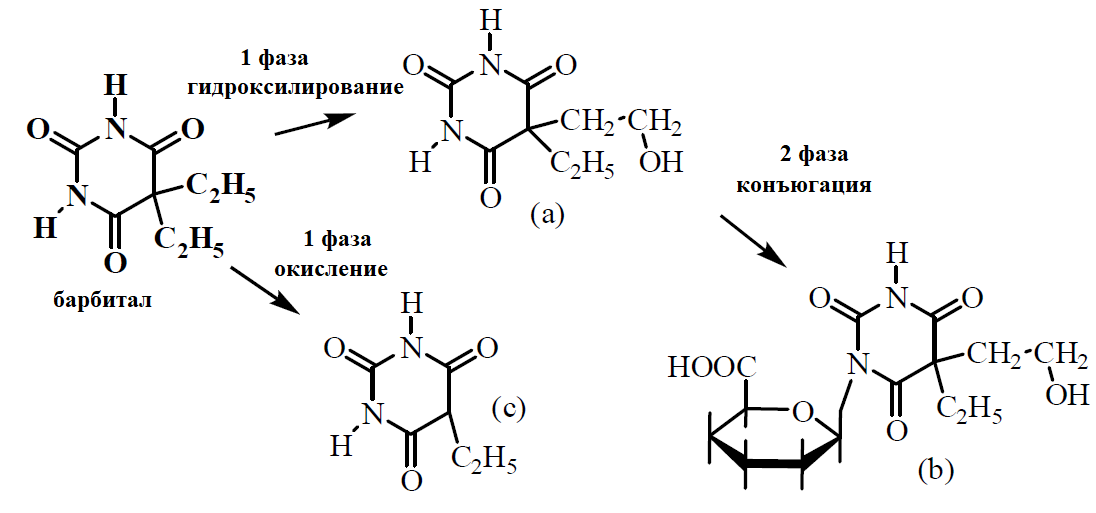 I фаза. Характеризуется химическими превращениями вещества под действием ферментных систем и заключается в изменении молекулы токсиканта, создающая или освобождающая функциональные группы. Смысл этих реакций – образование нетоксичных гидрофильных соединений с меньшей молекулярной массой, которые легче, чем исходное вещество выводятся из организма экскреторными органами. Это энергоемкий процесс, протекающий с затратой необходимой для этого энергии. II фаза. Характеризуется образованием конъюгатов. Это процесс биосинтеза между метаболитами и некоторыми эндогенными веществами организма (глюкуроновая кислота, сульфаты, ацетаты, глицин и т.д.). Конюгаты. как правило, не обладают токсичностью, имеют хорошую растворимость в биологических жидкостях организма и легко экскретируются. БЛОК III ХТА группы токсикологически важных веществ, изолируемых дистилляцией («Летучие яды») 6. Схема химико-токсикологического исследования этилового спирта. Формула C2Н5 - OH Этанол (C2H5OH) – бесцветная жидкость с характерным запахом, плотность 0,813–0,816, температура кипения 77–77,50С. Смешивается с водой, эфиром и другими органическими растворителями. Перечь объектов исследования. Приказ Минздравсоцразвития РФ от 12.05.2010 № 346н: головной мозг, печень, почку – по 100,0 г, кровь, мочу – по 10,0-20,0 мл Дополнительно: рвотные массы, остатки жидкости в стакане, емкости, флаконах, найденных на месте происшествия Изолирование – методом дистилляции (перегонка с водяным паром). Процесс. Объект массой 100,0 г тщательно измельчают, смешивают с водой до состояния густой кашицы, помещают в круглодонную колбу таким образом, чтобы она заполнилась не более чем на 1/3 объема, подкисляют щавелевой или виннокаменной кислотой до рН 2-3 и подвергают перегонке (с целью перевода веществ кислотного характера – цианиды калия, натрия, феноляты, салицилаты в свободные кислоты). Собирают два дистиллята. Первый в количестве 1 – 3 мл собирают в приемник с 5% раствором гидроксида натрия для улавливания летучей синильной кислоты. Для обнаружения этанола 2 – ю порцию дистиллята отгоняют в объеме 25 – 50 мл. Вещества кислотного и нейтрального характера перегоняются из кислых растворов в такой последовательности: синильная кислота, диэтиловый эфир, хлороформ, четыреххлористый углерод, ацетон, спирты алифатического ряда (этанол), нитробензол, муравьиная кислота, хлоралгидрат, формальдегид, сероуглерод, салициловая кислота и другие. Во втором дистилляте обычно содержатся вещества средней летучести. Внешний вид дистиллята: бесцветная жидкость с запахом спирта. Качественный анализ (обнаружение). 1.ГЖХ (основной метод) Газожидкостная хроматография основана на физико-химическом разделении анализируемых компонентов, находящихся в газовой фазе, при их прохождении вдоль нелетучей жидкости, нанесенной на твердый сорбент. Методика. 5 мл дистиллята помещают в пенициллиновый флакон, закрывают резиновой пробкой, которую фиксируют с помощью зажима. Флакон нагревают на водяной бане в течении 10 мин для перевода определяемого вещества (этанола) в паро – газовую фазу. 0,5 мл паро – газовой смеси вносят в колонку хроматографа. Обнаружение этанола проводят по соответствующим параметрам удерживания. Время удерживания на колонке характерно для каждого из разделяемых веществ, поэтому служит качественной характеристикой вещества. Исправленное время удерживания рассчитывается как разность абсолютного времени удерживания вещества и времени удерживания несорбируемого компонента: t испр = t абс – t н.к. Удерживаемый объем также является качественной характеристикой анализируемого вещества. Удерживаемый объем V – это объем газа-носителя, необходимый для вымывания всего количества вещества из колонки, который численно равен произведению скорости газа – носителя U на время удерживания t: V = U · t Скорость газа измеряется в мл/мин, время удерживания – в минутах. Если на хроматограмме появляется пик, параметры удерживания которого (время удерживание, расстояние удерживания, объем удерживания) должны совпасть с параметрами удерживания этанола проводят подтверждающие реакции. 2. Химические реакции (подтверждающие). 2.1. Реакция образования йодоформа. В качестве реактивов применяют раствор гидроксида натрия, раствор иода и реакцию проводят при нагревании. При наличии этанола ощущается запах иодоформа, а при больших количествах этанола образуется желтый осадок. Предел обнаружения – 0,04 мг/мл. Методика выполнения реакции образования иодоформа: в пробирку вносят 1 мл исследуемого раствора и 2 мл 5%-го раствора гидроксида натрия или карбоната натрия. К этой смеси по каплям прибавляют 1%-й раствор иода в 2%-м растворе иодида калия до слабо-желтой окраски. Затем смесь несколько минут нагревают на водяной бане (50 °С). При наличии этилового спирта ощущается запах йодоформа 2.2. Реакция этерификации. Для получения этиловых эфиров, имеющих характерный запах, применяют бензоилхлорид и ацетат натрия.  Методика выполнения реакции образования этилацетата: в пробирку вносят 1 мл исследуемого раствора и 0,1 г высушенного ацетата натрия, затем осторожно по каплям прибавляют 2 мл концентрированной серной кислоты. Смесь нагревают на пламени горелки (лучше нагревать пробирку на парафиновой или глицериновой бане) до выделения пузырьков газа. Появление специфического запаха уксусно-этилового эфира указывает на наличие этилового спирта в исследуемом растворе. Предел обнаружения – 20 мг/мл. Методика выполнения реакции образования этилбензоата: к 1 мл исследуемого раствора прибавляют 1–2 капли бензоилхлорида. При взбалтывании смеси к ней прибавляют по каплям 10%-й раствор гидроксида натрия до исчезновения удушливого запаха бензоилхлорида. Появление запаха этилбензоата указывает на наличие этилового спирта в пробе. 2.3. Реакция образования ацетальдегида. Методика выполнения реакции образования ацетальдегида: к 1 мл исследуемого раствора прибавляют 1 мл 10%-ного раствора серной кислоты до получения кислой среды (по лакмусу). К этой смеси по каплям прибавляют 10%-й раствор дихромата калия до тех пор, пока жидкость не станет оранжево-красной. Смесь оставляют на несколько минут при комнатной температуре. При наличии этилового спирта в исследуемом растворе появляется запах ацетальдегида. Предел обнаружения – 3 мг/мл. Количественное определение 1.Метод газожидкостной хроматографии (основной). Количество этанола, извлеченного из биологического материала прямо пропорционально высоте или площади пика. Для расчета количества метанола в исследуемом объекте используют метод внутреннего стандарта, в качестве которого рекомендован пропанол. К каждому из стандартных растворов, предназначенных для построения графика, а также к анализируемой пробе добавляют определенное количество пропанола (внутренний стандарт) и хроматографируют. Рассчитывают отношение площадей Sх или высот hx пиков исследуемого вещества к Sст(hст). Строят калибровочный график зависимости Sx /Sст (hx/hст) от концентрации исследуемого вещества. 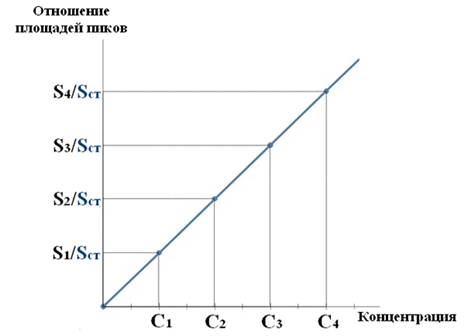 Для расчета концентрации этаноал в исследуемой пробе используют калибровочный коэффициент, который является постоянным для данной пары веществ на колонке и зависит от летучести определяемых веществ в условиях опыта.Калибровочный коэффициент рассчитывают по формуле: 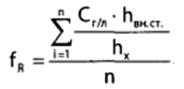 Где Сг/л – концентрация вещества, %; hвн.ст. – высота пика внутреннего стандарта (пропанол); hх – высота пика этанола; n – число измерений (не менее трех). Калибровочный коэффициент вводят в формулу расчета концентрации вещества в исследуемом образце: 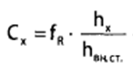 Где Сх – концентрация вещества в пробе %; hх – высота пика; hвн.ст. – высота пика внутреннего стандарта (пропанол). Метаболизм. Этанол выделяется из организма с выдыхаемым воздухом, мочой, калом, слюной, молоком, но большая часть этанола в организме метаболизируется. У человека несколько ферментов участвуют в переработке этанола сначала в ацетальдегид, а затем в уксусную кислоту и ацетил-КоА. Как только ацетил-КоА образуется, он становится субстратом для цикла лимонной кислоты, в конечном счете производя клеточную энергию и высвобождая воду и углекислый газ 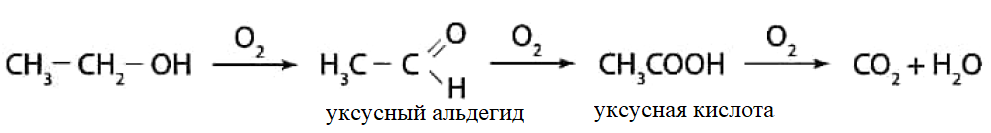 Токсикологическое значение. Этиловый спирт широко используется в промышленности как растворитель и исходный продукт для получения многих химических соединений. Этот спирт используется в медицине как дезинфицирующее средство. В химических лабораториях он применяется как растворитель, входит в состав многих спиртных напитков. БЛОК IV ХТА группы токсикологически важных веществ, изолируемых минерализацией («Металлические яды») 15. Соединения мышьяка, имеющие токсикологическое значение. Изолирование. Дробный метод их обнаружения и определения в минерализате. Оценка результатов химико-токсикологического анализа. Мышьяк и его соли, являясь высокотоксичными соединениями, широко применяются в народном хозяйстве и медицине. Наибольшее токсикологическое значение имеют: Мышьяковистый ангидрид (As2O3), арсениты и арсенаты натрия, арсенит и арсенат кальция, парижская или швейнфуртская зелень [Cu(CH3COO)2 · 3Cu(AsO2)2], органические соединения мышьяка (новарсенол, миарсенол, осарсол и др.) Перечь объектов исследования. Основные объекты исследования на содержание мышьяка – моча и волосы. 1.пробоподготовкА и метод (схема) изолирования яда Пробоподготовка, включает изолирование (извлечение) тяжелого металла методом минерализации, отделение мешающих проведению анализа компонентов биопробы. Минерализация пероксидом водорода и азотной кислотой под давлением с использованием СВЧ. Пробу волос (максимально 2,0 г) помещают в специальный сосуд прибора + смесь концентрированной азотной кислоты и пероксида водорода (окислительный агент). Сосуд герметично закрывают. Переносят в микроволновую систему прибора, где реакционная смесь нагревается в СВЧ поле. При мощности МВ – нагрева 450 Вт в течение 15 минут степень извлечения токсиканта составляет 94% 2.ДЕНИТРАЦИЯ (ОЧИСТКА МИНЕРАЛИЗАТА) После минерализации биологического материала минерализат содержит окислители, которые мешают дальнейшему проведению исследования Денитрация с помощью формальдегида К минерализату + 15 мл дистиллированной воды и смесь нагревают. В нагретую жидкость + формальдегид по каплям. Наблюдается бурное выделение пузырьков газа (NO и N2) и, вследствие окисления NO кислородом воздуха, выделяются бурые пары NO2. 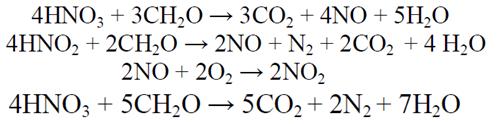 На денитрацию при помощи формальдегида расходуется до 2 мл формальдегид и реакция заканчивается через 1–2 мин. Остатки непрореагировавшего формалина удаляют или нагреванием в течение 10 минут или добавлением в нагретую жидкость 10 капель пергидроля. Окончание денитрации определяют с дифениламином (синее окрашивание)  3.Реакции обнаружения (идентификации) яда Предварительные 1.Реакция Зангера – Блека. Реакции обнаружения мышьяка основаны на восстановлении мышьяка до мышьяковистого водорода с дальнейшим обнаружением последнего. В связи с этим в качестве ориентирующей реакции, имеющей только отрицательное судебно – химическое значение, используют реакцию Зангер – Блека, в основе которой лежат следующие процессы: 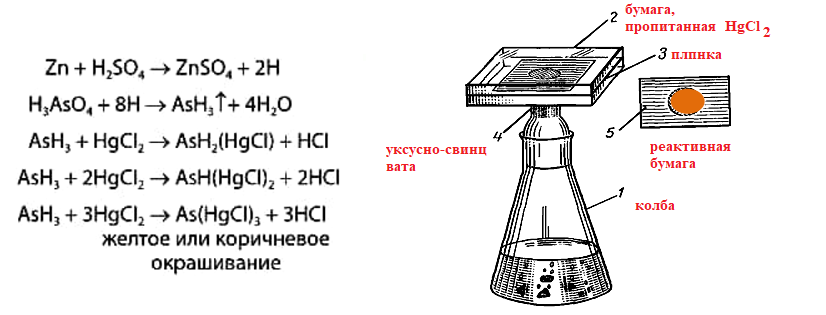 Если в минерализате присутствуют соединения сурьмы в количестве 2 мг и более, они также могут давать окрашенное пятно на бумаге. При бурно текущей реакции между цинком и серной кислотой может образовываться сероводород, способный реагировать с дихлоридом ртути: Вата, пропитанная ацетатом свинца, служит для исключения влияния сероводорода: Реакция Зангер – Блека высокочувствительна (предел обнаружения – 0,1 мкг в исследуемом объекте), но не специфична, так как мешают соединения, которые восстанавливаются водородом (например, соединения сурьмы). При отрицательных результатах этих реакций отпадает необходимость в проведении реакции Марша. При положительном результате обязательным является подтверждение обнаружения мышьяка реакцией Марша. Подтверждающие Метод Марша включает в себя ряд испытаний. К 10 мл минерализата добавляют 20 капель 10% раствора хлорида олова (II) в концентрированной серной кислоте и переносят в воронку аппарата Марша, проверенного на отсутствие воздуха. 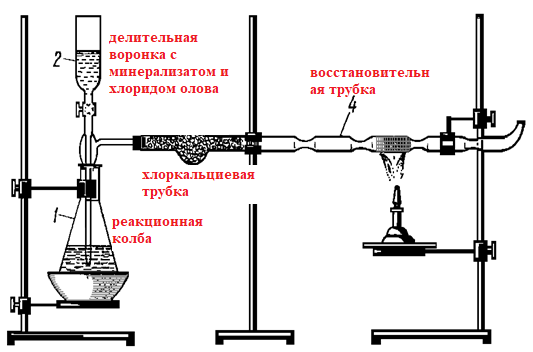 Жидкость порциями прибавляют в реакционную колбу Марша, нагревая восстановительную трубку аппарата. Для определения мышьяка в минерализате проводят ряд испытаний. 1.Отставляют горелку от нагреваемой части трубки, поджигают газ, выходящий из трубки. В присутствии мышьяка пламя окрашивается в синий цвет, ощущается чесночный запах. В пламя у конца трубки вносим холодную фарфоровую чашку. В присутствии мышьяка наблюдаются буровато – серые пятна. 2.Восстановительную трубку поворачивают на 180º и конец её опускают в приёмник с 5% раствором нитрата серебра, подщелоченный гидроксидом аммония: 3.Горелку вновь подставляют под трубку Марша, нагревают в течение часа. В охлажденной части восстановительной трубки может появиться серо – бурое окрашивание. Прибор разбирают, место налёта в восстановительной трубке нагревают на горелке. На холодных частях трубки образуется белый налет оксида мышьяка, кристаллы которого имеют под микроскопом форму октаэдра. Белый налет в трубке растворяют в 2 каплях 5% раствора азотной кислоты. Раствор упаривают на предметном стекле досуха. Сухой остаток растворяют в 1 – 2 каплях 10% соляной кислоты. В раствор вносят кристаллы хлорида цезия. Если осадка не появилось, то можно говорить об отсутствии сурьмы. Далее добавляют несколько кристаллов иодида калия. В присутствии мышьяка под микроскопом кристаллы красного цвета в виде правильных шестилучевых звезд гексаиодарсенат цезия и гексаиодарсенит цезия. 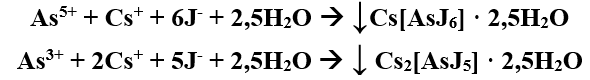 На осадок действуют 1 – 2 каплями пиридина. При наличии мышьяка осадок растворяется, а по краям капли образуется скопление зеленовато – желтых игольчатых кристаллов. При наличии сурьмы кристаллы теряют окраску, но сохраняют форму. Предел обнаружения – 0,1 мкг мышьяка в пробе. 4.Количественное определение яда 1.Атомно – абсорбционная СФМ при 193,7нм Аликвоту исследуемого минерализата (5 мкл) вносят графитовую печь электротермического атомизатора. Цикл работы состоит из стадий: – испарения – пиролиза (три стадии) – атомизации – очистки После окончания цикла и индикации результатов измерения, значения массовой концентрации элемента – аналита вычисляют по амплитуде анализируемого сигнала. Измерение концентрации для каждой пробе проводят дважды и вычисляют среднее арифметической. Массовую долю металла в биоматериале (в мкг⁄мл) вычисляют по формуле: где С – концентрация элемента в анализируемом растворе, мкг⁄мл; Со – концентрация элемента в фоновом (холостом) растворе, мкг⁄мл; V – объём анализируемого минерализата, л; Р – навеска пробы, мл. 2. ФЭК. Проводят реакцию AsН3 c ДДТК серебра в пиридине. Мышьяковистый водород получают в специальном приборе, так чтобы проба не содержала влаги. Химизм образования ДДТК мышьяка не выяснен, образующийся комплекс имеет устойчивую красно – фиолетовую окраску, но в присутствии воды легко гидролизуется. Оптическую плотность измеряют на ФЭК при 540 нм в кювете с толщиной слоя в 10 мм. Раствор сравнения – 1 мл раствор 20% раствора серной кислоты. Концентрацию металла определяют по стандарту (0,1 мг/мл). Для пересчета количества мышьяка на 100 мл биоматериала используют формулу: Сх = Аиссл ∙ Сст ∙ V1 ∙ 100 Аст ∙ V2 ∙ В Сx – количество мышьяка в мг на мл биоматериала; Аиссл., Аст. – оптические плотности исследуемого и стандартного растворов; V1 – общий объем минерализата; V2 – аликвота, взятая для определения, мл; В – навеска биологического материала, мл. Метаболизм. Мышьяк обладает способностью кумулироваться. При остром отравлении он концентрируется в основном в ЖКТ и паренхиматозных органах, при хроническом отравлении накапливается в костях и ороговевших тканях (волосы, ногти, кожа). Выделяется мышьяк медленно через почки, кишечник, потовые железы и с молоком. Токсикологическое значение. Ангидрид мышьяковистой кислоты применяется в медицине, в сельском хозяйстве (как инсектицид), в стекольной и кожевенной промышленностях. Арсениты и арсенаты некоторых металлов применяются в качестве ядохимикатов. Сюда относится парижская (швейнфуртская) зелень. Определенное токсикологическое значение имеют органические соединения мышьяка, применяемые в медицине (новарсенол, осарсол и др.). Известны случаи отравлений мышьяковистым водородом. Очень токсичными являются боевые отравляющие вещества (люизит, адамсит и др.), содержащие мышьяк. Соединения пятивалентного мышьяка в организме превращаются в более токсичные соединения трехвалентного мышьяка. БЛОК V ХТА группы токсикологически важных веществ, изолируемых экстракцией и сорбцией («Лекарственные яды») 7.Составить примерный план анализа при подозрении на отравление алкалоидами – производными изохинолина (папаверин). Алкалоид папаверин содержится в опии в количестве 0,1 – 1,5%. Папаверин обладает основными свойствамиза счет третичного атома азота в молекуле. Экстрагируется из щелочных фракций (рН 8 – 10,0) 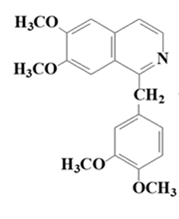 Перечь объектов исследования. Приказ Минздравсоцразвития РФ от 12.05.2010 № 346н – комплекс внутренних органов (содержимое желудка, 1/3 печени, желчь, одну почку); биологические жидкости (всю мочу, но не более 200 мл и 200 мл крови); лекарственные препараты Изолирование – возможно применение общих методов, изолирование проводят из щелочных фракций: – Метод Стаса – Отто – изолирование этиловым спиртом, подкисленным щавелевой или винной кислотой; Метод А.А.Васильевой – изолирование водой, подкисленной органической кислотой; Метод В.А.Карташова – изолирование нейтральным ацетоном; Метод прямой экстракции липофильными растворителями Схема изолирования общим методом А.А. Васильевой. 1.Настаивание измельченного объекта с водой, подкисленной щавелевой кислотой до рН 3, в течении двух часов. Воды берем в количестве 1:2 по отношению к навеске объекта. Водное извлечение фильтруем. 2.Экстрагирование веществ кислого характера из водного фильтрата хлороформом при рН = 2 (трехкратная экстракция), отделение органической фазы и концентрирование извлечение упариванием (фракция «кислое извлечение»). При этом разрушаются комплексы папаверина с белками, он приобретает положительный заряд за счет протонирования и переходит в водную фазу. Данную фракцию отбрасываем. 3.Подщелачивание оставшегося после разделения фаз водного слоя раствором аммиака до рН 10, экстрагирование веществ основного характера трехкратной экстракцией хлороформом, отделение органической фазы и концентрирование упариванием (фракция «щелочное извлечение»). Папаверин в щелочной среде находится в молекулярной форме и экстрагируется в неполярный растворитель – хлороформ. Методы очистки. С целью очистки извлечений из биологического материала в химико – токсикологическом анализе широко используются различные виды и варианты хроматографии. Наиболее часто для очистки извлечений используется тонкослойная хроматография (ТСХ) и колоночная хроматография (КХ). Фракцию «щелочное извлечение» исследуют на наличие папаверина. 1.ТСХ. В тонкослойной хроматографии роль неподвижной фазы выполняет фиксированный тонкий слой сорбента (0,1 – 0,5мм), содержащий определенное количество воды, нанесенный на хроматографическую пластинку из стекла, фольги, полимера. В качестве сорбентов чаще используют силикагель и окись алюминия. Для лучшего удерживания на пластинке в сорбент добавляют связующий компонент – гипс, крахмал и др. Роль подвижной фазы выполняет индивидуальный растворитель или их смесь, так называемая «хроматографическая система». В процессе хроматографирования, по мере того как растворитель поднимается вверх по пластинке за счет капиллярных сил, происходит разделение смеси веществ согласно их коэффициентам распределения между подвижной и неподвижной фазами Методика. 5 – 10 мкл извлечения исследуют методом одномерной восходящей хроматографии на пластинках «Силуфол УФ254» или «Сорбфил ПТСХ-ПА-УФ». Для разделения и идентификации всего применяются многокомпонентные системы растворителей (для веществ основного характера): диоксан – хлороформ – ацетон – 25 % раствор аммиака (47,5:45:5:2,5) ацетон – хлорофром – 25% раствор аммиака (245:12:1).  Схема детектирования. После того как система растворителей поднимется на 10 см выше линии старта, пластинку вынимают из камеры, подсушивают на воздухе и опрыскивают реактивом Драгендорфа, модифицированным по Мунье. Расчет Rf. Величина Rf – отношение длины пробега анализируемого вещества (а) к длине пробега растворителя (b): Rf = a / b При проявлении пятен и соответствующих значений Rf = 0,75 – 0,80, выполняют частные реакции и проводят количественное определение. Окраска пятен. Желто – оранжевые 2.Химические реакции. 2.1. Обнаружение с помощью общеалкалоидных реактивов. С реактивом Драгендорфа образуется оранжевый осадок: 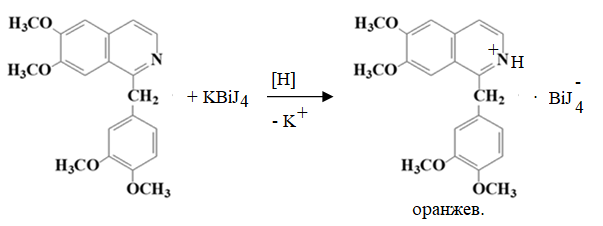 2.2. Реакция с серной кислотой, образуется фиолетовое окрашивание (оксониевая соль): 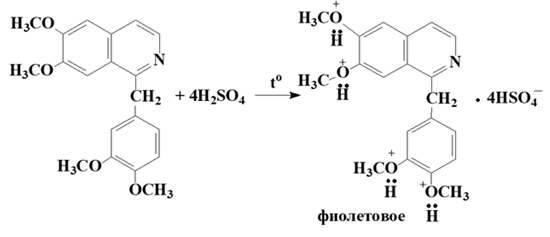 2.3. Реакция окислительной конденсации с реактивом Марки – при этом образуется сульфат метиленбиспапаверина, который легко окисляется при добавлении бромной воды, а при добавлении аммиака образует фиолетовый осадок, растворяющийся в этаноле с образованием раствора, окрашенного в фиолетовый цвет: 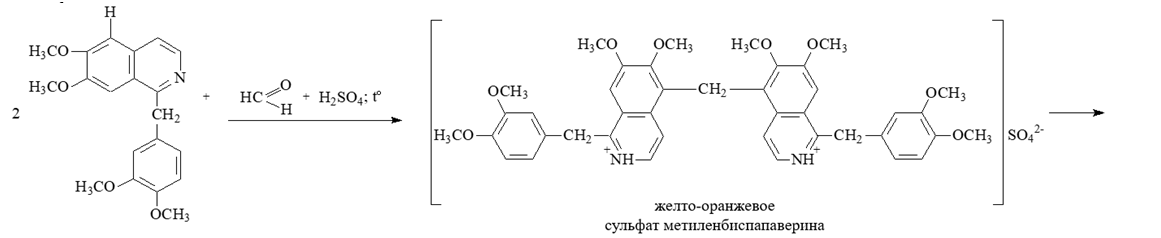 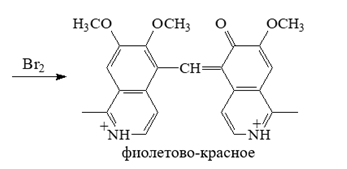 2.4. Характерной реакцией на папаверин является каролиновая проба: к исследуемому порошку прибавляют концентрированную серную кислоту, уксусный ангидрид и нагревают. Появление ярко-желтого окрашивания и зеленой флуоресценции указывает на наличие папаверина: 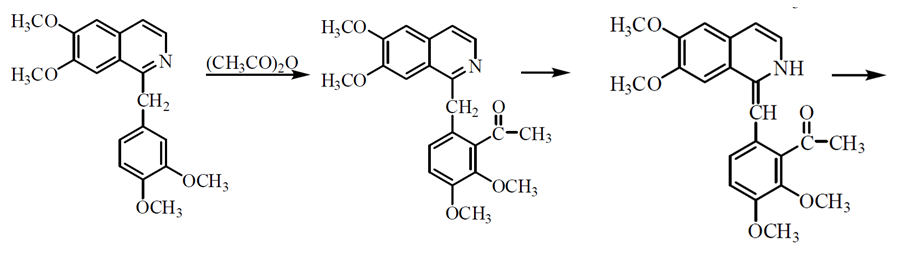 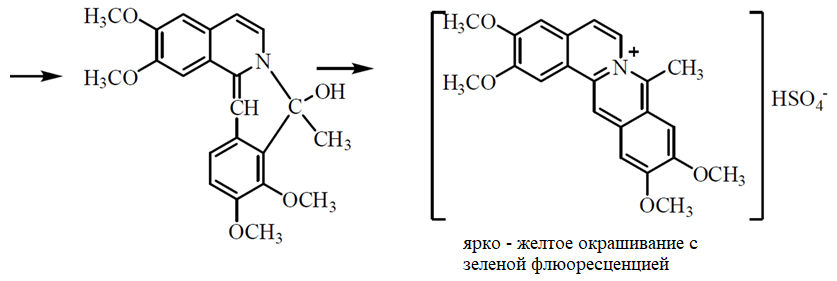 2.5. Микрокристаллические реакции. На предметное стекло наносят несколько капель исследуемого раствора и выпаривают досуха. К сухому остатку прибавляют каплю 0,1 н. раствора соляной кислоты. Рядом наносят каплю 10 % раствора хлорида кадмия, а затем соединяют эти растворы. При наличии папаверина появляются сростки из тонких пластинок, имеющих форму куба. 3.Исследование извлечения методом СФМ в УФ – области спектра. В молекуле папаверина имеется цепь сопряженных двойных связей, которые обеспечивают поглощение веществами излучения в УФ – области спектра. Длины волн, соответствующие максимумам поглощения в спектре исследуемого соединения, должны совпадать с таковым в спектре стандарта. Основание папаверина в 1 н. растворе соляной кислоты имеет максимум поглощения при 250, 284 и 310 нм. Раствор папаверина в 1 н. растворе серной кислоты имеет максимумы поглощения при 250. 254 и 310 нм 4. Исследование методом ВЭЖХ. ВЭЖХ, или жидкостная хроматография высокого давления, является вариантом колоночной жидкостной хроматографии, где элюент подается на колонку под большим давлением, что ускоряет проведение анализа. Разделение веществ проводится на колонках, заполненных мелкодисперсным сорбентом (силикагель, окись алюминия) или полимерным сорбентом. Папаверин имеет значительную молекулярную массу и содержит реакционноспособные группировки. Роль неподвижной фазы выполняет силикагель с привитой жидкой углеводородной фазой, элюентом служит ацетонитрил или метанол, детектор – спектрофотометр. Часть извлечения после очистки методом ТСХ вводят в колонку жидкостного хроматографа.Определение проводят на 2 или 4 хроматографических колонках; на хроматограмме появляется пик, время удерживания или объем которого должен совпасть с параметрами удерживания ацетона – стандарта. Время удерживания на колонке характерно для каждого из разделяемых веществ, поэтому служит качественной характеристикой вещества. Исправленное время удерживания рассчитывается как разность абсолютного времени удерживания вещества и времени удерживания несорбируемого компонента: t испр = t абс – t н.к. Удерживаемый объем также является качественной характеристикой анализируемого вещества. Удерживаемый объем V – это объем газа-носителя, необходимый для вымывания всего количества вещества из колонки, который численно равен произведению скорости газа – носителя U на время удерживания t: V = U · t Скорость газа измеряется в мл/мин, время удерживания – в минутах. При получении соответствующего пика наличие ацетона в исследуемом объекте подтверждают химическими методами. Количественное определение. ВЭЖХ – способы расчета концентрации. Количество папаверина, извлеченного из биологического материала, прямо пропорцианально высоте или площади пика. Расчет: Сх = (hx × Сст × 100) / hст или Сх = (Sх × Сст × 100) / Sст Где Сх – содержание папаверина в 100г органов, Сст – концентрация стандартного раствора, hxи hст ; Sx и S ст – соответственно высота или площади пиков исследуемого вещества и стандарта. Количество папававерина, извлеченного из биологического материала, прямо пропорционально высоте или площади пика. Расчет по калибровочному графику, используя внутренний стандарт (метод относительной калибровки).  Токсикологическое значение. Применяется в медицине в качестве ЛС, входит в состав комбинированных спазмолитических препаратов. Метаболизм. Метаболизм папаверинапроисходит главным образом путем дезалкилирования. При этом образуются фенольные соединения, которые выделяются с мочой в виде глюкуронидов. I стадия метаболизма. Окислительное О – дезалкилирование. 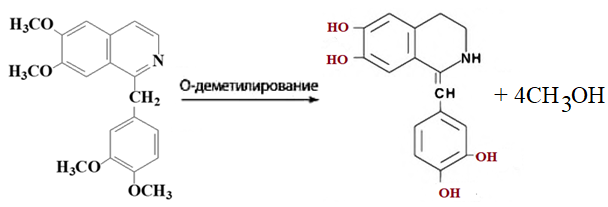 II стадия метаболизма. Конъюгация с глюкуроновой кислотой. 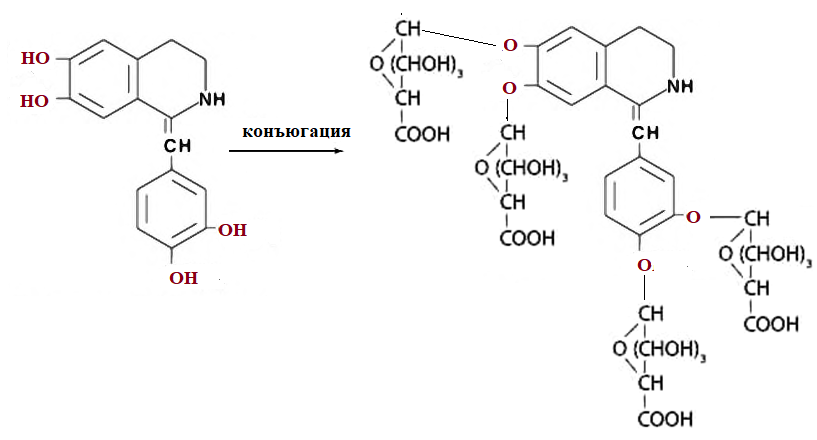 БЛОК VI Газохроматографическое определение «Летучих ядов» Задачи. 9. На хроматограмме, полученной в результате газохроматографического анализа крови на содержание этанола, высота пика этилнитрита составила 4,3 см, высота пика изопропилнитрита 5,4 см. Пользуясь методом внутреннего стандарта, определить количественное содержание этанола в крови, если котангенс угла наклона калибровочной кривой на калибровочном графике составил 2,12.  Расчет ведем по формуле: С = h / hst ∙ ctg a = 4,3 / 5,4 ∙ 1.54 = 1,23 При определении этилового спирта в крови найденную по калибровочному графику концентрацию этого спирта умножают на 0,95: 1,23 × 0,95 = 1,17%0 Заключение. Концентрация спирта в крови 1,17 %0, что соответствует легкой степени опьянения (0,5 – 1,5). 1 2 |
