лаба. Отчет по лабораторной работе 4 о к и сление э тил е н а в ацетальде г ид
 Скачать 207.12 Kb. Скачать 207.12 Kb.
|
|
Министерство науки и высшего образования Российской Федерации Федеральное государственное бюджетное образовательное учреждение высшего образования «Уфимский государственный нефтяной технический университет» Кафедра газохимии и моделирования ХТП Отчет по лабораторной работе № 4 « ОКИСЛЕНИЕ ЭТИЛЕНА В АЦЕТАЛЬДЕГИД » Вариант № 2 Выполнил: Ст. гр. БТГ-18-01 Ахметов М.А. Проверил: Доцент кафедры Хафизова С.Р. Уфа 2021 Цель работы: Получение ацетальдегида прямым окислением этилена в присутствии жидкого катализатора, определение выхода ацетальдегида на пропущенный этилен и конверсии этилена в ацетальдегид. Исходные данные:
Теоретическая часть: По масштабам производства ацетальдегид, наряду с формальдегидом, стоит на первом месте среди альдегидов, что обусловлено его большой ценностью в качестве промежуточного продукта органического синтеза. Окислением ацетальдегида получают уксусную кислоту, уксусный ангидрид, надуксусную кислоту. Реакцией с синильной кислотой и последующими превращениями циангидрина получают молочную кислоту, акрилонитрил и эфирыакриловойкислоты. Другие методыпереработкиацетальдегида состоят в процессах типа альдольной конденсации (получение пентаэритрита, бутандиола-1,3, кротонового альдегида и др.). Ацетальдегид в промышленности получают: жидкофазной гидратацией ацетилена в присутствии ртутьсодержащих и парофазной гидратацией в присутствии кадмийкальцийфосфатных катализаторов; каталитическим окислительным дегидрированием этанола; окислением легких насыщенных С3 - С4 углеводородов; прямым каталитическим окислением этилена. Из всех методов получения ацетальдегида наибольшее распространение получил процесс прямого окисленияэтилена в присутствиихлорида палладия. Реакция окисления этилена в ацетальдегид сопровождается выделением Процесс получения ацетальдегида окислением этилена может осуществляться на твердом катализаторе (гетерогенно-каталитический процесс). Однако это сопряжено с трудностями, связанными с отводом значительного количества тепла. Применение жидкого катализатора (гомогенно-каталитический процесс) позволяет проще решать проблему отвода тепла - путем испарения части воды, содержащейся в катализаторном растворе. Непрерывный процесс получения ацетальдегида состоит из двух стадий: 1. Карбонилирование Установлено, что промежуточным соединением при введении этилена в водный раствор хлорида палладия является комплекс этилен - палладийхлорид. 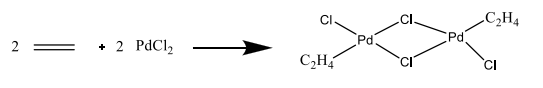 который при взаимодействии с водой очень быстро разрушается с образованием ацетальдегида и металлического палладия. Скорость реакции окисления значительно ниже, чем реакции карбонилирования, поэтому активность катализатора быстро падает. Для повышения скорости окисления палладия применяются водные растворы хлоридов меди и железа, играющие роль переносчиков кислорода: 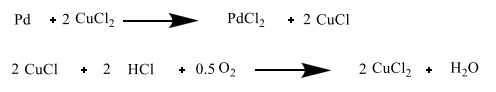 В качестве побочных продуктов при окислении этилена в ацетальдегид образуются уксусная кислота, муравьиная кислота, хлорсодержащие соединения (метилхлорид, этилхлорид, ацетальдегидхлорид), продукты конденсации (кротоновый альдегид), диоксид углерода. В промышленности существуют два варианта технологического оформления гомогенно-каталитического процесса - одностадийный (карбонилирование и окисление катализатора в одном аппарате) и двухстадийный (карбонилирование в одном аппарате, окисление металлического палладия - в другом). Определение количества полученного ацетальдегида гидроксиламинным методом. Гидроксиламинный метод основан на реакции:  В колбу Эрленмейера емкостью 150-200 мл пипеткой отмеряют 5 мл скрубберной воды, добавляют 3-4 капли индикатора бромфенолблау и 10 мл 10 %-ного водного раствора солянокислого гидроксиламина. Содержимое колбы перемешивают встряхиванием и оставляют стоять в течение 30 минут, после чего выделившуюся соляную кислоту оттитровывают 0.1 н раствором гидроксида натрия до перехода желтой окраски раствора в сине-фиолетовую. Параллельно ставят холостой опыт (берут те же реактивы и в таких же количествах, но без скрубберной воды и титруют раствором щелочи). Методикавыполнениялабораторнойработы: 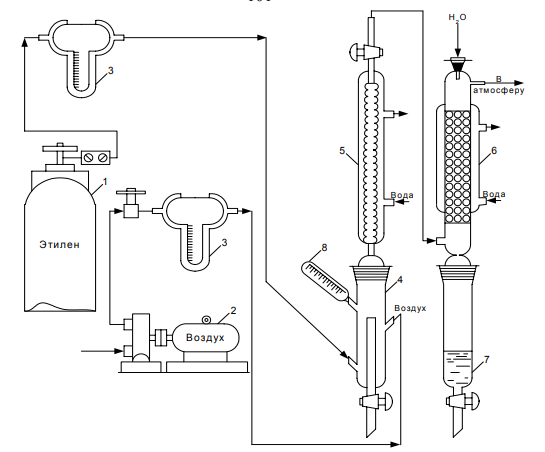 Рисунок 3.1 - Схема установки для получения ацетальдегида окислением этилена: 1 - баллон с этиленом; 2 - воздуходувка; 3 - реометр; 4 - реактор; 5 - холодильник; 6 - скруббер; 7 - приемник; 8 - термометр Лабораторная схема установка представлена на рисунке 3.1. Этилен из баллона 1 и воздух из воздуходувки 2 через реометры 3 поступают в реактор 4, где проходят через нагретый катализаторный раствор. Непрореагировавшие газы и продукты реакции вместе с увлеченной из катализаторного раствора водой проходят через водяной холодильник 5 и направляются в скруббер 6, орошаемый холодной водой, которая растворяет поступающий в нижнюю часть скруббера газообразный ацетальдегид. Скрубберную воду собирают в приемник 7 и сливают через определенные промежутки времени для определения содержания ацетальдегида гидроксиламинным методом. Непрореагировавшие газы выбрасываются в атмосферу. Опыт начинают с подачи воздуха в левую секцию реактора и этилена - в правую. Затем, постепенно взбалтывая, заливают в реактор 200 мл катализаторного раствора. После этого по реометрам устанавливают необходимые расходы этилена и воздуха - 200 мл/мин и 180 мл/мин соответственно. Включают обогрев реактора. Температуру катализаторного раствора в реакторе поддерживают в течение всего опыта в пределах 83- 85оС. Затем начинают подавать воду в верхнюю часть скрубберов со скоростью 50-60 капель в минуту. После установления необходимой температуры реакции из приемника сливают накопившуюся водуис этого момента начинаютотсчет времени опыта. Скрубберную воду сливают каждые 20, 40 и 60 минут от начала опыта, замеряют ее количество, результаты сводят в таблицу 2. Затем определяют содержание ацетальдегида гидроксиламинным методом. Ход работы: 1. Количество ацетальдегида определяют по формуле: 1 проба:  𝐺𝑎 = 0,0044∙(𝑏−𝑎)∙𝐾∙𝑑 = 𝐺𝑎 = 0,0044∙(𝑏−𝑎)∙𝐾∙𝑑 = 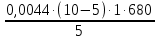 = 2,992 г = 2,992 г2 проба:  𝐺𝑎 = 0,0044∙(𝑏−𝑎)∙𝐾∙𝑑 = 𝐺𝑎 = 0,0044∙(𝑏−𝑎)∙𝐾∙𝑑 = 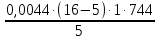 = 7,201 г = 7,201 г3 проба:  𝐺𝑎 = 0,0044∙(𝑏−𝑎)∙𝐾∙𝑑 = 𝐺𝑎 = 0,0044∙(𝑏−𝑎)∙𝐾∙𝑑 = 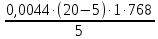 = 10,137 г = 10,137 ггде 𝐺𝑎 - количество ацетальдегида, г; 0,0044 - число грамм ацетальдегида, соответствующее 1 мл 0.1 н раствора NaOH; a - объем 0.1 н раствора NaOH, пошедший на титрование холостого опыта, мл; b - объем 0.1 н раствора NaOH, пошедший на титрование пробы, мл; d -суммарный объем скрубберной воды, полученной за время опыта, мл. 2. Рассчитаем объем и массу пропущенного этилена при н.у.: 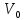 = =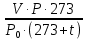 = = 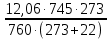 = 10,94 л = 10,94 л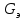 = =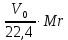 = = 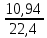 · 28 = 13,675 г · 28 = 13,675 гТаким образом: 1 проба: В = 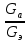 · 100% = · 100% = 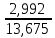 · 100% = 21,88 % · 100% = 21,88 %где Ga - количество полученного ацетальдегида, г; GЭ - количество пропущенного этилена, г. 2 проба: В = 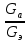 · 100% = · 100% = 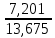 · 100% = 52,65 % · 100% = 52,65 %3 проба: В = 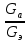 · 100% = · 100% = 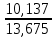 · 100% = 74,12 % · 100% = 74,12 %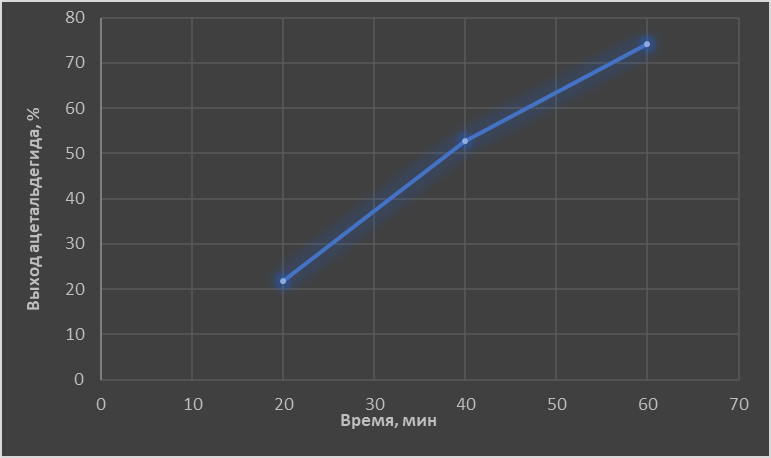 3. Рассчитывают конверсию этилена: К = 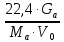 · 100 % · 100 % где Ga - количество полученного ацетальдегида, г; V0 - количество пропущенного этилена при нормальных условиях, л; Ма - молекулярная масса ацетальдегида. 1 проба: К = 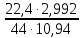 · 100 % = 13,92 % · 100 % = 13,92 %2 проба: К = 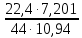 · 100 % = 33,5 % · 100 % = 33,5 %3 проба: К = 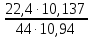 · 100 % = 47,18 % · 100 % = 47,18 %Вывод: В ходе лабораторной работы проведен гомогенно-каталитический процесс получения ацетальдегида прямым окислением этилена в присутствии жидкого катализатора – хлорида палладия. Определены выход ацетальдегида на пропущенный этилен и конверсия этилена в ацетальдегид для трёх проб. На скорость процесса, селективность и выход ацетальдегида существенное влияние оказывают: состав катализатора, кислотность среды, давление, температура и соотношение этилена и окисляющего агента. Конверсия этилена в ацетальдегид для 1, 2 и 3 пробы составляет соответственно 13,92 %, 33,5% и 47,18%, т.е. наибольший выход ацетальдегида достигается в третьей пробе. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
