07.БОЛЕЗНИ ОПЕРИРОВАННОГО ЖЕЛУДКА. Болезни оперированного желудка
 Скачать 263 Kb. Скачать 263 Kb.
|
Глава 7Болезни оперированного желудкаЦель: изучить классификацию, основные патогенетические механизмы и клиническую картину болезней оперированного желудка, а так же современные методы диагностики, консервативного лечения и хирургической коррекции. Контрольные вопросы:
Практические навыки:
Формы контроля:
Термином «болезнь оперированного желудка» принято обозначать расстройства, возникающие у больных после операции вследствие патофизиологических и патоморфологических изменений не только в пищеварительном аппарате, но и во всем организме. В результате недостаточности процессов адаптации и компенсации у 30% оперированных больных возникают различные патологические синдромы или рецидивы язв, (чаще у оперированных по поводу язвенной болезни двенадцатиперстной кишки). Классификация болезней оперированного желудка (А.А. Шалимов, В.Ф. Саенко, 1986). А. Функциональные расстройства: 1) демпинг-синдром; 2) гипогликемический синдром; 3) функциональный синдром приводящей петли. Б. Органические поражения: 1) рецидив язвы; 2) пептическая язва анастомоза; 3) рак культи желудка; 4) синдром приводящей петли механического происхождения; 5) анастомозит; 6) рубцовые деформации и сужения анастомоза; 7) ошибки в технике операции; 8) пострезекционные сопутствующие заболевания (панкреатит, энтероколит, гепатит). В. Смешанные расстройства или сочетание А и Б, но главным образом в сочетании с демпинг-синдромом. Наиболее полно отвечает условиям клиники классификация болезней оперированного желудка, предложенная Б.В. Петровским. Функциональные (патофизиологические) расстройства: - демпинг-синдром; - гипогликемический синдром; - функциональный синдром приводящей петли; - синдром регургитации и рефлюкс-эзофагит; - постгастрорезекционная и агастральная астения; - атония желудка и пилороспазм после ваготомии. Механические расстройства: - порочный круг; - механический синдром приводящей петли; - механическая непроходимость желудочно-кишечного соустья. Органические поражения желудка и его культи: - рецидив язвы после ушивания; - пептическая язва; - гастрит культи желудка; - рак культи желудка. ДЕМПИНГ-СИНДРОМ Частота колеблется от 3,5 до 20%, тяжелые формы встречаются у 2 – 10%, больных. Демпинг-синдром чаще развивается после резекции желудка по Бильрот-II, что обусловлено выключением пассажа пищи через двенадцатиперстную кишку. Этиология и патогенез. Основными причинными факторами в развитии демпинг-синдрома служат удаление важной секретирующей зоны и ликвидация привратникового регулирующего механизма. Некоторые авторы (М.И. Кузин и соавт., 1978) связывают демпинг-синдром с избыточным выделением инсулина после еды, последующим снижением сахара в крови. В настоящее время предложено более 25 теорий патогенеза демпинг-синдрома. При демпинг-синдроме наблюдается быстрое опорожнение желудка или его культи. Стремительный пассаж химуса по тонкой кишке, быстрый ферментный гидролиз пищевых веществ с неадекватными осмотическими и рефлекторными влияниями провоцируют нарушения гуморальной регуляции и активацию симпатико-адреналовой системы. При этом происходит выделение вазоактивных аминов, падение объема плазмы, гипергликемия. Своеобразным фоном для проявления синдрома у этих больных являются нарушения системы гипофиз – корковое вещество надпочечников — нервно-психические нарушения. Клиническая картина и диагностика. По тяжести течения различают 3 степени демпинг-синдрома: легкую, средней тяжести, тяжелую. Демпинг-синдром легкой степени – симптоматика проявляется вскоре после еды (только после приема сладких и молочных блюд) и продолжается 15 - 20 минут в виде слабости, резкого чувства голода, сосущей боли в эпигастрии, потливости, побледнения кожного покрова, сонливости. Пульс учащается на 5 - 10 ударов в мин., систолическое артериальное давление повышается не более чем на 10 мм рт. ст. Эти явления быстро проходят после приема пищи, особенно углеводистой. При правильной диете можно избежать приступов, трудоспособность не нарушается. Демпинг-синдром средней степени тяжести – симптомы выражены значительно резче, приступы появляются 2 - 4 раза в неделю. Синдром развивается на прием любой пищи. Во время приступа больные вынуждены ложиться. На высоте демпинг-атаки пульс учащается на 10 - 15 ударов мин., АД повышается на 10 - 15 мм рт. ст. Такое состояние продолжается 30 - 60 минут. Вне периода приступа больных беспокоят слабость, раздражительность, утомляемость. У больных отмечается дефицит веса, обменные расстройства, нарушается функция внешней секреции поджелудочной железы. Снижается трудоспособность, соблюдение диеты не предотвращает возникновению приступов демпинг-синдрома. Демпинг-синдром тяжелой степени: каждый прием пищи, в отдельных случаях, даже воды, вызывает продолжительные (иногда до 3 часов) приступы слабости, головокружения или обморочного состояния. Пульс учащается более чем на 15 - 20 ударов в мин., АД повышается на 15 - 25 мм рт. ст. Клиническая картина демпинг-синдрома может сочетаться с синдромом гипогликемии. Из-за мучительных приступов больные ограничивают прием пищи, в результате наступают истощение (белковое, витаминное и др.), расстройства минерального обмена и резкая астенизация нервно-психической деятельности. Трудоспособность утрачена. Консервативное лечение обычно не приносит облегчения. Большое значение в диагностике имеет рентгенологическое исследование - определяется быстрый сброс контрастной массы из культи желудка, нарушения моторно-эвакуаторной деятельности тонкой кишки (дистонические и дискинетические явления) нередко с признаками энтерита, ускоренный пассаж контрастной массы по тонкой кишке, потеря четкости изображения и возникновения уровней жидкости в кишечнике. Рентгенологическое исследование должно проводиться смесью сернокислого бария с концентрированными растворами глюкозы. Лечение. Консервативное лечение показано при легкой и средней степени демпинг-синдрома. Принципы консервативного лечения следующие: 1) Диета физиологически полноценная, механически щадящая. Состав диеты: высокое содержание белков (130 - 140 г), нормальное содержание жиров (310 г), нормальное содержание соли (15 г), значительное ограничение или исключение простых углеводов, ограничение сложных углеводов. Калорийность около 2800—3200 ккал. Все блюда готовят на пару или варят. Прием пищи небольшими порциями 5—6 раз в сутки, в положении лежа. Исключение приема жидкости во время еды. 2) С целью уменьшения реакции на быстрое поступление пищи в тонкую кишку перед едой назначают новокаин, анестезин, антигистаминные препараты (пипольфен, димедрол, супрастин), инсулин. 3) В качестве заместительной терапии назначают желудочный сок, раствор соляной кислоты, панкреатин, панзинорм, фестал, витамины группы В, аскорбиновую кислоту, препараты железа, кальция, магния, калия, белковые препараты — плазму, протеин, белковые гидролизаты. 4) Устранение психопатологических симптомов под контролем психиатра. 5) Санаторно-курортное лечение. Показания к операции: 1) тяжелая степень демпинг-синдрома; 2) сочетание демпинг-синдрома с синдромом приводящей петли; 3) отсутствие эффекта от консервативного лечения. Оперативное лечение должно предусматривать следующие задачи:
Возможны следующие варианты хирургического лечения: — реконструкция анастомоза по Бильрот-II в анастомоз по типу Бильрот-I (по Габереру); — уменьшение просвета гастродуоденоанастомоза до 1,8 – 2 см после резекции желудка по Бильрот-I; — в случае сочетания демпинг-синдрома с синдромом приводящей петли необходимо одновременно устранить причину синдрома приводящей петли. ГИПОГЛИКЕМИЧЕСКИЙ СИНДРОМ Гипогликемический синдром встречается в 5–17% в зависимости от метода оперативного вмешательства. Этиология и патогенез. Гипогликемический синдром вызывается быстрым поступлением углеводов из желудка в кишку, что провоцирует интенсивную абсорбцию глюкозы и реактивную гипергликемию, вызывающую массивный выброс инсулина в кровь. В результате избыточной секреции инсулина или повышенной чувствительности организма к нему развивается приступ гипогликемии. Некоторые авторы называют это расстройство поздним демпинг-синдромом. Клиническая картина и диагностика. Для приступов гипогликемии характерны наступающие через 1,5—3 часа после еды или физической нагрузки резкая мышечная слабость, сердцебиение, дрожь, головокружение, головная боль, разбитость, падение артериального давления, чувство голода, бледность кожного покрова и потоотделение, редко бывает потеря сознания. Гипогликемический синдром может варьировать от эпизодически возникающей слабости до тяжелых проявлений. Симптомы гипогликемии быстро устраняются приемом углеводов (больные обычно носят с собой кусочек сахара). Диагностика основана на проведении инсулиновых тестов и изучения «сахарных кривых». Лечение. При легкой и среднетяжелой степени гипогликемического синдрома показано консервативное лечение — в основном диетотерапия, построенная по тому же признаку, что и при демпинг-синдроме. Для снятия гипогликемической реакции применяются: сахар, конфеты, печенье. Хороший эффект оказывают общеукрепляющие средства, витаминотерапия, переливание крови и плазмы, введение инсулина в качестве профилактического средства. Лечение сводится к консервативным мероприятиям и лишь при тяжелой степени позднего демпинг-синдрома показана реконструктивная операция, так как частые атаки демпинг-синдрома и гипогликемии могут приводить к кратковременной потере сознания, стенокардии. СИНДРОМ ПРИВОДЯЩЕЙ ПЕТЛИ Приводящая петля — это оставшаяся часть двенадцатиперстной кишки и участок тощей кишки до анастомоза с культей желудка. Частота синдрома приводящей петли составляет 1,3–22%, тяжелые формы отмечены у 1–10% оперированных. Этиология и патогенез. Синдром приводящей петли (СПП) развивается после резекции желудка по Бильрот-II и в других модификациях. Он проявляется различными нарушениями опорожнения двенадцатиперстной кишки и может иметь функциональную и механическую природу. При функциональном СПП основное значение имеет снижение тонуса и нарушение моторики двенадцатиперстной кишки, обусловленное как нарушением иннервации, так и наличием недиагностированного дуоденита и хронической дуоденальной непроходимости. Механический СПП вызывается спайками, изгибами, перекрутами кишки, внутренними грыжами, стенозом гастроеюноанастомоза, ущемлением приводящей петли в окне брыжейки поперечно-ободочной кишки, инвагинацией приводящей петли кишки в гастроэнтероанастомоз, выпадением (пролапсом) слизистой оболочки приводящей петли в анастомоз, техническими погрешностями формирования желудочно-кишечного соустья (рис. 7.1). Застой содержимого в двенадцатиперстной кишке, дискинезия приводящей петли создают условия для развития кишечного дисбактериоза, холецистита, панкреатита, цирроза печени. Сочетание синдрома приводящей петли с другими синдромами способствует развитию синдромов расстройств питания, нарушению водно-электролитного баланса и кислотно-щелочного состояния. 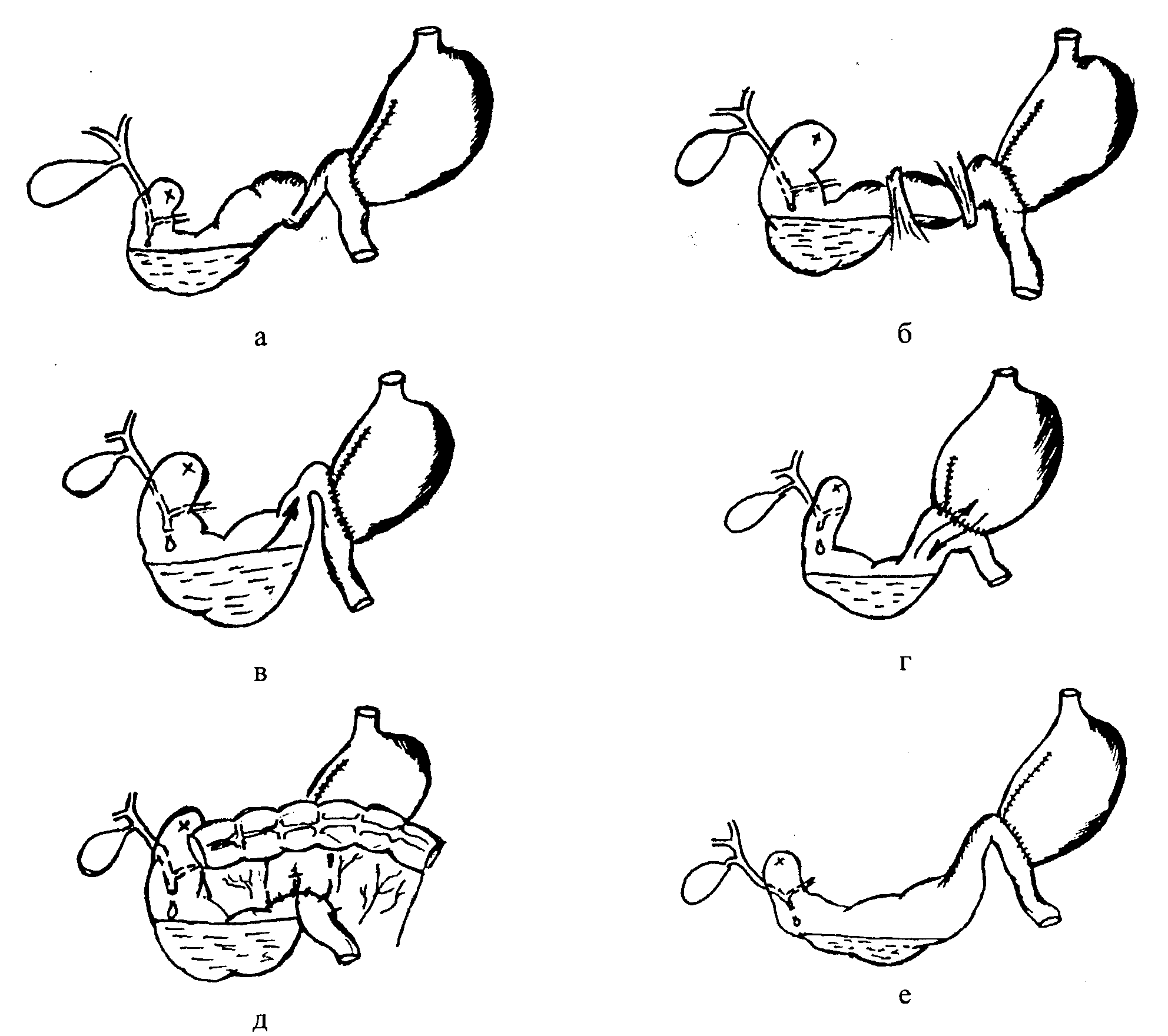 Рис. 7.1. Схематичное изображение механических причин синдрома приводящей петли: а – перекрут приводящей петли; б – спайки в области приводящей петли: в – высокая "шпора"; г – низкая "шпора"; д – ущемление петли в брыжейке толстой кишки; е – провисание длинной приводящей петли. Клиническая картина и диагностика. Непроходимость приводящей петли может протекать остро или хронически. Острая непроходимость характеризуется постоянными и усиливающимися болями в эпигастрии, правом подреберье, тошнотой, рвотой желчью. После рвоты наступает облегчение, при полной непроходимости в рвотных массах желчь отсутствует. Прогрессивно ухудшается общее состояние, тахикардия. Наблюдается болезненность в эпигастрии, дефанс, иногда можно пропальпировать опухолевидное образование тугоэластической консистенции. Возможны срыгивания, отрыжка, изжога, загрудинные боли чаще при сочетании с грыжей пищеводного отверстия диафрагмы. Различают три степени тяжести синдрома: Легкая форма - после приема особенно жирной пищи, отмечается тяжесть и небольшие боли в эпигастральной области и в правом подреберье, сопровождающиеся отрыжкой желчью до 50 - 100 мл. Общее состояние остается вполне удовлетворительным. Средняя степень тяжести синдрома - боли после еды возникают часто, они более интенсивные, могут иррадировать в спину и правую лопатку. Рвота желчью с примесью или без примеси пищи возникает 3-4 раза в неделю. Вследствие потери желчи и панкреатического сока у больных наблюдаются нарушения переваривания и всасывания пищевых веществ и потеря веса. Трудоспособность таких больных ограничена. Терапевтическое лечение приводит к временному улучшению. Тяжелая форма синдрома приводящей петли - каждый прием пищи вызывает распирающие боли в эпигастральной области и в правом подреберье с иррадиацией в спину и правую лопатку. Иногда боли могут принимать опоясывающий характер. Возникает ежедневная рвота большим количеством желчи (до 1000 мл и более). После рвоты больные чувствуют временное облегчение, поэтому рвоту иногда вызывают искусственно. Отмечаются выраженное обезвоживание, значительный дефект веса и признаки гипо- и авитаминоза. Изменяется психика больных, они становятся раздражительными и апатичными. Стул нерегулярный, серого цвета и содержит много непереваренных жиров. Хроническая форма синдрома приводящей петли проявляется ощущением полноты и растяжения в эпигастрии, усиливающимся после еды. Бывает отрыжка с неприятным запахом и рвота со значительной примесью желчи. К хронической форме синдрома приводящей петли, как правило, присоединяется вторичное поражение желчных путей. Застойные процессы ведут к развитию патогенной флоры в приводящей петле и восходящему инфицированию желчных путей, сопровождающимся резкими приступообразными болями в правом подреберье, зудом кожи, желтушностью склер, увеличением и уплотнением печени, увеличением желчного пузыря, характерными мучительными приступами изжоги. Диагностика проводится на основании типичной клинической картины. У ряда больных рентгенологически можно четко определить расширенную и атоничную, заполненную газом петлю приводящей кишки с длительной задержкой контрастного вещества. Лечение. Консервативная терапия при синдроме приводящей петли легкой и средней степени тяжести обычно дает положительный эффект. Следует ограничить прием молочных продуктов, сладкого. Оперативное лечение показано при тяжелом синдроме и неэффективности консервативного лечения. Выбор операции при пептической язве зависит прежде всего от ее причины. Наилучший результат дает реконструкция операции Бильрот-II в Бильрот-I или в У-образный анастомоз по Ру (рис. 7.2). Также возможно устранение препятствий для пассажа пищи путем рассечения спаек расправления заворота, устранения инвагинации. В целях улучшения эвакуации накладывают энтероанастомоз по Брауну между приводящей (если она слишком велика) и отводящей петлей. Лечение при хронической форме синдрома приводящей петли, как правило, хирургическое, при этом необходимо устранить анатомические условия, способствующие застою содержимого в приводящей петле вследствие механических причин. Операции: У-образный гастроеюнальный анастомоз, реконструкция гастроеюнального анастомоза в гастродуоденальный, наложение Брауновского соустья между двенадцатиперстной кишкой и тощей. Профилактика связана, прежде всего, с правильной хирургической методикой и техникой резекции желудка. А.А. Русанов (1956) и затем его последователи разработали правила резекции желудка по Гофмейстеру-Финстереру, позволяющие практически избежать болезни оперированного желудка. К ним относятся:
При наличии хронической дуоденальной непроходимости целесообразно отказаться от операции Гофмейстера-Финстерера, а выполнить ее по способу Ру.  Рис. 7.2. Резекция желудка по Ру. ПЕПТИЧЕСКАЯ ЯЗВА АНАСТОМОЗА Этиология и патогенез. Частота пострезекционных пептических язв колеблется от 0,5 до 10%. В подавляющем числе случаев (90—98%) пептические язвы соустья развиваются после резекции желудка, выполненной по поводу язвенной болезни двенадцатиперстной кишки. Следует знать, что нормальные цифры желудочной секреции для здорового человека являются высокими для больного с резецированным желудком. Причинами образования пептических язв могут быть недостаточное снижение продукции соляной кислоты вследствие чрезмерно экономной резекции желудка или неполной и неадекватной ваготомии, оставления части слизистой оболочки антрального отдела над культей двенадцатиперстной кишки, сужения гастродуоденостомы после операции ваготомии с пилоропластикой, а также экстрагастральные факторы, такие как синдром Золлингера-Эллисона, гиперпаратиреоз. Среди эндокринных симптоматических язв особое место занимает синдром Золлингера-Эллисона, в основе которого лежат образующие гастрин аденомы из Д-клеток поджелудочной железы и значительно реже других локализаций (желудок, двенадцатиперстная кишка, печень, надпочечники, гипофиз, паращитовидные железы). При синдроме Золлингера-Элллисона морфологическим субстратом в 90% случаев имеет место опухоль, в 10% – гиперплазия островкового аппарата. Около 60% опухолей бывают злокачественными и их метастазы гормонально активны. Мультицентрический рост имеют 20% опухолей. В 20-40% случаев опухоли локализуются вне поджелудочной железы – в парапанкреатической клетчатке или в стенке двенадцатиперстной кишки. В 25% случаев аденомы из Д-клеток поджелудочной железы сочетаются с аденомами других желез внутренней секреции (паращитовидных, гипофиза, надпочечников) это так называемый полигландулярный эндокринный аденоматоз, или синдром множественных эндокринных неоплазий 1-го типа. Иногда причиной образования язв служат аденомы паращитовидных желез. Повышение уровня желудочного сока обусловлено повышенным содержанием в плазме ионизированного кальция, воздействующего на париетальные клетки фундальных желез и опосредованного через увеличение высвобождения гастрина из G-клеток. При синдроме Золлингера-Эллисона гипергастринемия может быть обусловлена гиперплазией G-клеток антрального отдела желудка (это I тип синдрома Золлингера-Эллисона) или развитием опухоли из Д-клеток панкреатических отростков продуцирующих гастрин (II тип синдрома Золлингера-Эллисона, так называемая гастринома). Гипергастринемия при синдроме Золлингера-Эллисона вызывает два синергических эффекта: гиперстимуляцию париетальных клеток, тем самым увеличивая секрецию соляной кислоты, и увеличение секретирующих париетальных клеток. Локализация язв при синдроме Золлингера-Эллисона разнообразна (двенадцатиперстная кишка – 50-60%; желудок – 16-20%; пищевод и тонкая кишка 25-30%; множественные язвы 12-15%) Заболевание характеризуется наличием язв желудочно-кишечного тракта, выраженной гиперсекрецией желудочных желез, болями в животе и диареей. Характер боли как при язвенной болезни желудка или двенадцатиперстной кишки, но более интенсивные и не уменьшающиеся при антацидной терапии. При синдроме Золлингера-Эллисона очень высока базальная секреция желудочного сока как до операции, так и в послеоперационном периоде. Соотношение между базальной и стимулированной гистамином секрецией желудочного сока равно либо выше 60%. Патогномоничным является повышение уровня гастрина (15 мг/кг) или секретина (1 клин. ЕД/кг), уровень содержания гастрина в крови повышается, при язвенной болезни этот уровень неизменный. У здорового человека в 1 мл плазмы содержится 50-200 пг гастрина (1пг = 10-12 г). У больных синдромом Золлингера-Эллисона уровень гастрина выше 500 пг/мл. Диагноз заболевания устанавливается на основании клинических проявлений, магнитно-резонансной томографии, рентгенологических и эндоскопических данных, желудочной секреции и уровня гастрина в крови. Медикаментозное лечение (фамотидин, омепрозол, октреотид), как правило, безуспешно. При I типе синдрома Золлингера-Эллисона показана резекция желудка. При втором типе – удаление аденомы поджелудочной железы, резекция поджелудочной железы вместе с аденомой и при невозможности удаления опухоли – гастрэктомия. Операция в виде резекции желудка или ваготомии неэффективна. Необходимо отметить, что при синдроме Золлингера-Эллисона после удаления аденомы поджелудочной железы может в дальнейшем наступить рецидив язвы. Это связано с тем, что аденомы бывают множественными и оставленными (невыявленными) во время операции. Эти аденомы стимулируют выработку гастрина (Е.М. Благитко, 1997). В такой ситуации показана гастрэктомия. Клиническая картина и диагностика. Пептические язвы появляются в течение первых 3 лет после хирургического вмешательства, локализуются они в области анастомоза на линии шва (маргинальная язва), в отводящей петле, в культе желудка, в двенадцатиперстной кишке, нередко пенетрируя в брыжейку поперечно-ободочной кишки, в кишку, поджелудочную железу. Основным симптомом пептической язвы является интенсивная боль, более мучительная, чем до операции. Вначале боли носят периодический характер, усиливаясь после приема грубой острой пищи, затем светлые промежутки укорачиваются, боли становятся постоянными, жестокими, иррадиируют в спину, грудную клетку, плечо, основное место локалазиции болей — левое подреберье. Наблюдается также изжога, тошнота, рвота, возможны поносы, у других больных запоры. Пептические язвы нередко осложняются кровотечением, перфорацией, пенетрацией в другие органы. Больные обычно истощены, так как из-за болей избегают приема пищи. Диарея может привести к потере жидкости и электролитов, и прежде всего калия. При гипокалиемии развиваются мышечная слабость, парез кишечника, гипокалиемический алкалоз. Часто видна пигментация кожи живота от грелки. Установить диагноз помогает обнаружение свободной НСl в желудочном соке, рентгенологическое исследование, при котором находят нишу в области анастомоза или отводящей петле. Очень информативна эндоскопия и проведение уреазных тестов. Лечение. Если язва неосложненная, а кислотность невысокая, то целесообразна консервативная терапия в стационарных условиях с последующим санаторно-курортным лечением. Основной метод лечения при пептической язве — оперативный. Выбор операции при пептической язве зависит прежде всего от ее причины. Необходимо выбрать хирургическое вмешательство, максимально устраняющее все дефекты предыдущей операции. Применяются следующие операции:
НЕЗАЖИВШИЕ И РЕЦИДИВНЫЕ ЯЗВЫ ПОСЛЕ ВАГОТОМИИ Этиология и патогенез. Частота рецидивов язв после ваготомии колеблется от 2—30% и зависит от различных факторов. Основной причиной рецидива или незажившей язвы двенадцатиперстной кишки считается неадекватная ваготомия. В патогенезе рецидивов язв в желудке придается важное значение таким факторам, как нарушение желудочной эвакуации, дуоденогастралъный рефлюкс, снижение защитных свойств слизистой оболочки, нарушение кровоснабжения желудочной стенки. Клиническая картина и диагностика. Характерным признаком рецидивных язв является частая их бессимптомность (так называемые немые рецидивы). Необходимо различать язвы незажившие, обнаруженные на том же месте в сроки 2 недели — 1 месяц после ваготомии, и рецидивные, появляющиеся в более поздние сроки, через несколько лет. К основным методам диагностики относится фиброгастродуоденоскопия. Лечение. Лечение при незаживших и рецидивных язвах в принципе такое же, как и у больных с язвенной болезни желудка и двенадцатиперстной кишки, не подвергавшихся оперативному лечению, и зависит как от локализации язвы, так и от состояния желудочной секреции. Методом выбора при неподдающихся консервативному лечению рецидивных язвах является резекция желудка. Иногда при рецидиве язвы в двенадцатиперстной кишке и обнаружении во время повторной операции явно неадекватной денервации кислотопродуцирующей зоны вполне возможна и оправдана повторная ваготомия. ПОСТРЕЗЕКЦИОННАЯ (АГАСТРАЛЬНАЯ) АСТЕНИЯ Этиология и патогенез. Пострезекционная астения возникает вследствие резкого нарушения пищеварительной функции желудка, поджелудочной железы, печени и тонкой кишки. Культя желудка при этом почти полностью теряет свою пищеварительную функцию ввиду малого размера и быстрой эвакуации пищи в кишечник. В слизистой оболочке культи желудка, двенадцатиперстной и тонкой кишки развиваются атрофические изменения. Ахлоргидрия приводит к значительному снижению переваривающей функции желудочного сока, размножению в тонкой кишке патогенной флоры, еюниту, дуодениту, холециститу и гепатиту, снижению антитоксической функции печени, дисбактериозу и гиповитаминозу. В результате нарушения процессов переваривания и всасывания нарушается обмен белков, жиров и углеводов, микроэлементов, развивается поливитаминная недостаточность. Клиническая картина и диагностика. У больных постепенно нарастает астени-зация психической и соматической сферы, что проявляется повышенной раздражительностью, вспыльчивостью, плаксивостью, конфликтностью, апатией, аутизмом и др. Больные страдают бессонницей, головной болью, головокружением. Могут возникать отеки, исхудание, понос, кожные и эндокринные нарушения. Перечисленные изменения выражены тем сильнее, чем больший объем желудка удален. В диагностике данного синдрома имеют значение ФГС, рентгенография желудка, изучение белковых фракций крови, копрограммы. Лечение. При легкой степени пострезекционной астении показана консервативная терапия — переливание крови, плазмы, альбумина и протеина, белковых препаратов. Одновременно проводят коррекцию нарушений водно-электролитного обмена, назначают лечение витаминами. Для улучшения процессов синтеза белка используют анаболические гормоны. Диета должна быть богата белками, жирами и углеводами. Заместительная терапия включает прием НСl и пепсина, ферментных препаратов и др. При тяжелых степенях заболевания такое лечение служит в качестве предоперационной подготовки. Оперативное лечение предусматривает включение в пассаж двенадцатиперстной кишки. ЩЕЛОЧНОЙ РЕФЛЮКС-ГАСТРИТ Этиология и патогенез. Основной причиной возникновения щелочного рефлюкс-гастрита является удаление или повреждение привратника при резекции желудка или ваготомии с дренирующими операциями. Ведущее значение в патогенезе щелочного рефлюкс-гастрита отводится дуоденогастральному рефлюксу. Заброс дуоденального содержимого в культю желудка после резекции или в желудок после ваготомии в условиях сниженной кислотопродукции или ахлоргидрии вызывает повреждение защитного барьера слизистой оболочки желудка с развитием выраженного воспалительного процесса. Клиническая картина и диагностика. Основные клинические проявления щелочного рефлюкс-гастрита включают боль в эпигастральной области, отрыжку горечью, рвоту желчью и потерю массы тела. Боль постоянная, усиливается после еды и почти не облегчается приемом антацидов и рвотой. По тяжести клинического течения различают легкий, средний и тяжелый рефлюкс-гастрит (Е.В. Гук, 1991). Диагноз щелочного рефлюкс-гастрита подтверждается изучением функционального состояния желудка с помощью желудочной секреции, определением концентрации желчных кислот, и особенно эндоскопическим исследованием с биопсией слизистой. При эндоскопическом исследовании определяется поверхностный, атрофический или очаговый гастрит иногда с множественными эрозиями. В биоптате обнаруживается воспалительная реакция, подслизистые кровоизлияния, отек и эрозии слизистой оболочки. Лечение. Консервативная терапия направлена на улучшение гастродуоденальной моторики, связывание агрессивных компонентов дуоденального содержимого, улучшение состояния защитного барьера слизистой оболочки культи желудка. Лечение эффективно только при легких и средних степенях рефлюкс-гастрита и включает применение билигнина, холестирамина, связывающих желчные кислоты, щадящую диету, антацидные, вяжущие и обволакивающие лекарственные препараты. Эффект могут оказать средства, усиливающие эвакуацию из желудка (метоклопрамид), блокаторы Н2-рецепторов. У больных с тяжелой степенью щелочного рефлюкс-гастрита, сопровождающегося выраженными постоянными симптомами, не поддающимися консервативной терапии, показана операция. Основная цель операции при щелочном рефлюкс-гастрите — ликвидирование дуоденогастрального рефлюкса. Для этого у больных, которым была произведена ваготомия с дренирующей операцией, проводят реконструкцию привратника, а у больных с резекцией желудка наибольшее распространение получила реконструкция анастомоза по Ру, дополненная ваготомией (для профилактики пептической язвы соустья). РЕФЛЮКС-ЭЗОФАГИТ Этиология и патогенез. В основе развития этого заболевания лежит забрасывание желудочного и кишечного содержимого в пищевод вследствие недостаточности запирательной функции пищеводно-желудочного перехода. В результате механического и химического воздействия на слизистую оболочку пищевода (как правило, нижней его трети) возникает эзофагит, который может быть катаральным, фибринозным, эрозивным или язвенно-некротическим. Тяжелый рефлюкс-эзофагит нередко заканчивается формированием рубцовой пептической стриктуры пищевода. Клиническая картина и диагностика. Характерной для клинической картины рефлюкс-эзофагита является жгучая боль за грудиной, иногда сопровождающаяся гиперсаливацией, усиливающаяся при наклоне туловища вперед. Второй характерной жалобой является мучительная изжога, появляющаяся через 1,5—2 часа после еды. Нередко возникает дисфагия, особенно после приема горячей или холодной пищи, что обусловлено эзофагоспазмом и дискоординацией моторики воспаленного пищевода. Диагноз подтверждают рентгенологическим и эндоскопическим исследованиями. Лечение. Лечение при послеоперационном рефлюкс-эзофагите преимущественно консервативное. Важную роль играют щадящая диета (как при язвенной болезни) и режим питания. Пищу следует принимать часто и небольшими порциями. Перед приемом пищи следует проглотить ложку растительного масла. Последний прием пищи должен быть за 3—4 часа до отхода ко сну. В промежутках между приемами пищи не рекомендуется принимать жидкость. Спать рекомендуется с приподнятым головным концом. Нельзя заниматься тяжелым физическим трудом и работать при наклоне туловища вперед. Медикаментозное лечение заключается в назначении антацидных препаратов, обволакивающих, вяжущих и спазмолитических средств, а также лекарств, улучшающих пропульсивную моторику пищевода и желудка (церукал). При неэффективности консервативного лечения показано оперативное лечение. Наиболее оптимальным являются антирефлюксные вмешательства типа фундопликации, при необходимости (повышенная желудочная гиперсекреция) сочетающиеся с ваготомией. У больных с пептическими стриктурами применяют бужирование до операции и после выполнения антирефлюксной операции. При пенетрирующих пептических язвах пищевода или при подозрении на злокачественное перерождение показана экстирпация пищевода. ПОСЛЕОПЕРАЦИОННАЯ ДИАРЕЯ Этиология и патогенез. Диарея редко встречается после резекции желудка и селективной проксимальной ваготомии, но считается характерным осложнением стволовой ваготомии в сочетании с дренирующими желудок операциями (М.И. Кузин и соавт., 1986; А.Ф. Черноусов и соавт., 1996). О наличии постваготомической диареи можно говорить при частоте жидкого стула больше 3 раз в сутки. Частота ее колеблется после этой операции от 2 до 40%. Причинами постваготомической диареи являются нарушение моторики желудочно-кишечного тракта, ахлоргидрия и дисбактериоз, быстрый кишечный транзит и мальабсорбция желчных кислот. В патогенезе диареи имеет значение денервация печени, поджелудочной железы, нарушение секреции и процесса конъюгации желчных кислот, которые в большом количестве поступают в толстую кишку, что вызывает экскрецию значительного количества жидкости. Это может быть связано также с большой скоростью эвакуации химуса из тонкой кишки в толстую, что и вызывает понос. Клиническая картина и диагностика. В зависимости от тяжести клинической картины различают три степени диареи: легкую, среднюю и тяжелую. При легкой степени могут быть частые позывы на стул или понос 2—3 раза в неделю. При средней степени тяжести бывают периодические эпизоды диареи в течение нескольких дней или жидкий стул ежедневно от 3 до 5 раз в сутки. При тяжелой степени внезапная обильная диарея бывает больше 5 раз в сутки, такие эпизоды приступов длятся от 3 до 5 дней и приводят к прогрессирующему ухудшению состояния больного. В диагностике помогает контрастная рентгенография желудочно-кишечного тракта, изучение копрограммы. Лечение комплексное. Следует обращать внимание на связь диареи с недостаточностью внешнесекреторной функции поджелудочной железы с дисбактериозом, демпинг-синдромом и другими факторами. Применяют препараты, замедляющие моторику кишечника (фосфат кодеина), агенты, связывающие желчные соли (холестирамин), слабые растворы минеральных кислот (хлористо-водородной, лимонной), антибиотики широкого спектра действия, а также ферментные препараты, улучшающие пищеварение (фестал, мексазе и др.). Иногда хороший эффект оказывает бензогексоний. При отсутствии эффекта от консервативного лечения применяют реверсию сегментов тонкой кишки длиной 10—20 см в 100—120 см от связки Трейтца. Профилактика постваготомической диареи состоит в сохранении иннервации печени, поджелудочной железы и тонкой кишки, что достигается более широким применением селективной проксимальной ваготомии. Диспансеризация Диспансерное наблюдение больных в амбулаторно-поликлинических условиях осуществляется согласно приказу Министра здравоохранения СССР № 770 от 30.05.86 г. После резекции желудка динамическое наблюдение осуществляется хирургом (2 раза в год), одновременно необходима консультация терапевтом. Выполняется анализ крови клинический – 2 раза в год, анализ мочи – 1 раз в год, рентгенологическое исследование по показаниям. Лечебно-оздоровительные мероприятия заключаются в назначении режима, диеты, санаторно-курортного лечения, трудоустройства – по показаниям. Критерием эффективности диспансеризации является отсутствие нетрудоспособности. Через 1 год больные передаются под наблюдение терапевта. РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
|
