константа. Цель работы Определить константу скорости реакции окисления иодида персульфатом аммония при заданных начальных концентрациях реагентов. Оборудование и реактивы
 Скачать 21.16 Kb. Скачать 21.16 Kb.
|
|
Цель работы Определить константу скорости реакции окисления иодида персульфатом аммония при заданных начальных концентрациях реагентов. Оборудование и реактивы Бюретка объемом 25 мл – 4 шт.; мерная пипетка объемом 5 мл (для крахмала) – 1 шт.; секундомер; колба круглая объемом 100 мл – 5 шт.; химический стакан объемом 50 мл – 5 шт; химический стакан объемом 25 мл (для персульфата) – 1 шт.; иодид калия – 0,2 М раствор; тиосульфат натрия – 0,02 М раствор; крахмал – 1 % раствор; персульфат аммония – 0,2 М раствор. Экспериментальные данные: Концентрация раствора иодида калия – 0,2 моль/л Концентрация раствора тиосульфата натрия – 0,002 моль/л Концентрация раствора персульфата аммония (или натрия) – 0,2 моль/л
Обработка экспериментальных данных:
Пример обработки экспериментальных данных для опыта №1: 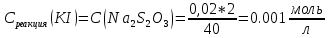 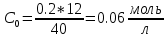 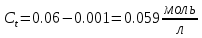 Расчет погрешностей эксперимента: Среднее значение константы скорости реакции: 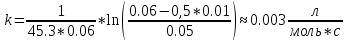 Вероятная ошибка определения средней константы скорости процесса для (t=95%): : 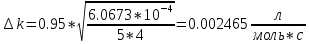 Относительная погрешность: 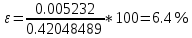 Вывод В данной лабораторной работе были определены константа нестойкости, свободная энергия диссоциации на ионы, свободная энергия образования для трех комплексов: [FeCNS]2+; [Fe(CNS)2]+; [Fe(CNS)3]0. Проанализировав полученные данные можно сделать вывод об устойчивости комплекса на основании значения константы нестойкости: чем глубже проходит процесс образования ионов комплекса, тем меньше значение его константы нестойкости и тем он устойчивее. Опираясь на таблицу 4 можно прийти к выводу, что чем меньше константа нестойкости комплекса, тем большую энергию необходимо прикладывать для разрыва химических связей и диссоциации комплекса – значит, комплекс более устойчив. При этом для образования более устойчивого комплекса затрачивается так же большая энергия образования. Среднее расхождение экспериментальных энергий Гиббса образования комплексов от их теоретического значения составило 6,4%. Данное расхождение вызвано отличием объемов фактических растворов от теоретических, неточностью вычислений (округлением некоторых величин), а также неточностью линейной аппроксимации, с помощью которой были определены константы нестойкости. Небольшая относительная погрешность свидетельствует о верно осуществленной методике эксперимента и достижении цели работы. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

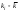
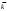 =0,002465073
=0,002465073