Ответы на вопросы по иммунологии. Человека строение и функции. 1
 Скачать 289.38 Kb. Скачать 289.38 Kb.
|
ОглавлениеИммунная система человека: строение и функции. 1 Центральные органы иммунной системы: их строение и функции. 1 Периферические органы иммунной системы: их строение и функции. 2 Понятие об иммунитете. 3 Виды иммунитета. 4 Основные группы клеток иммунной системы. 5 Характеристика клеток врожденного иммунитета (нейтрофилы, макрофаги). 7 Т-лимфоциты: строение, происхождение, дифференцировка, субпопуляции, функции. 10 В-лимфоциты: строение, происхождение, дифференцировка, функции. 12 Функции NK-клеток, макрофагов, дендритных клеток, нейтрофилов. 14 Общая характеристика молекул иммунной системы. 15 Иммунная система человека: строение и функции.Структура иммунной системы. Иммунная система представлена лимфоидной тканью. Это специализированная, анатомически обособленная ткань, разбросанная по всему организму в виде различных лимфоидных образований. К лимфоидной ткани относятся вилочковая, или зобная, железа, костный мозг, селезенка, лимфатические узлы (групповые лимфатические фолликулы, или пейеровы бляшки, миндалины, подмышечные, паховые и другие лимфатические образования, разбросанные по всему организму), а также циркулирующие в крови лимфоциты. Лимфоидная ткань состоит из ретикулярных клеток, составляющих остов ткани, и лимфоцитов, находящихся между этими клетками. Основными функциональными клетками иммунной системы являются лимфоциты, подразделяющиеся на Т- и В-лимфоциты и их субпопуляции. Общее число лимфоцитов в человеческом организме достигает 1012, а общая масса лимфоидной ткани составляет примерно 1—2 % от массы тела. Лимфоидные органы делят на центральные (первичные) и периферические (вторичные). Функции иммунной системы. Иммунная система выполняет функцию специфической зашиты от антигенов, представляющую собой лимфоидную ткань, способную комплексом клеточных и гуморальных реакций, осуществляемых с помощью набора иммунореагентов, нейтрализовать, обезвредить, удалить, разрушить генетически чужеродный антиген, попавший в организм извне или образовавшийся в самом организме. Специфическая функция иммунной системы в обезвреживании антигенов дополняется комплексом механизмов и реакций неспецифического характера, направленных на обеспечение резистентности организма к воздействию любых чужеродных веществ, в том числе и антигенов. Центральные органы иммунной системы: их строение и функции.Центральные: костный мозг и тимус. В центральных органах иммунной системы постоянно идут процессы пролиферации клеток-предшественниц Т- и В-лимфоцитов, их созревания (дифференцировки), их отбора (селекции), сопровождающиеся их частичной гибелью или транспортировкой созревающих клеток через кровь в периферические органы. Костный мозг – орган кроветворения и центральный орган иммунной системы. Выделяют красный костный мозг, который у взрослого человека располагается в ячейках губчатого вещества плоских и коротких костей, а также в эпифизах трубчатых костей, и желтый костный мозг, заполняющий полости в диафизах трубчатых костей. В детском возрасте все костномозговые полости заполнены красным костным мозгом. Общая масса костного мозга составляет 2,5 – 3 кг (от 4 до 5% массы тела). Красный костный мозг состоит из миелоидной (кровеобразующей) и лимфоидной ткани. В красном костном мозге находятся также стволовые клетки – родоначальники всех видов клеток крови и иммунной системы, обладающие способностью к многократному (до 100 раз) делению. Тимус располагается позади тела грудины. Он состоит из двух удлиненных асимметричных по величине правой и левой долей. Каждая доля разделена на многочисленные дольки размером от 1 до 10 мм. Периферию долек образует более темное корковое вещество, а центральную часть – более светлое мозговое вещество. Строма тимуса образована многоотросчатыми эпителиоретикулоцитами, формирующими сеть, в петлях которой располагаются Т-лимфоциты и их предшественники. Эпителиоретикулоциты вырабатывают биологически активные вещества (тимозин, тимопоэтин), которые оказывают влияние на дифференцировку Т-лимфоцитов. В мозговом веществе Эпителиоретикулоциты образуют слоистые структуры – химические тельца (тельца Гассаля). Образование Т-лимфоцитов происходит преимущественно в корковом веществе, откуда они перемещаются в мозговое вещество и мигрируют в кровеносное русло. Периферические органы иммунной системы: их строение и функции.Периферические: селезенка, лимфатические узлы, лимфоидная ткань ассоциированная со слизистыми. Периферические органы иммунной системы являются местом встречи Т-и В-лимфоцитов с поступающими туда антигенами, местом распознавания антигенов и развития последовательных стадий специфического иммунного ответа на данный антиген. Распознавание антигена лимфоцитом служит сигналом его усиленной пролиферации, ускоренной дифференцировки и активации. В-лимфоциты после активации в периферических органах иммунной системы дифференцируются в плазматические клетки, продуцирующие и секретирующие антитела — иммуноглобулины. Активированные Т- и В-лимфоциты в периферических органах иммунной системы продуцируют и секретируют межклеточные медиаторы — цитокины, влияющие на иммунный ответ. Там же, в периферических органах иммунной системы, накапливаются и сохраняются долгоживущие Т- и В-лимфоциты, ответственные за поддержание «иммунологической памяти» о встрече с данным антигеном. Миндалины представляют собой скопление лимфоидной ткани, в которой располагаются небольших размеров структуры (0,2 – 1 мм) с плотно расположенными в них лимфоцитами – лимфоидные узелки. Одиночные лимфоидные узелки, располагающиеся в слизистой оболочке органов пищеварительной, дыхательной систем и мочевыводящих путей, представляют собой плотные скопления лимфоцитов, образующие структуры шаровидной или яйцевидной формы. Залегая под эпителием слизистой оболочки на близком расстоянии друг от друга, лимфоидные узелки, как сторожевые посты, защищают слизистую оболочку и организм в целом от проникновения в нее генетически чужеродных частиц и микроорганизмов. Внутри многих лимфоидных узелков образуются собственные центры размножения. В случае антигенной опасности начинается быстрое размножение лимфоцитов в лимфоидных узелках. В слизистой оболочке тонкой кишки расположены лимфоидные бляшки, представляющие собой скопления лимфоидных узелков. Лимфоидные бляшки, как правило, имеют овальную форму и чуть-чуть выступают в просвет кишки. На месте лимфоидных бляшек ворсинки слизистой оболочки отсутствуют. Лимфоидные бляшки в тонкой кишке, где происходит основное всасывание продуктов переваривания пищи, препятствуют проникновению в кровеносное и лимфатическое русло чужеродных веществ. Червеобразный отросток – аппендикс также является органом иммунной системы. В его стенках имеется огромное количество лимфоидных узелков (до 550), плотно прилежащих друг к другу. Аппендикс расположен на границе между тонкой и толстой кишкой, является важным органом в функциях иммунной защиты организма. Лимфатические узлы расположены на путях тока лимфы от органов и тканей к лимфатическим стволам и протокам. В лимфатических узлах задерживаются и уничтожаются чужеродные частицы, микробные тела, собственные погибшие клетки, попавшие в просвет лимфатических сосудов в момент всасывания в них тканевой жидкости. Лимфатические узлы располагаются группами, состоящими из двух и более узлов. Каждый лимфатический узел имеет соединительнотканную капсулу, от которой внутрь узла отходят пучки соединительной ткани – трабекулы. В паренхиме лимфатического узла выделяют корковое и мозговое вещество. Корковое вещество занимает периферические отделы узла. В корковом веществе расположены лимфоидные узелки. В центральных отделах лимфатического узла находится мозговое вещество. Паренхима мозгового вещества представлена тяжами лимфоидной ткани – мякотными тяжами, которые простираются от внутренних отделов коркового вещества до ворот лимфатического узла. Пограничная с мозговым веществом часть коркового вещества получила название паракортикальной или тимусзависимой зоны. Под капсулой лимфатического узла, а также вдоль соединительнотканных трабекул и мякотных тяжей лежат узкие щели – лимфатические синусы, внутри которых находятся мелкоячеистые сети, образованные ретикулярными волокнами. По этим синусам течет лимфа от приносящих сосудов к выносящим лимфатическим сосудам. Во время тока лимфы по синусам сквозь сети из ретикулярных волокон задерживаются погибшие клетки, микробные тела и другие чужеродные вещества, присутствующие в лимфе. Все эти чужеродные вещества распознаются и уничтожаются лимфоцитами, проникающими внутрь синусов из лимфоидной паренхимы. Таким образом, лимфатические узлы задерживают любые чужеродные частицы, которые попали в организм, и препятствуют их проникновению из органов и тканей в ток крови. Селезенка располагается в брюшной полости в левом подреберье. Это единственный орган, контролирующий состав крови. Масса селезенки составляет 150 – 200 г. Снаружи она имеет соединительнотканную капсулу, от которой внутрь органа отходят трабекулы. Между трабекулами находится мякоть селезенки, ее пульпа. Выделяют белую и красную пульпы, в которых разветвляются артериальные сосуды – пульпарные артерии. Белая пульпа представлена типичной лимфоидной тканью, включает расположенные вокруг пульпарных артерий периартериальные лимфоидные муфты, лимфоидные узелки и эллипсоиды, окружающие кровеносные капилляры. Красная пульпа, занимающая до 78% всего объема селезенки, состоит из ретикулярной стромы, в петлях которой находятся лимфоциты, лейкоциты, макрофаги, погибшие эритроциты и другие клетки. Образованные этими клетками тяжи располагаются между селезеночными венозными синусами. Протекающая по пульпарным артериям кровь контролируется лимфоидными клетками периартериальных лимфоидных муфт, эллипсоидов и лимфоидных узелков. Распознанные чужеродные элементы в синусах селезенки захватываются макрофагами, которые переносят их в красную пульпу. Здесь они уничтожаются. Продукты уничтожения чужеродных веществ поступают по воротной вене с кровью в печень, где они утилизируются. Понятие об иммунитете.Иммунитет – это способ защиты организма от генетически чужеродных веществ – антигенов экзогенного и эндогенного происхождения, направленный на поддержание и сохранение гомеостаза, структурной и функциональной целостности организма, биологической (антигенной)индивидуальности каждого организма и вида в целом. Различают несколько основных видов иммунитета: врожденный, или видовой иммунитет, он же наследственный, генетический, конституциональный и приобретенный иммунитет. Иммунное состояние, т. е. активный иммунитет, может поддерживаться, сохраняться либо в отсутствие, либо только в присутствии антигена в организме. В первом случае антиген играет роль пускового фактора, а иммунитет называют стерильным. Во втором случае иммунитет трактуют как нестерильный. Примером стерильного иммунитета является поствакцинальный иммунитет при введении убитых вакцин, а нестерильного— иммунитет при туберкулезе, который сохраняется только в присутствии в организме микобактерий туберкулеза. Иммунитет (резистентность к антигену) может быть системным, т. е. генерализованным, и местным, при котором наблюдается более выраженная резистентность отдельных органов и тканей, например слизистых верхних дыхательных путей (поэтому иногда его называют мукозальным). Виды иммунитета.Различают несколько основных видов иммунитета. Врожденный, иди видовой, иммунитет, он же наследственный, генетический, конституциональный — это выработанная в процессе филогенеза генетически закрепленная, передающаяся по наследству невосприимчивость данного вида и его индивидов к какому-либо антигену (или микроорганизму), обусловленная биологическими особенностями самого организма, свойствами данного антигена, а также особенностями их взаимодействия. Примером может служить невосприимчивость человека к некоторым возбудителям, в том числе к особо опасным для сельскохозяйственных животных (чума крупного рогатого скота, болезнь Ньюкасла, поражающая птиц, оспа лошадей и др.), нечувствительность человека к бактериофагам, поражающим клетки бактерий. К генетическому иммунитету можно также отнести отсутствие взаимных иммунных реакций на тканевые антигены у однояйцовых близнецов; различают чувствительность к одним и тем же антигенам у различных линий животных, т. е. животных с различным генотипом. Видовой иммунитет может быть абсолютным и относительным. Например, нечувствительные к столбнячному токсину лягушки могут реагировать на его введение, если повысить температуру их тела. Белые мыши, не чувствительные к какому-либо антигену, приобретают способность реагировать на него, если воздействовать на них иммунодепрессантами или удалить у них центральный орган иммунитета — тимус. Приобретенный иммунитет — это невосприимчивость к антигену чувствительного к нему организма человека, животных и пр., приобретаемая в процессе онтогенеза в результате естественной встречи с этим антигеном организма, например, при вакцинации. Примером естественного приобретенного иммунитета у человека может служить невосприимчивость к инфекции, возникающая после перенесенного заболевания, так называемый постинфекционный иммунитет (например, после брюшного тифа, дифтерии и других инфекций), а также «проиммуниция», т. е. приобретение невосприимчивости к ряду микроорганизмов, обитающих в окружающей среде и в организме человека и постепенно воздействующих на иммунную систему своими антигенами. Широко используют преднамеренную иммунизацию антигенами для создания к ним невосприимчивости организма. С этой целью применяют вакцинацию, а также введение специфических иммуноглобулинов, сывороточных препаратов или иммунокомпетентных клеток. Приобретаемый при этом иммунитет называют поствакцинальным, и служит он для защиты от возбудителей инфекционных болезней, а также других чужеродных антигенов. Приобретенный иммунитет может быть активным и пассивным. Активный иммунитет обусловлен активной реакцией, активным вовлечением в процесс иммунной системы при встрече с данным антигеном (например, поствакцинальный, постинфекционный иммунитет), а пассивный иммунитет формируется за счет введения в организм уже готовых иммунореагентов, способных обеспечить защиту от антигена. К таким иммунореагентам относятся антитела, т. е. специфические иммуноглобулины и иммунные сыворотки, а также иммунные лимфоциты. Поскольку в формировании иммунитета принимают участие клетки иммунной системы и гуморальные факторы, принято активный иммунитет дифференцировать в зависимости от того, какой из компонентов иммунных реакций играет ведущую роль в формировании защиты от антигена. В связи с этим различают клеточный, гуморальный, клеточно-гуморальный и гуморально-клеточный иммунитет. Примером клеточного иммунитета может служить противоопухолевый, а также трансплантационный иммунитет, когда ведущую роль в иммунитете играют цитотоксические Т-лимфоциты-киллеры; иммунитет при токсинемических инфекциях (столбняк, ботулизм, дифтерия) обусловлен в основном антителами (антитоксинами); при туберкулезе ведущую роль играют иммунокомпетентные клетки (лимфоциты, фагоциты) с участием специфических антител; при некоторых вирусных инфекциях (натуральная оспа, корь и др.) роль в защите играют специфические антитела, а также клетки иммунной системы. В инфекционной и неинфекционной патологии и иммунологии для уточнения характера иммунитета в зависимости от природы и свойств антигена пользуются также такой терминологией: антитоксический, противовирусный, противогрибковый, противобактериальный, противопротозойный, трансплантационный, противоопухолевый и другие виды иммунитета. Наконец, иммунное состояние, т. е. активный иммунитет, может поддерживаться, сохраняться либо в отсутствие, либо только в присутствии антигена в организме. В первом случае антиген играет роль пускового фактора, а иммунитет называют стерильным. Во втором случае иммунитет трактуют как нестерильный. Примером стерильного иммунитета является поствакцинальный иммунитет при введении убитых вакцин, а нестерильного— иммунитет при туберкулезе, который сохраняется только в присутствии в организме микобактерий туберкулеза. Основные группы клеток иммунной системы.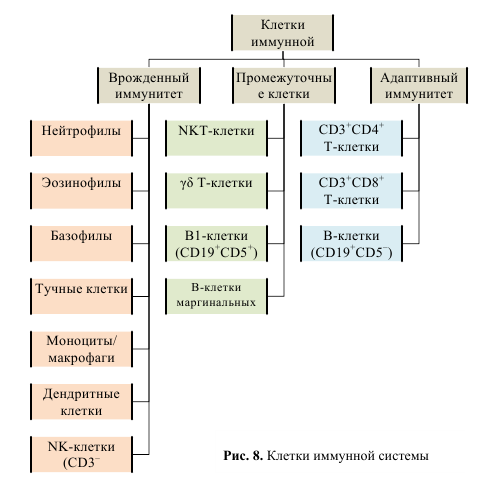 Клетки иммунной системы условно разделяют на клетки врожденного и адаптивного иммунитета. Главным различием этих клеток является специфичность распознавания АГ. Клетки врожденного иммунитета характеризуются низкой специфичностью распознавания АГ, клетки адаптивного иммунитета характеризуются высокой специфичностью в распознавании АГ. Существует и третья группа клеток – промежуточная, несущая признаки обеих групп. 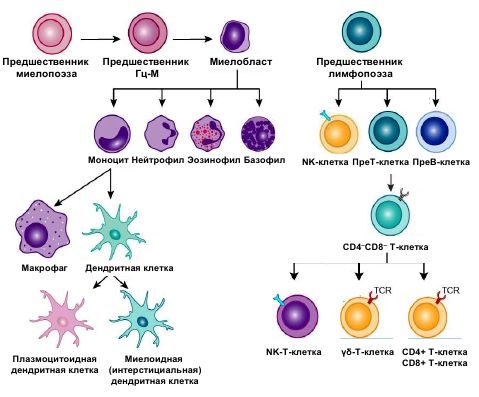 Клетки врожденного иммунитета: Естественные киллеры (ЕК, NK-клетки) не имеют специфического рецептора к антигену. Однако они разрушают клетки-мишени, инфицированные вирусом или опухолевые (неиммунный цитолиз). Выделяют цитотоксический белок перфорин (сходен с МАК комплемента), ФНОb, ферменты гранзимы. Естественные киллеры вызывают апоптоз посредством взаимодействия рецептора апоптоза CD95 с Fas-лигандом этих клеток. Система мононуклеарных фагоцитов Эта система объединяет моноциты крови и различные макрофаги (купферовские клетки печени – звездчатые эндотелиоциты, альвеолярные макрофаги, мезангиальные макрофаги, макрофаги соединительной ткани, астроциты глии, остеокласты). Созревают под влиянием гранулоцитарно-макрофагальных колониестимулирующих факторов (ГМ-КСФ), выделяемых Т-лимфоцитами, фибробластами и макрофагами. Функции макрофагов
Нейтрофилы. Их увеличение в крови – нейтрофилия – наблюдается при воспалении и инфекциях. Азурофильные гранулы содержат глюкуронидазу, катепсины, кислые гидролазы, кислые и нейтральные протеазы, эластазу, миелопероксидазу. В специфических гранулах находятся коллагеназа, лизоцим, белок, связывающий витамин B12. Основной функцией нейтрофилов является фагоцитоз чужеродных объектов (бактерий, клеток), после чего они превращаются в «гноеродные тельца» – составную часть гноя. При фагоцитозе происходит усиление метаболизма по гексозомонофосфатному пути с активацией клеточного дыхания – "респираторного взрыва" и из гранул высвобождаются ферменты. Через высокоаффинные Fc-рецепторы, появляющиеся после активации, нейтрофилы связывают IgG и IgE-антитела и за счет них могут специфично взаимодействовать с антигенами и аллергенами. Базофилы (0,5-1% в крови) участвуют в аллергических реакциях. На поверхности базофилов имеется от 6000 до 60000 высокоаффинных Fc-рецепторов, связывающих IgE. В гранулах базофилов содержится большое количество медиаторов аллергии. Эозинофилы играют большую роль в противопаразитарном иммунитете и аллергии. В норме в крови их 0,5-3%, созревают под действием ИЛ-5. При аллергии и паразитарных инвазиях количество их в крови увеличивается до 10-20% – эозинофилия. Система антигенпредставляющих клеток (АПК). Дендритные клетки Антигенпредставляющие клетки (АПК) – это гетерогенная популяция лейкоцитов с весьма выраженной иммуностимулирующей активностью. Большая часть АПК обеспечивает активацию Т-хелперов, некоторые взаимодействуют с другими клетками иммунной системы. Главную роль в системе АПК играют дендритные клетки (ДК). Клетки приобретенного иммунитета - клетки, способные специфически распознавать антиген и отвечать на него иммунной реакцией. Такими клетками являются Т- и В-лимфоциты (тимусзависимые и костномозговые лимфоциты), которые под влиянием чужеродных агентов дифференцируются в сенсибилизированный лимфоцит и плазматическую клетку. Т-лимфоциты – это сложная по составу группа клеток, которая происходит от полипотентной стволовой клетки костного мозга, а созревает и дифференцируется в тимусе из предшественников. Т-лимфоциты разделяются на две субпопуляции: иммунорегуляторы и эффекторы. Задачу регуляции иммунного ответа выполняют Т-хелперы. Эффекторную функцияю осуществляют Т-киллеры и естественные киллеры. В орагнизме Т-лимфоциты обеспечивают клеточные формы иммунного ответа, определяют силу и продолжительность иммунной реакции. B-лимфоциты – преимущественно эффекторные иммунокомпетентные клетки. Зрелые В-лимфоциты и их потомки – плазматические клетки являются антителопродуцентами. Их основными продуктами являются иммуноглобулины. В-лимфоциты участвуют в формировании гуморального иммунитета, В-клеточной иммунологической памяти и гиперчувствительности немедленного типа. Макрофаги - клетки соединительной ткани, способные к активному захвату и перевариванию бактерий, остатков клеток и других чужеродных для организма частиц. Основная функция макрофагов сводится к борьбе с теми бактериями, вирусами и простейшими, которые могут существовать внутри клетки-хозяина, при помощи мощных бактерицидных механизмов. Роль макрофагов в иммунитете исключительно важна - они обеспечивают фагоцитоз, переработку и представление антигена T-клеткам. Характеристика клеток врожденного иммунитета (нейтрофилы, макрофаги).Клеточное звено врожденного иммунитета представлено полиморфно-ядерными лейкоцитами (нейтрофилами, эозинофилами, базофилами), моноцитами/макрофагами, дендритными клетками, натуральными киллерами и тучными клетками, или тканевыми базофилами. Согласно современной схеме кроветворения все клетки врожденной системы иммунитета развиваются из стволовой гемопоэтической клетки, дающей начало двум типам полустволовых клеток – общему предшественнику миелопоэза и общему предшественнику лимфопоэза . Из миелоидной клетки-предшественника образуется еще одна прогениторная клетка – предшественник гранулоцитов и моноцитов, от которого берут начало полиморфно-ядерные лейкоциты (нейтрофилы, эозинофилы, базофилы) и моноциты. Полиморфно-ядерные лейкоциты. Популяция полиморфно-ядерных лейкоцитов (гранулоцитов) представлена короткоживущими фагоцитирующими клетками, содержащими большое количество лизосом, ферменты которых способны разрушать поглощенные микроорганизмы. Для всех гранулоцитов характерны следующие морфологические особенности: наличие в цитоплазме специфической зернистости и сегментированного ядра; по особенностям окраски специфической зернистости гранулоциты подразделяются на три вида: нейтрофильные, эозинофильные и базофильные. Жизненный цикл гранулоцитов состоит из трех этапов: 1) развитие в костном мозге; 2) кратковременная циркуляция в кровеносном русле; 3) выселение в ткани для выполнения своих функций. Нейтрофилы. Нейтрофилы, циркулирующие в периферической крови, составляют 60-70% от общего количества лейкоцитов. Образуются нейтрофилы в костном мозге, являясь продуктом миелоидного кроветворения. По степени зрелости нейтрофилы делятся на сегментоядерные, палочкоядерные и юные формы. Костный мозг покидают дефинитивные формы дифференцировки клеток – сегментоядерные нейтрофилы, но в небольшом количестве (1-6%) в периферический кровоток могут выходить палочкоядерные нейтрофилы и юные нейтрофилы (0,5%). После выхода из костного мозга нейтрофилы циркулируют с током крови 8-12 часов, после чего выходят в ткани, где живут 2-3 дня и погибают путем апоптоза. В очаге воспаления продолжительность жизни нейтрофилов резко сокращается и составляет 1- 4 часа. В цитоплазме клеток обнаруживаются три типа гранул: первичные гранулы (азурофильные), вторичные гранулы (специфические) и секреторные везикулы. Азурофильные гранулы представляют видоизмененные первичные лизосомы, содержащие набор гидролитических ферментов (кислых протеаз и гидролаз). Специфические гранулы по химическому составу отличаются от азурофильных гранул, и сливаются с фагосомой уже после азурофильных гранул. Маркером специфических гранул является белок лактоферрин. Секреторные везикулы необходимы нейтрофилам для восстановления цитоплазматической мембраны, утраченной в процессе фагоцитоза. Основная функция нейтрофильных гранулоцитов – фагоцитоз и участие в воспалительных реакциях. Нейтрофильные гранулоциты первыми приходят в очаг воспаления и обнаруживаются там уже через 30-60 минут. Главным хемоаттрактантом для нейтрофилов является хемокин IL-8, под влиянием которого они мигрируют в очаг воспаления. Для распознавания и фагоцитоза неопсонизированных микроорганизмов на плазмолемме нейтрофилов имеются TLR1, TLR2 и TLR6, образующие единый комплекс, лигандами которого являются липопептиды, липотейхоевые кислоты, пептидогликаны бактериальной стенки и зимозан. Эозинофилы Составляют 1-5% лейкоцитов, циркулирующих в крови. Эозинофилы развиваются в костном мозге, где они созревают в течение 5 дней. Дифференцировка эозинофилов происходит под влиянием аутокринных и паракринных цитокинов IL-3, IL-5 и CSF-GM. Зрелые эозинофилы выходят из костного мозга в периферический кровоток, где они циркулируют 18-24 часа, после чего выходят в органы, контактирующие с внешней средой (слизистые оболочки воздухоносных путей, желудочно-кишечного тракта, органов мочеполовой системы), где выполняют защитную функцию. Эозинофилы имеют сферическую форму, размеры в крови составляют 12 мкм, после выхода в ткани размеры эозинофилов увеличиваются до 12-14 мкм. Ядро эозинофила состоит из двух крупных сегментов, соединенных тонкой перемычкой. Цитоплазма окрашивается слабо-оксифильно, в ней находятся азурофильные гранулы и крупные ярко-оксифильные специфические гранулы. При электронной микроскопии в цитоплазме эозинофилов выявляются специфицифические гранулы овоидной формы, в центре которых располагается удлиненный кристаллоид, состоящий из главного основного белка (МВР – major basic protein). Также в специфических гранулах содержится нейротоксин (белок Х), эозинофильная пероксидаза, гистаминаза, фосфолипаза D, кислая фосфатаза, коллагеназа, цинк, катепсин. Мелкие гранулы содержат арилсульфатазу, кислую фосфатазу, пероксидазу, катионный белок эозинофилов. Эозинофилы имеют Fc-рецепторы к Fc- фрагментам IgG, IgМ и IgЕ, рецепторы комплемента. В тканях эозинофилы могут находиться в двух состояниях – активированном и неактивированном. Основными функциями эозинофилов являются уничтожение паразитов, участие в аллергических и воспалительных реакциях. Базофилы В кровеносное русло выходят зрелые формы клеток, которые составляют 0-1% от общего числа лейкоцитов, циркулирующих в крови. Базофил представляет собой клетку сферической формы диаметром 10-12 мкм. Ядро базофила состоит из нечетко выраженных трех долек, в цитоплазме клетки имеются крупные специфические гранулы, окрашивающиеся метахроматически основными красителями. В гранулах содержатся такие вещества, как гепарин, гистамин, нейтральные протеазы (триптазы, химазы), фактор хемотаксиса эозинофилов. Азурофильные гранулы содержат набор лизосомальных гидролаз, характерный для лизосом. Основная функция базофилов – участие в аллергических реакциях. При стимуляции хемокинами базофилы через эндотелий кровеносных сосудов мигрируют в очаг аллергического воспаления, где происходит их активация и дегрануляция. Существуют два пути активации базофилов в очаге аллергического воспаления: 1) IgЕ-зависимый путь активации; 2) IgЕ-независимый путь активации. Тучные клетки Тучные клетки (мастоциты), и их предшественники происходят из стволовых кроветворных клеток костного мозга. В отличие от лейкоцитов, тучные клетки не циркулируют в крови, а заканчивают свою дифференцировку в рыхлой соединительной ткани, где локализуются группами по ходу сосудов микроциркуляторного русла. Мастоциты, как и другие лейкоциты, способны к движению. Диаметр тучных клеток варьирует от 10 до 20 мкм. Ядра тучных клеток имеют округлую или овальную форму. Отличительным морфологическим признаком мастоцитов является наличие в цитоплазме крупных специфических гранул, окрашивающихся основными красителями, которые нередко маскируют ядро клеток. Мастоциты реагируют на повреждающие воздействия разного рода, участвуют в развитии воспаления, служат основными эффекторными клетками при гиперчувствительности немедленного типа и входят в первую линию иммунной защиты от многоклеточных паразитов. В отличие от базофилов, которым требуется время на миграцию из крови в ткани, тучные клетки, изначально локализующиеся в тканях, немедленно реагируют на любое повреждение, инициируя развитие реакций врожденного иммунитета. Медиаторы воспаления, выделяемые тучными клетками при активации, можно условно разделить на три группы: предсуществующие медиаторы, медиаторы липидной природы, синтезированные de novo, и цитокины. Рецепторы тучных клеток. Главной чертой тучных клеток, наряду с базофилами и эозинофилами, является наличие на плазмолемме высокоафинного Fcε-рецептора к Fc-фрагменту IgЕ. На поверхности тучных клеток имеются TLR2, TLR3, TLR4/CD14, TLR5, TLR7, TLR8, TLR9 для распознавания пептидогликана клеточной стенки бактерий, липополисахаридов, вирусных РНК и бактериальных ДНК. На поверхности тучных клеток присутствуют молекулы МНС обоих классов; наличие молекул МНС II класса и костимулирующих молекул CD86 придает мастоцитам способность выполнять функции АПК, особенно при индукции Th2-клеток. Моноциты и макрофаги Моноциты составляют 5-10% лейкоцитов периферической крови. Образуются моноциты в красном костном мозге из общего предшественника моноцитов-гранулоцитов. Моноциты крови представляют собой сферической формы клетки с ядром бобовидной формы диаметром 10-12 мкм. На окрашенных мазках крови цитоплазма моноцитов имеет светло-базофильную окраску. Моноциты циркулируют с током крови 8-12 ч, после чего выселяются в различные ткани, где дифференцируются в тканевые макрофаги. Тканевые макрофаги – это фагоциты, развивающиеся из моноцитов крови. Макрофаги способствуют поддержанию тканевого гомеостаза путем очищения организма от стареющих и апоптических клеток, участвуют в восстановлении тканей после повреждения и воспаления. Макрофаги слизистых оболочек играют ведущую роль в защите организма от инфекции. При микробной инвазии в очаг воспаления дополнительно мигрирует большое количество моноцитов, которые под влиянием цитокинов дифференцируются в воспалительные макрофаги. Все макрофаги экспрессируют большое количество PRR, снабжены кислородзависимыми и кислороднезависимыми механизмами киллинга микроорганизмов. Важной функцией макрофагов является их участие в доиммунном и иммунном воспалении. Продолжительность жизни тканевого макрофага в среднем составляет 30 дней, после чего они погибают путем апоптоза. Моноциты/макрофаги, мигрировавшие из крови в очаг воспаления, могут подвергаться: 1. Классической активации посредством цитокинов IFNγ и TNFα (направлена на элиминацию патогенных микроорганизмов) 2. Альтернативной активации посредством IL-4/IL-13. 3. Дезактивации, опосредованной IL-10 и TGFβ. Под влиянием цитокиновой стимуляции резко усиливается экспрессия макрофагом молекул МНС II класса и костимулирующих молекул (CD40, CD54, CD80/CD86). В результате этого макрофаги приобретают способность представлять АГ CD4+ Т-лимфоцитам. Дендритные клетки Дендритные клетки – это специализированные АПК, способные активировать наивные Т-клетки и Т-клетки памяти. В организме человека дендритные клетки представлены тремя субпопуляциями: миелоидные (интерстициальные), плазмоцитоидные и клетки Лангерганса. Процесс созревания дендритных клеток в очаге воспаления начинается с момента распознавания АГ. После созревания в очаге воспаления, дендритные клетки перемещаются во вторичные лимфоидные органы, где заселяются в Т- зависимые зоны. Во вторичных лимфоидных органах зрелые дендритные представляют АГ детерминанты неимунным Т-клеткам, индуцируя их дифференцировку в направлении Th1 или Th2-клеток. NK-клетки NK-клетки представляют собой большие гранулярные лимфоциты, не экспрессирующими маркеров Т- и В-клеток (таких, как CD3 и CD19). Они дифференцируются в костном мозге из общей лимфоидной клетки-предшественницы, ростовым фактором для NK-клеток является IL-15. Большинство NK-клеток содержат в цитоплазме азурофильные гранулы, в которых депонируются цитотоксические белки перфорин, гранзимы и гранулизин. NK-клетки способны спонтанно (т.е. без предварительной активации) уничтожать опухолевые клетки и клетки, инфицированные вирусами. Т-лимфоциты: строение, происхождение, дифференцировка, субпопуляции, функции.T-лимфоциты (Т-клетки) – это лимфоциты, развивающиеся у млекопитающих в тимусе из предшественников — претимоцитов, поступающих в него из красного костного мозга. Находясь в тимусе, Т-клетки приобретают поверхностные рецепторы к различным АГ, после чего выходят в кровь и заселяют периферические лимфоидные органы. Здесь эти еще незрелые клетки могут реагировать на АГ, к которым уже имеют рецепторы, пролиферацией с последующей дифференцировкой в Т-лимфоциты. Важной особенностью Т-лимфоцитов является способность распознавать только АГ презентированные (представленные) на поверхности вспомогательных АПК (дендритных, макрофагов или В-лимфоцитов) в комплексе с собственными АГ МНС. Дифференцировка Т-лимфоцитов Весь путь развития Т-лимфоцитов от СКК до зрелых Т-лимфоцитов включает несколько этапов и процессов: формирование Т-клеточного рецептора (Т-Cell Receptor – ТCR); экспрессию генов молекул, обеспечивающих проведение сигнала с ТCR внутрь клетки; экспрессию генов мембранных молекул, необходимых для взаимодействия с другими клетками (дентритными клетками, макрофагами, В-клетками); экспрессию на мембране корецепторных комплексов. В процессе дифференцировки T-лимфоцитов выделяют два основных этапа – антигензависимую и антигеннезависимую дифференцировку Антигеннезависимая дифференцировка Т-лимфоцитов Родоначальной клеткой Т-лимфоцитов, как и всех клеток крови, является полипотентная стволовая гемопоэтическая клетка. Ее маркером является молекула CD34. Предшественники Т-лимфоцитов обнаружены в островках гемопоэтической ткани эмбриональной печени на 8-й неделе внутриутробного развития. На 9-й неделе протимоциты колонизируют тимус. Еще в период эмбрионального развития в вилочковой железе создается микроокружение, имеющее значение для дифференцировки Т- лимфоцитов. В субкапсулярной зоне из протимоцитов образуются тимоциты, которые под влиянием тимических гормонов (α- и β-тимозины, тимулин, тимопоэтин, тимический гуморальный фактор), «клеток нянек», эпителиальных клеток тимуса активно пролиферируют и приступают к дальнейшей дифференцировке. По мере созревания тимоциты перемещаются в более глубокие зоны коры, где за счет реаранжировки генома у них формируются специфические рецепторы Т-клеток (TСR) для распознавания различных АГ. Причем, для каждого АГ в организме предназначен отдельный лимфоцит или его клональные дочерние лимфоциты-потомки, которые имеют специфичный АГ TСR. Кроме того, тимоциты одновременно с TСR в процессе дифференцировки приобретают специфический мембранный маркер CD3, который тесно связан с TСR. CD3 необходим для передачи сигнала от TcR в цитоплазму. Следующий важный этап созревания корковых тимоцитов – экспрессия молекул корецепторов CD4+ и CD8+, после которого они становятся двойными позитивными Т-клетками. Двойные позитивные Т- клетки проходят тимическую селекцию, состоящую из двух фаз: - первая фаза – положительная селекция; - вторая фаза – отрицательная селекция. В фазу положительной селекции тимоциты взаимодействуют с молекулами MHC I и II класса на поверхности корковых эпителиоретикулоцитов, что играет важную роль в обучении клеток распознавать «свое» и «чужое». Тимоциты, TCR которых не смогли распознать молекулы MHC I и II класса, погибают апоптозом и разрушаются макрофагами. Тимоциты, прошедшие положительную селекцию, перемещаются в мозговое вещество, где взаимодействуют с молекулами MHC I и II класса на поверхности дендритных клеток. В результате отрицательной тимической селекции формируются мозговые тимоциты, или одиночные позитивные Т-клетки, у которых сохраняется экспрессия одного из корецепторов – либо CD4+ либо CD8+. Аутореактивные Т-клетки в фазу отрицательной селекции погибают путем апоптоза и уничтожаются макрофагами. 90-95% тимоцитов не проходят тимическую селекцию и погибают в тимусе. После такой селекции путем подтверждения адекватности корецептора клетка приобретает функциональные свойства, соответствующие ее назначению. Антигензависимая дифференцировка происходит в периферических органах иммунной системы только при контакте Т- лимфоцита с АГ. Необходимо отметить, что хелперы и ЦТЛ распознают антиген по-разному. Так, CD4+Т-лимфоциты распознают АГ в комплексе с HLA II класса, CD8+Т-лимфоциты - в комплексе АГ HLA I класса. В результате взаимодействия с АГ Т-лимфоциты активируются, пролиферируют (экспансия клона), секретируют разнообразные цитокины (лимфокины), вновь поступают в кровь, а из нее - повторно в ткани (процесс рециркуляции), где они и осуществляют свои защитные функции. Часть Т-лимфоцитов превращается в долгоживущие Т-клетки памяти (с фенотипом CD45+ RO+), которые сохраняют в течение всего времени своего существования усиленную экспрессию ТCR и ряда маркеров, что определяет их высокую чувствительность к повторному воздействию данного АГ. Рециркулирующие Т-лимфоциты живут до 4-6 месяца. Т- клетки памяти сохраняются преимущественно в лимфоидных органах в течение многих лет. Т-лимфоциты выполняют следующие важные функции: - являются основными эффекторами клеточного иммунитета (эти клетки опосредуют клеточные цитотоксические реакции, а также реакции ГЗТ); - являются регуляторами воспаления, иммунных реакций и гемопоэза; - участвуют в процессах репаративной и физиологической регенерации различных тканей. Популяции Т-лимфоцитов. Субпопуляции Т-лимфоцитов. СD4 Т-лимфоциты. СD8 Т-лимфоциты. Основная функция CD4+ Т-лимфоцитов — продуцировать цитокины, активирующие функции других клеток, в связи с этим данные клетки называют помощниками (helper) и обозначают соответственно Th. Основной функцией СD8+ Т-лимфоцитов является цитотоксичность, т. е. способность убивать клетки-мишени, инфицированные соответствующим по специфичности вирусом, поэтому их называют цитотоксическими Т-лимфоцитами и обозначают CTL. 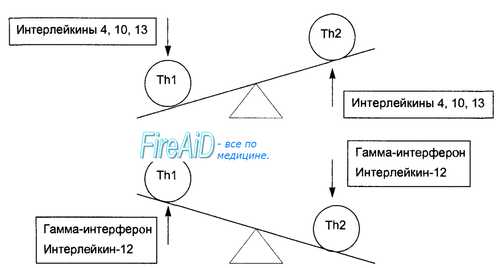 СD4+ Т-лимфоциты после распознавания антигена начинают секретировать интерлейкины (ИЛ-2, ИЛ-4), гамма-интерферон и дифференцируются в двух направлениях. Одни — Th1 — приобретают способность активировать макрофаги и участвовать в клеточном иммунном ответе. Другое направление дифференцировки ведет к формированию Th2, способных активировать В-лимфоциты к продукции соответствующих по специфичности антител, т. е. участвуют в гуморальном иммунном ответе. Каждая из двух субпопуляций Th продуцирует аутокринно и паракринно действующие цитокины, способные помешать дифференцировке и активации альтернативной субпопуляции. В-лимфоциты: строение, происхождение, дифференцировка, функции.Они образуются у эмбриона человека из стволовых клеток – в печени и костном могзге, а у взрослого человека – в костном мозге. B- лимфоциты составляют около 15-18% всех лимфоцитов, находящихся в периферической крови. После распознавания специфического АГ эти клетки размножаются и дифференцируются, трансформируясь в плазматические клетки. Плазматические клетки вырабатывают большое количество АТ (Ig), которые являются собственными рецепторами B- лимфоцитов в растворенном виде. Главной функцией В-лимфоцитов является специфическое распознавание АГ, которое ведет к их активации, пролиферации и дифференцировке в плазматические клетки-продуценты специфических АТ - иммуноглобулинов, т. е. к гуморальному иммунному ответу. Чаще всего В-лимфоциты для развития гуморального иммунного ответа нуждаются в помощи Т-лимфоцитов в виде продукции активирующих цитокинов. Дифференцировка В-лимфоцитов Созревание В-лимфоцитов в эмбриональном периоде происходит в печени. Предшественники В-лимфоцитов обнаружены в островках гемопоэтической ткани эмбриональной печени на 8-9-й неделе внутриутробного развития. После рождения исходные стволовые клетки перемещаются в костный мозг, здесь и происходит дальнейшее образование зрелых В-лимфоцитов с высокой скоростью – 100 млн. клеток в сутки. Весь путь развития В2-лимфоцитов от стволовой кроветворной клетки (СКК) до плазмоцита включает несколько стадий и процессов: формирование В-клеточного рецептора (B-Cell Receptor – BCR): экспрессию генов молекул, обеспечивающих проведение сигнала с BCR внутрь клетки; экспрессию генов мембранных молекул, необходимых для взаимодействия с другими клетками (в первую очередь с T-лимфоцитами и дентритными клетками); экспрессию на мембране корецепторных комплексов. В процессе дифференцировки В-лимфоцитов выделяют два основных этапа – антигензависимую и антигеннезависимую дифференцировку. 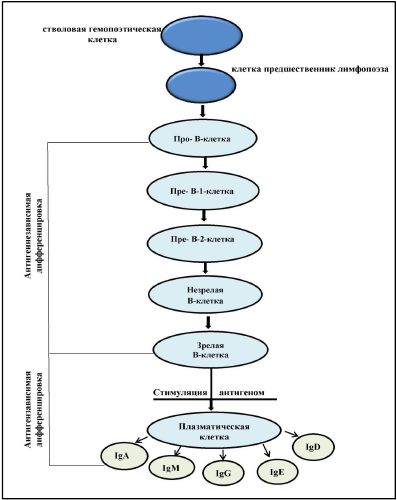 Антигеннезависимая дифференцировка B-лимфоцитов в течение всего постэмбрионального периода происходит в костном мозге под контролем клеточного мозгового микроокружения и гуморальных факторов костного мозга и не определяется контактом с АГ. На зрелых В-лимфоцитах поверхностные Ig-молекулы представлены IgM и IgD. Рецепторы: BCR, MHC I & II, цитокиновые В костном мозге в процессе развития В-лимфоцитов происходит селекция клонов, способных реагировать только на чужеродные АГ. Клетки, экспрессирующие Ig рецепторы к своим собственным АГ, либо погибают в результате запуска механизма апоптоза, либо переходят в состояние ареактивности (анергии). Антигензависимая стадия развития B-лимфоцитов начинается с момента контакта этих клеток с Аг (в том числе - аллергеном). В результате происходит активация B-лимфоцитов, протекающая в два этапа: пролиферации и дифференцировки. Пролиферация B-лимфоцитов обеспечивает два важных процесса: 1. Увеличение числа клеток, дифференцирующихся в плазматические клетки, продуцирующие АТ (Ig). Плазматические клетки это результат конечной дифференцировки В-лимфоцитов. Они не имеют на наружной мембране рецепторов для АГ, осуществляют интенсивный синтез Ig-ов 2. Образование В-лимфоцитов иммунологической памяти. Эти клоны B-клеток представляют собой долгоживущие рециркулирующие малые лимфоциты. Они не превращаются в плазматические клетки, но сохраняют иммунную «память» об АГ. Клетки памяти активируются при повторной их стимуляции тем же самым АГ. Таким образом, обладая функциями клеток адаптивного иммунитета, В2-лимфоциты играют важную роль в гуморальном иммунном ответе, а именно: - способны дифференцироваться в плазматические клетки и продуцировать АТ, которые обеспечивают эффективную защиту от внеклеточных паразитов (бактерий) и токсинов; - выполняют роль АПК; -продуцируют IL-12, который активирует NК-клетки и «наивные» Т- лимфоциты; - участвуют в регуляции гемостаза. Функции NK-клеток, макрофагов, дендритных клеток, нейтрофилов.NK-клетки NK-клетки представляют собой большие гранулярные лимфоциты, не экспрессирующими маркеров Т- и В-клеток (таких, как CD3 и CD19). Они дифференцируются в костном мозге из общей лимфоидной клетки-предшественницы, ростовым фактором для NK-клеток является IL-15. Большинство NK-клеток содержат в цитоплазме азурофильные гранулы, в которых депонируются цитотоксические белки перфорин, гранзимы и гранулизин. NK-клетки способны спонтанно (т.е. без предварительной активации) уничтожать опухолевые клетки и клетки, инфицированные вирусами. Моноциты и макрофаги Моноциты составляют 5-10% лейкоцитов периферической крови. Образуются моноциты в красном костном мозге из общего предшественника моноцитов-гранулоцитов. Моноциты крови представляют собой сферической формы клетки с ядром бобовидной формы диаметром 10-12 мкм. На окрашенных мазках крови цитоплазма моноцитов имеет светло-базофильную окраску. Моноциты циркулируют с током крови 8-12 ч, после чего выселяются в различные ткани, где дифференцируются в тканевые макрофаги. Тканевые макрофаги – это фагоциты, развивающиеся из моноцитов крови. Макрофаги способствуют поддержанию тканевого гомеостаза путем очищения организма от стареющих и апоптических клеток, участвуют в восстановлении тканей после повреждения и воспаления. Макрофаги слизистых оболочек играют ведущую роль в защите организма от инфекции. При микробной инвазии в очаг воспаления дополнительно мигрирует большое количество моноцитов, которые под влиянием цитокинов дифференцируются в воспалительные макрофаги. Все макрофаги экспрессируют большое количество PRR, снабжены кислородзависимыми и кислороднезависимыми механизмами киллинга микроорганизмов. Важной функцией макрофагов является их участие в доиммунном и иммунном воспалении. Продолжительность жизни тканевого макрофага в среднем составляет 30 дней, после чего они погибают путем апоптоза. Моноциты/макрофаги, мигрировавшие из крови в очаг воспаления, могут подвергаться: 1. Классической активации посредством цитокинов IFNγ и TNFα (направлена на элиминацию патогенных микроорганизмов) 2. Альтернативной активации посредством IL-4/IL-13. 3. Дезактивации, опосредованной IL-10 и TGFβ. Под влиянием цитокиновой стимуляции резко усиливается экспрессия макрофагом молекул МНС II класса и костимулирующих молекул (CD40, CD54, CD80/CD86). В результате этого макрофаги приобретают способность представлять АГ CD4+ Т-лимфоцитам. Дендритные клетки Дендритные клетки – это специализированные АПК, способные активировать наивные Т-клетки и Т-клетки памяти. В организме человека дендритные клетки представлены тремя субпопуляциями: миелоидные (интерстициальные), плазмоцитоидные и клетки Лангерганса. Процесс созревания дендритных клеток в очаге воспаления начинается с момента распознавания АГ. После созревания в очаге воспаления, дендритные клетки перемещаются во вторичные лимфоидные органы, где заселяются в Т- зависимые зоны. Во вторичных лимфоидных органах зрелые дендритные представляют АГ детерминанты неимунным Т-клеткам, индуцируя их дифференцировку в направлении Th1 или Th2-клеток. Нейтрофилы. Нейтрофилы, циркулирующие в периферической крови, составляют 60-70% от общего количества лейкоцитов. Образуются нейтрофилы в костном мозге, являясь продуктом миелоидного кроветворения. По степени зрелости нейтрофилы делятся на сегментоядерные, палочкоядерные и юные формы. Костный мозг покидают дефинитивные формы дифференцировки клеток – сегментоядерные нейтрофилы, но в небольшом количестве (1-6%) в периферический кровоток могут выходить палочкоядерные нейтрофилы и юные нейтрофилы (0,5%). После выхода из костного мозга нейтрофилы циркулируют с током крови 8-12 часов, после чего выходят в ткани, где живут 2-3 дня и погибают путем апоптоза. В очаге воспаления продолжительность жизни нейтрофилов резко сокращается и составляет 1- 4 часа. В цитоплазме клеток обнаруживаются три типа гранул: первичные гранулы (азурофильные), вторичные гранулы (специфические) и секреторные везикулы. Азурофильные гранулы представляют видоизмененные первичные лизосомы, содержащие набор гидролитических ферментов (кислых протеаз и гидролаз). Специфические гранулы по химическому составу отличаются от азурофильных гранул, и сливаются с фагосомой уже после азурофильных гранул. Маркером специфических гранул является белок лактоферрин. Секреторные везикулы необходимы нейтрофилам для восстановления цитоплазматической мембраны, утраченной в процессе фагоцитоза. Основная функция нейтрофильных гранулоцитов – фагоцитоз и участие в воспалительных реакциях. Нейтрофильные гранулоциты первыми приходят в очаг воспаления и обнаруживаются там уже через 30-60 минут. Главным хемоаттрактантом для нейтрофилов является хемокин IL-8, под влиянием которого они мигрируют в очаг воспаления. Общая характеристика молекул иммунной системы. |
