Физическая и Коллоидная химия. Ответы к контрольным вопросам к лекции №2_Полшкова_ОРНз-19-02. Дайте определение понятия теплоемкость
 Скачать 79.06 Kb. Скачать 79.06 Kb.
|
|
Дайте определение понятия «теплоемкость». Теплоемкость – физическая величина, характеризующая количество теплоты, подведенное (отведенное) к термодинамической системе необходимое для изменения ее температуры на 1 Кельвин. Является ли теплоемкость функцией состояния. Поскольку теплота является функцией процесса, то и теплоемкость есть функция процесса, т.е. не является функцией состояния. Может ли теплоемкость вещества иметь отрицательное значение, быть равной нулю или бесконечности? Числено теплоемкость изменяется в пределах от -∞ до +∞. Теплоемкость может иметь отрицательное значение для определенного типа процессов. Из определения теплоемкости следует, что одно и то же вещество может иметь множество теплоёмкостей в зависимости от вида процесса, так как количество теплоты является функцией процесса. Кроме того, теплоемкость может иметь отрицательное значение, когда знаки теплоты и изменения температуры различны. При изотермическом процессе система получает тепло При адиабатическом процессе система не получает и не отдает тепла Какие виды теплоемкости Вы знаете? Различают теплоемкость среднюю и истинную. Средней теплоемкостью называют количество теплоты, необходимое для нагревания единицы массы вещества на 1 К. Так как теплоемкость зависит от массы вещества, то различают удельную, Дж/(кг К), и молярную, Дж/(моль К), теплоемкости. Удельной средней теплоемкостью называется количество теплоты, необходимое для нагревания единицы массы вещества на 1 К, а молярной теплоемкостью — количество теплоты, необходимое для нагревания одного моля вещества на 1 К. Истинной теплоемкостью называют отношение бесконечно малого количества теплоты к бесконечно малому приращению температуры. С использованием какой теплоемкости расчет теплоты процесса можно провести точнее? Для более точных расчетов теплового эффекта следует использовать значения истинных теплоемкостей. Какая из теплоемкостей воды в твердом, жидком или газообразном состояниях имеет наибольшее значение при комнатной температуре и почему? Удельная теплоемкость — это физическая величина, которая используется для расчета количества теплоты, необходимого для нагревания вещества до определенной температуры. Вода обладает большой теплоемкостью. Это значит, что существенное увеличение тепловой энергии вызывает лишь сравнительно небольшое повышение ее температуры. Удельная теплоемкость жидкости больше, чем у этого же вещества в твердом состоянии, так как между ними лежит фазовый переход (плавление). Какими эмпирическими уравнениями зависимости теплоемкости от температуры пользуются при выводе интегрального уравнения Кирхгофа? Какова область (р и Т) применения этих эмпирических уравнений? С изменением температуры изменяются энтальпии веществ, участвующих в реакции, а поэтому изменяется и тепловой эффект реакции. При p=const изменение энтальпии (а для v=const соответственно энергии) можно оценить, зная, как теплоемкость Cp (или Cv) зависят от температуры. Чтобы вывести соответствующее уравнение проведем дифференцирование по температуре выражения для энтальпии реакции: и в результате получим: 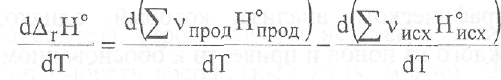 Учитывая определительное уравнение для теплоемкости, можем записать: Таким образом, температурный коэффициент теплового эффекта химической реакции, осуществляемой в условиях постоянства давления, равен разности сумм изобарных теплоёмкостей продуктов и исходных веществ с учетом стехиометрических коэффициентов в уравнении химической реакции. Это выражение называют уравнением Кирхгофа в дифференциальной форме. Применительно к процессам, протекающим при постоянном объеме, уравнение приобретает вид: Интегрирование уравнения Кирхгофа осуществляют от базисной до требуемой температуры. Для расчета теплового эффекта реакции при любой температуре пользуются интегральной формой уравнения Кирхгофа. ∆H2 = ∆H1 + 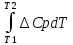 ∆U2 = ∆U1 + 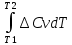 Закон Кирхгофа позволяет установить характер зависимости теплового эффекта химической реакции от температуры и рассчитать тепловой эффект химической реакции при любой заданной температуре. Может ли изменение теплоемкости химической реакции иметь отрицательное значение, быть равной нулю или бесконечности? ∆Cp > 0, (∂∆Hr /∂T)p > 0 ∆Cp < 0, (∂∆Hr /∂T)p < 0 ∆Cp = 0, (∂∆Hr /∂T)p = 0 При каких условиях тепловой эффект химической реакции не зависит от температуры? Случай, когда тепловой эффект не зависит или почти не зависит от от температуры, является исключительным. При этом теплоемкость продуктов реакции должна быть равна теплоемкости исходных веществ. Такое соотношение теплоемкостей довольно часто наблюдается при комнатных температурах у многих твердых тел, если их рассматривать как соединение элементов, также взятых в твердом состоянии. Почему для расчета изменения энтропии в необратимых процессах пользуются уравнениями, выведенными для обратимых процессов? Для необратимых процессов dS > δQ/T. Но энтропия – функция состояния и ее изменение не зависит от пути процесса, а определяется конечным и начальным состоянием системы. Если из состояния 1 система перешла в состояние 2 один раз обратимо, а другой раз необратимо, то dSобр = dSнеобр. Теплота же обратимого процесса δQобр > δQнеобр. Поэтому для вычисления изменения энтропии в необратимом (неравновесном) процессе его следует заменить процессом, протекающем через ряд обратимых стадий, причем начальное и конечное состояния в обоих процессах должны совпадать. Например, необходимо определить изменение энтропии при замерзании 1 моля переохлажденной воды при 263,15 К и давлении 1 атм. Так как переохлажденная жидкость не может находиться в равновесии с твердой фазой при этой температуре и давлении, то этот процесс является необратимым. Следовательно, вычислить изменение энтропии по теплоте кристаллизации воды при 263,15 К нельзя. Но необратимый процесс кристаллизации переохлажденной воды можно мысленно заменить следующими тремя квазистатическими процессами: 1. Нагревание 1 моль переохлажденной воды от 263,15 К до 273,15 К. В этом процессе изменение энтропии ΔS1 будет равно 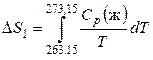 . .2. Обратимая кристаллизация воды при температуре плавления льда 273,15 К: где 3. Обратимое охлаждение льда от 273,15 К до 263,15 К, тогда 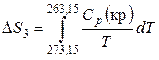 . .В результате изменение энтропии при кристаллизации переохлажденной воды при 263,15 К будет равно ΔS = ΔS1 + ΔS2 + ΔS3. Может ли энтропия вещества быть отрицательной? Может ли изменение энтропии реакции быть отрицательной величиной? Энтропия, есть мера вероятности данного состояния системы и отрицательной быть не может. Обычно все реакции идут от менее вероятного к более вероятному состоянию, поэтому энтропия в них возрастает. Если в результате реакции образуется состояние с меньшей термодинамической вероятностью, то энтропия уменьшится. Система при этом должна быть незамкнутой. Но состояние системы после такой реакции будет менее стабильным, чем до. Изменение энтропии может быть отрицательным, тогда реакция несамопроизвольна при любых температурах, обратная реакция самопроизвольна Всегда ли совпадают по направлению две тенденции — стремление к минимуму энергии и к максимуму энтропии? Ответ обоснуйте, подсчитав изменение энтропии для трех процессов, протекающих с выделением тепла при температуре 298 К Изменение энтропии ΔS — и еще один критерий — стремление системы к максимуму энтропии. Совершенно очевидно, что две тенденции - стремление к минимуму энергии и к максимуму энтропии - могут не совпадать по направлению действия. Так, в трех экзотермических реакциях  изменение энтропии существенно различно: положительно, отрицательно и близко к нулю. Пример: аА+вВ=сС+d D Формула: ΔS°298 = (cS°298(C) + dS°298 (D)) - (aS0298(А) + bS°298(B)) где S°298 – энтропия образования простого вещества (табличная величина), a, b, с, d – коэффициенты в уравнении реакции Пример 1. CH4(г)+2O2(г)=CO2(г)+2H2O(ж)+Q S°298(CH4)=186,19 Дж/моль*К; S°298(O2)=205,00 Дж/моль*К; S°298(CO2)=213,60 Дж/моль*К; S°298(H2O)=69,96 Дж/моль*К; ΔS°298 =213,60+2*69,96-(186,19+205,00)=-37,67 Дж/моль*К. Пример 2. H2(г)+Cl2(г)=2HCl(г)+Q S°298(H2)=130,60 Дж/моль*К; S°298(Cl2)=223,00 Дж/моль*К; S°298(HCl)=186,70 Дж/моль*К; ΔS°298 =2*186,70-(130,60+223,00)=19,80 Дж/моль*К. Пример 3. H2SO4(ж)+2NaOH(к)=Na2SO4(к)+2H2O(ж)+Q S°298(H2SO4)=156,90 Дж/моль*К; S°298(NaOH)=64,40 Дж/моль*К; S°298(Na2SO4)=149,50 Дж/моль*К; S°298(H2O)=69,96 Дж/моль*К; ΔS°298 =149,50+2*69,96-(156,90+2*64,40)=3,72 Дж/моль*К. |
