Дайте определение поверхностных явлений, как классифицируют поверхности раздела фаз Поверхностные явления
 Скачать 213.81 Kb. Скачать 213.81 Kb.
|
|
1. Дайте определение поверхностных явлений, как классифицируют поверхности раздела фаз? Поверхностные явления – это процессы, происходящие на границе раздела фаз и обусловленные особенностями состава и строения поверхностного слоя. К поверхностным явлениям относятся, например, поверхностное натяжение, сорбция, адгезия, капиллярная конденсация. Поверхности раздела бывают: - подвижные (между жидкостью и газом (ж-г), между двумя несмешивающимися жидкостями (ж-ж)), - неподвижные (между твердым телом и жидкостью (т-ж), твердым телом и газом (т-г), двумя твердыми телами (т-т)). 2. Дайте определение поверхностного натяжения, перечислите факторы, влияющие на поверхностное натяжение жидкости на границе с газом. Поверхностное натяжение - это величина, измеряемая энергией Гиббса, приходящейся на единицу поверхностного слоя. Численно равна работе, которую необходимо совершить для образования единицы поверхности раздела фаз при постоянной температуре. Поверхностное натяжение биологических жидкостей используют в диагностических целях. Например, поверхностное натяжение плазмы крови подвержено значительным колебаниям при различных заболеваниях. С возрастом поверхностное натяжение сыворотки крови уменьшается. Поверхностное натяжение играет значительную роль в таких процессах, как деление клеток, фагоцитоз, пиноцитоз, изменение проницаемости клеточных мембран и др 3. Как влияет природа жидкости, давление и температура на поверхностное натяжение жидкости на границе с газом? С увеличением температуры поверхностное натяжение всегда уменьшается. Это связано: а) с усилением теплового движения молекул, что ведёт к ослаблению межмолекулярного взаимодействия, уменьшения внутреннего давления и как следствие, уменьшению σ. б) с другой стороны, увеличивается давление насыщенного пара Ро , что ведет к увеличению концентрации молекул в газовой фазе, к уменьшению нескомпенсированности сил на поверхности раздела фаз и уменьшению поверхностного натяжения. чем выше давление и температура, тем меньше поверхностное натяжениие чем сильнее межмолекулярные силы, тем больше поверхностное натяжение 4. Дайте определение поверхностной активности, какие вещества различают по поверхностной активности? Поверхностная активность – это способность растворенного вещества изменять поверхностное натяжение: 1. Поверхностно-активные вещества (ПАВ) понижают поверхностное натяжение растворителя ( ), концентрация растворенных веществ в поверхностном слое больше, чем в объеме раствора, к ПАВ относятся многие органические вещества: спирты, кислоты алифатического ряда, сложные эфиры, белки; 2. Поверхностно-инактивные вещества (ПИВ) незначительно повышают поверхностное натяжение растворителя ( ), концентрация растворенных веществ в поверхностном слое меньше, чем в объеме раствора, к ПИВ относятся: неорганические кислоты, основания и соли, некоторые органические соединения, такие как глицерин, α-аминокислоты и др.; 3. Поверхностно неактивные вещества (ПНВ) практически не изменяют поверхностного натяжения растворителя ( ), к ним относятся: сахароза и др. 5. Дайте определение ПАВ, приведите пример ПАВ, на этом примере объясните особенности его строения. 1. Поверхностно-активные вещества (ПАВ) понижают поверхностное натяжение растворителя ( ), концентрация растворенных веществ в поверхностном слое больше, чем в объеме раствора, к ПАВ относятся многие органические вещества: спирты, кислоты алифатического ряда, сложные эфиры, белки; 6. Дайте определение ПИВ и ПНВ, изобразите для них изотермы поверхностной активности. 2. Поверхностно-инактивные вещества (ПИВ) незначительно повышают поверхностное натяжение растворителя ( ), концентрация растворенных веществ в поверхностном слое меньше, чем в объеме раствора, к ПИВ относятся: неорганические кислоты, основания и соли, некоторые органические соединения, такие как глицерин, α-аминокислоты и др.; 3. Поверхностно неактивные вещества (ПНВ) практически не изменяют поверхностного натяжения растворителя ( ), к ним относятся: сахароза и др. 7. Сформулируйте правило Дюкло – Траубе, изобразите изотермы поверхностной активности для веществ подчиняющихся этому правилу. Влияние природы ПАВ на поверхностную активность описывается правилом Дюкло-Траубе: Поверхностная активность ПАВ в разбавленных водных растворах при одинаковой молярной концентрации увеличивается в 3-3,5 раза при удлинении гидрофобной части на одну метиленовую группу (СН3 ). 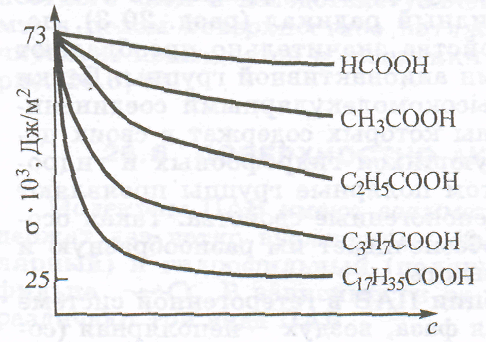 Поверхностно-активные вещества благодаря дифильным свойствам играют исключительно важную роль в природе, так как позволяют совместить между собой гидрофильные и гидрофобные системы. Именно с помощью ПАВ в живых организмах обеспечивается гидрофильно-липофильный гомеостаз. 8. Приведите классификацию ПАВ по способности к диссоциации. Классификация ПАВ: 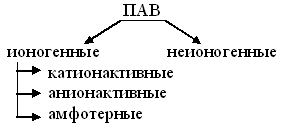 9. Дайте определение адсорбции, приведите формулу для ее расчета, и единицы измерения адсорбции. Абсорбция – процесс поглощения газов жидкими носителями – абсорбентами. Абсорбция применяется для очистки коксовых газов, от NH3, очистки коксовых газов от Н2S, SO2, и т.д. (получение HCl, H2SО4, HNO3) 10. Дайте определение адсорбента и адсорбата, приведите пример полярных и не полярных адсорбентов. Если поглощаемое вещество концентрируется на поверхности раздела контактирующих фаз, то процесс сорбции носит название адсорбция (соответственно поглотитель – адсорбент, поглощаемое вещество – адсорбат), если поглощаемое вещество распределяется по всему объему вещества поглотителя, то говорят об абсорбции (поглотитель – абсорбент, поглощаемое вещество – абсорбат). Абсорбент — жидкость или твердое тело, поглощающее газ или растворенное вещество во всем своем объеме. 11. Дайте определение дисперсной системы. Как классифицируют дисперсные системы по размеру частиц дисперсной фазы и по взаимодействию между фазами? Дисперсной называют систему, состоящую из дисперсной фазы – совокупности раздробленных частиц и непрерывной дисперсионной среды, в которой во взвешенном состоянии находятся эти частицы. Классификация дисперсных систем по степени дисперсности: · грубодисперсные (микрогетерогенные) системы – размер частиц дисперсной фазы более · коллоидно-дисперсные (ультрамикрогетерогенные) системы – размер частиц 12. Как классифицируют дисперсные системы по агрегатному состоянию фаз? В чем заключаются отличия истинных растворов и дисперсных систем? 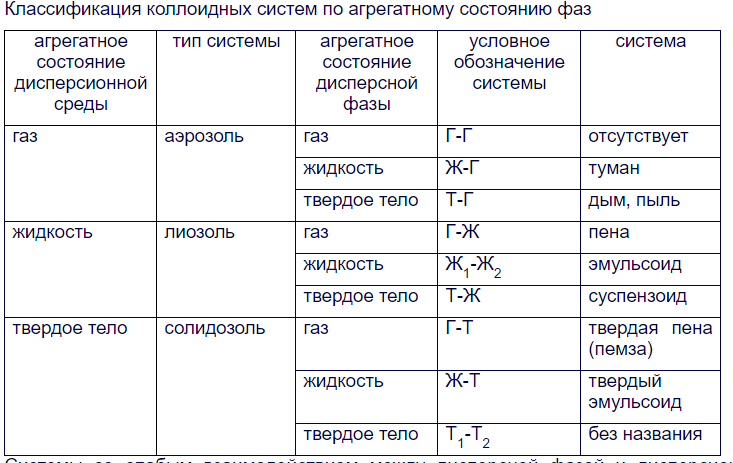 13. Охарактеризуйте состав и свойства грубодисперсных систем: аэрозолей, лиозолей. Приведите примеры. Аэрозоли (см.) представляют собой взвеси твердых (дым и пр.) или жидких (туман и пр.) коллоидных частиц в газообразной дисперсионной среде, напр, в воздухе Лиозоли (греч, лиос жидкость), называемые также коллоидными р-рами (см. Коллоиды), являются взвесями газообразных, жидких или твердых мицелл в жидкой дисперсионной среде. 14. Какими методами получают коллоидные растворы? Подробно поясните метод химической конденсации и пептизации. Методы получения лиофобных коллоидных растворов: · диспергационные механическое дробление измельчение с помощью ультразвука электрическое диспергирование химическое диспергирование · конденсационные физическая конденсация (замена растворителя) химическая конденсация (реакции гидролиза, окисления, восстановления, конденсации) Лиофильные коллоидные растворы получаются самопроизвольно из истинных растворов ПАВ и ВМС за счет ассоциации молекул при повышении их концентрации. 15. Охарактеризуйте методы очистки золей: фильтрация, диализ, ультрафильтрация. С какой целью проводят очистку коллоидных растворов? Фильтрацию используют для очистки коллоидных растворов от примесей грубодисперсных частиц (коллоидные частицы способны проходить через фильтр). Диализ – это процесс очистки коллоидных растворов от ионов и молекул низкомолекулярных примесей в результате их диффузии в чистый растворитель сквозь полупроницаемую мембрану. Электродиализ – это диализ в условиях наложения постоянного электрического поля, под действием которого катионы и анионы приобретают направленное движение к электродам. Компенсационный диализ применяют когда необходимо освободить коллоидный раствор лишь от части низкомолекулярных примесей. В этом случае растворитель в диализаторе заменяют раствором низкомолекулярных веществ, которые необходимо оставить в коллоидном растворе. Разновидностью компенсационного диализа является вивидиализ (от лат. vivus – живой). На этом принципе основано действие искусственной почки. Ультрафильтрация – «диализ под давлением», «продавливание» разделяемой смеси через фильтры с порами, пропускающими только молекулы и ионы низкомолекулярных веществ. Применяется для очистки систем, содержащих частицы коллоидных размеров (золи, растворы ВМС, взвеси бактерий и вирусов). 16. Охарактеризуйте молекулярно-кинетические свойства золей: броуновское движение, осмотическое давление. Бро́уновское движе́ние — беспорядочное движение микроскопических видимых взвешенных в жидкости или газе частиц твёрдого вещества, вызываемое тепловым движением частиц жидкости или газа. Броуновское движение никогда не прекращается. Броуновское движение связано с тепловым движением, но не следует смешивать эти понятия. Броуновское движение является следствием и свидетельством существования теплового движения. Осмотическое давление (обозначается π) — избыточное гидростатическое давление на раствор, отделённый от чистого растворителя полупроницаемой мембраной, при котором прекращается диффузия растворителя через мембрану (осмос). Это давление стремится уравнять концентрации обоих растворов вследствие встречной диффузии молекул растворённого вещества и растворителя. 17. Охарактеризуйте оптические свойства золей. Сравните оптические свойства истинных растворов, золей и грубодисперсных систем. Золь (также лиозоль, коллоидный раствор, англ. sol от лат. solutio — раствор) — высокодисперсная коллоидная система (коллоидный раствор) с жидкой (лиозоль) или газообразной (аэрозоль) дисперсионной средой, в объёме которой распределена другая (дисперсная) фаза в виде капелек жидкости, пузырьков газа или мелких твёрдых частиц, размер которых лежит в пределе от 1 до 100 нм (10−9—10−7м)[1]. 18. Дайте определение электрическим свойствам коллоидов. Чем объясняется устойчивость золей во времени? Электрические свойства коллоидных растворов или электрокинетические явления обусловлены наличием электрического заряда, как у коллоидных частиц, так и у дисперсионной среды. Это приводит к тому, что при наличии внешней разности электрических потенциалов происходит направленное перемещение заряженных коллоидных частиц и самой дисперсионной среды. В первом случае явление называется электрофорезом, а во втором – электроосмосом. Возможно, также, и самопроизвольное возникновение разности потенциалов в объёме коллоидного раствора в результате частичного оседания более тяжёлых и одноимённо заряженных коллоидных частиц. Возникающий в таких случаях скачок электрического потенциала между придонными и более высокими слоями жидкости называется потенциалом оседания. При течении коллоидных растворов через тонкие капилляры разность потенциалов может возникать и за счёт избирательной сорбции поверхностью капилляров частиц с определённым электрическим зарядом. Это – потенциал течения. 19. Дайте определение коагуляции. Каковы причины коагуляции и факторы, её вызывающие? Охарактеризуйте стадии коагуляции. Когуляция (от лат. coagulum –сгусток) – слипание коллоидных частиц с образованием более или менее крупных агрегатов. Коагуляция – проявление термодинамической неустойчивости дисперсных систем. Процесс укрупнения коллоидных частиц связан с потерей агрегативной устойчивости и приводит к потере ими кинетической устойчивости, которая выражается в образовании осадка. Коагуляция в разбавленных системах приводит к образованию хлопьев, выпадающих в осадок (или всплывающих), тогда как в концентрированных системах может также привести к возникновению сплошной пространственной структуры – геля. В ряде случаев свежий коагулят под влиянием механического воздействия (напр., перемешивания) или образования адсорбционных слоёв при добавлении некоторых веществ (пептизаторов) способен к обратному переходу в состояние золя. Это явление называется пептизацией. 20. Дайте определение порога коагуляции. Что такое коагулирующая способность? Сформулируйте правило Шульце-Гарди. Наименьшая концентрация электролита, вызывающая коагуляцию за определённый (обычно короткий) промежуток времени, называется порогом коагуляции (γ). Для различных электролитов величины порогов коагуляции могут сильно варьировать. Теоретически показано, что отношения порогов коагуляции у одно-, двух- и трёх-зарядных ионов при прочих равных условиях обратно пропорциональны шестой степени величины заряда. В среднем можно считать, что концентрации электролитов, соответствующие порогу коагуляции, с однозарядными ионами в 60 раз выше, чем с ионами двухзарядными, и приблизительно в 750 раз выше, чем с ионами трехзарядными (правило Шульца и Гарди). Правило Шульце-Гарди: коагуляцию коллоидных растворов вызывает не весь электролит, а только тот его ион, который противоположен по заряду гранулы. Причем чем выше заряд коагулирующего иона, тем меньше этого вещества необходимо для коагуляции. |
