19 Неделя Лебедев Лев_. Дериватография. Применение дериватографии
 Скачать 165.25 Kb. Скачать 165.25 Kb.
|
|
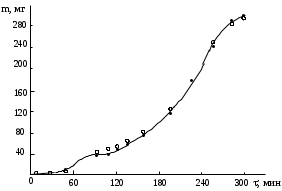
Термическая деструкция фенолформальдегидной смолы Кривая выделения летучих веществ при термическом разложении фенолформальдегидной смолы обнаруживает две основных стадии процесса (рис. 7) при скорости нагрева 2,5 К/мин и mmax=297 мг.
В данном случае процесс представляется двухстадийным, при этом первая и вторая брутто-стадии не могут быть достаточно четко разделены во времени. Важно отметить, что в этом случае систему уравнений (2) в принципе нельзя применять для расчета, так как на второй стадии m1 m1max, по крайней мере, на ее начальном участке. Однако для предварительной оценки параметров деструкции на каждой стадии можно использовать точки кривой, удаленные от области перегиба. В нашем случае будем рассматривать на первой стадии интервал потери массы 10—40 мг, на второй — 90—297 мг. Зададимся приближенной величиной m1max=60 мг. Тогда m2max составит 297 — 60 = 237 мг. После подбора значений lnk0 и E/R на каждой стадии дифференциальным методом и уточнения их интегральным методом, они оказались равными: а1= 3,7; b1= 3900 K; а2= 4,2; b2= 7700 K, а Z2 = 77 мг2. Из рис. 7 видно, что расчетные значения потери массы завышены в области точки перегиба. В таком случае можно достичь улучшения описания кривой, уменьшив максимальное выделение летучих на первой стадии, например до 50 мг, с увеличением m2max до 247 мг. Расчет активационных параметров стадий при таком распределении привел к следующим значениям: а1= 3,7; b1= 3600 K; а2= 4,2; b2= 7700 K; Z2 = 33 мг2. В этом случае расчетные величины потери массы практически совпали с их экспериментально полученными значениями. Термическая деструкция газового угля Г17 Кривая термической деструкции газового угля была получена при = 3 К/мин. Результаты представлены на рис. 8.
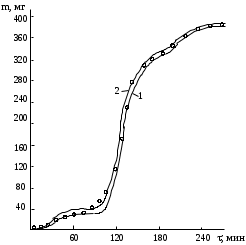
В данном случае имеют место три стадии разложения исходного вещества, причем третья стадия выражена достаточно слабо. Казалось бы, термическое разложение угля можно было бы описать системой двух уравнений, как и деструкцию полимера. Однако это оказалось невозможным даже на стадии дифференциальной обработки. В связи с этим система уравнений (1) была дополнена третьим членом: 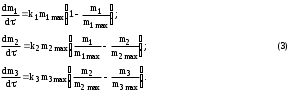 После предварительной оценки активационных параметров деструкции дифференциальным методом на каждой из стадий было проведено интегрирование системы (3) с минимизацией остаточной суммы квадратов Z2. В результате получили следующие значения (табл. 3). Таблица 3 Кинетические параметры термической деструкции угля Г17, Z2=115 мг2
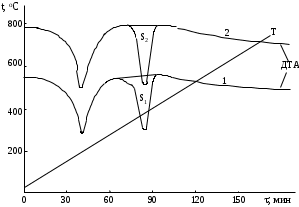
Как видно из рис. 8, расчетные и экспериментальные значения mi в ряде точек заметно различаются, поэтому для проверки адекватности полученного описания были поставлены параллельные опыты по деструкции угля Г17 в тех же начальных условиях. Один из этих опытов приведен на рис. 8 (кривая 2). Очевидно, что расхождение результатов в опытах на воспроизводимость превышает среднее отклонение экспериментальных и расчетных данных, таким образом предлагаемый метод расчета позволяет с удовлетворительной точностью описать кривую выделения летучих веществ в ходе дериватографического анализа, а тем самым и кривую ТГ. Определение теплового эффекта стадий термического разложения Качественная оценка кривой ДТА позволяет установить наличие и знак тепловых эффектов в ходе термодеструкции. Максимум кривой ДТА говорит о протекании экзотермической, а минимум — эндотермической реакции. Иногда наблюдаются пики на кривой ДТА, не сопровождающиеся потерей массы. В этом случае речь идет о превращениях физических, например, о плавлении пробы. Возможны также и химические процессы, не сопровождающиеся изменением массы образца. Анализ формы и характера пиков ДТА достаточно сложен и часто не позволяет полностью разграничивать химические и физико-химические взаимодействия. Расшифровка кривой ДТА в случае анализа ТГИ осложнена еще и тем, что при их термодеструкции протекает большое количество практически не поддающихся разграничению процессов. Поэтому бывает трудно, а иногда и невозможно установить нулевую линию дифференциальной кривой и, соответственно, величину и знак тепловых эффектов. Тепловые эффекты стадий определяются по площади, ограниченной нулевой линией ДТА и самой кривой, но обычно не прямым измерением этой площади, а путем ее сравнения с площадью пика, находящегося в близком температурном интервале, для реакции эталонного вещества с известным тепловым эффектом, определенным в тех же условиях термогравиметрического анализа. При этом считают, что существует пропорциональная зависимость: 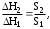 где H и S — соответственно тепловой эффект и площадь пика для известного (1) и испытуемого(2) образцов. Определение теплового эффекта термической деструкции оксалата кобальта Рассмотрим способ определения теплового эффекта реакции по данным дериватографического анализа на простом примере термического разложения солей щавелевой кислоты. Известно, что оксалат никеля NiC2O4 разлагается без доступа кислорода в температурном интервале 370-390оС с образованием металлического никеля и углекислого газа. H этой реакции составляет 390 кДж/моль. Разложение оксалата кобальта CoC2O4 в тех же условиях также приводит к металлическому кобальту и СО2. Надо определить тепловой эффект деструкции CoC2O4, анализируя пики кривых ДТА. На рис. 9 приведены кривые ДТА для оксалатов кобальта и никеля, полученные при скорости подъема температуры 5 К/мин. Анализу подвергались кристаллогидраты этих солей NiC2O4·2Н2О и CoC2O4·2Н2О. Как видно из рисунка, обе кривые ДТА обнаруживают два пика, характерных для эндотермических тепловых эффектов. Пики, относящиеся к области температур до 200оС, обусловлены тепловым эффектом реакции дегидратации: МС2О4·2Н2ОМС2О4+2Н2О, тепловые эффекты в области до 400 оС обусловлены деструкцией безводных солей: МС2О4М+2СО2.
Как видно из рисунка, обе кривые ДТА обнаруживают два пика, характерных для эндотермических тепловых эффектов. Пики, относящиеся к области температур до 200оС, обусловлены тепловым эффектом реакции дегидратации: МС2О4·2Н2ОМС2О4+2Н2О, тепловые эффекты в области до 400 оС обусловлены деструкцией безводных солей: МС2О4М+2СО2. В идеальном случае пики должны быть ограничены горизонтальной линией, как показано на рис. 2, однако на практике горизонтальная линия, отвечающая скорости подъема температуры бывает плохо определена даже в столь простом случае, как в рассматриваемом нами. Тогда для измерения площади пики ограничивают некоторыми условными линиями (на рис. 9 показаны пунктирами) и измеряют площадь образовавшихся фигур. В данном случае площадь пика S1 составила 182 мм2, площадь пика S2 — 204 мм2, отсюда 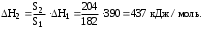 | ||||||||||||||||||||||||||